
- •0Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Хімічна кінетика
Мета роботи - вивчення впливу концентрації реагуючих речовин на швидкість хімічної реакції.
Загальні вказівки
При виконанні даної роботи необхідно знати, що швидкість хімічної реакції визначається зміною концентрацій речовин, які вступають в реакцію або утворюються в результаті реакції, за одиницю часу в одиниці об’єму для гомогенних реакцій або на одиниці поверхні поділу фаз в гетерогенних реакціях. Знайдена таким чином швидкість є середньою швидкістю реакції за певний проміжок часу:
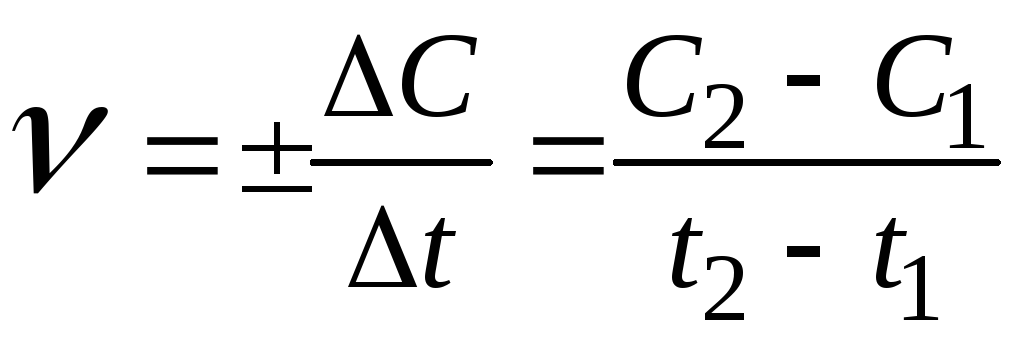 ,
,
де
![]() и
и
![]() - концентрації будь-якої з речовин у
моменти часу
- концентрації будь-якої з речовин у
моменти часу
![]() .
.
Необхідно пам’ятати, що швидкість хімічних реакцій залежить від природи взаємодіючих речовин і від умов проведення реакцій, насамперед від концентрації реагуючих речовин і температури.
Залежність швидкості хімічної реакції від концентрації реагуючих речовин виражається законом дії мас: швидкість хімічної реакції за сталої температури прямо пропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють стехіометричним коефіцієнтам.
У загальному вигляді для реакції
аА + вВ + ... → ...
закон дії мас має вигляд:
![]()
де
![]() і
і
![]() - концентрації взаємодіючих речовин;
- концентрації взаємодіючих речовин;
![]() - константа швидкості, що
залежить від природи взаємодіючих
речовин, температури, каталізатора, але
не залежить від концентрації речовин.
- константа швидкості, що
залежить від природи взаємодіючих
речовин, температури, каталізатора, але
не залежить від концентрації речовин.
Порядок виконання роботи
Залежність швидкості реакції від концентрації реагуючих речовин вивчають на прикладі взаємодії тіосульфату натрію з сірчаною кислотою:
![]()

![]()
Ознакою реакції є помутніння розчину внаслідок виділення сірки.
Необхідно приготувати розчини тіосульфату натрію різних концентрацій. Для цього в чотири великі пробірки налити послідовно за допомогою бюретки: в першу пробірку 5 мл розчину тіосульфату натрію і 15 мл дистильованої води, в другу – 10 мл тіосульфату натрію і 10 мл дистильованої води, в третю – 15 мл тіосульфату натрію і 5 мл води, в четверту – 20 мл тіосульфату натрію.
У чотири маленькі пробірки налити по 5 мл сірчаної кислоти і прилити кислоту по черзі в пробірки з розчином тіосульфату натрію. Ретельно перемішати. Відзначити, через скільки секунд після перемішування почнеться помутніння в кожній пробірці.
Оформлення результатів роботи
Результати спостережень записати в таблицю:
|
Номер пробір-ки |
Об’єм
|
Відносна концентрація
|
Об’єм
|
Час
появи муті, с |
Відносна швидкість реакції 1/ | ||
|
|
|
суміші | |||||
Розрахувати
швидкість реакції в умовних одиницях
(1/![]() ).
Побудувати графік залежності швидкості
реакції від концентрації тіосульфату
натрію, відкладаючи на осі абсцис
концентрацію, а на осі ординат – швидкість
реакції в умовних одиницях. На основі
графіка зробити висновок про залежність
швидкості реакції від концентрації.
Написати рівняння реакції і математичний
вираз закону дії мас.
).
Побудувати графік залежності швидкості
реакції від концентрації тіосульфату
натрію, відкладаючи на осі абсцис
концентрацію, а на осі ординат – швидкість
реакції в умовних одиницях. На основі
графіка зробити висновок про залежність
швидкості реакції від концентрації.
Написати рівняння реакції і математичний
вираз закону дії мас.
Питання для самоперевірки
Чим вимірюється швидкість хімічної реакції?
Від яких факторів залежить швидкість хімічних реакцій?
Який закон виражає залежність швидкості реакції від концентрації реагуючих речовин? Сформулювати цей закон.
Що таке константа швидкості реакції?
Лабораторна робота № 5
