
monomers-Платэ-книга
.pdf
381
ют широкую фракцию, выкипающую в пределах 523-553 К, из которой удаляют индол и дифенил, после чего ее подвергают дистилляции с выделением более узкой фракции – 531-541 К. Эту фракцию направляют на повторную дистилляцию с выделением фракции 533-536 К, из которой после перекристаллизации и центрифугирования извлекают технический 2,6-диметилнафталин с температурой кристаллизации 363-368 К.
По другому способу для синтеза нафталин-2,6-дикарбоновой кислоты используются более разнообразные и доступные источники сырья. В качестве исходных соединений в процессе термокаталитического превращения могут применяться соли 1-, 2-нафтойных кислот, смесь нафталинмоно- и нафталиндикарбоновых кислот, нафталевый ангидрид и т.д.
В свою очередь, продукты, необходимые для синтеза нафталин-2,6- дикарбоновой кислоты, могут быть получены на основе монометилнафталинов и аценафтена, содержащихся в смолах коксования углей или газойлях каталитического крекинга.
Поскольку условия изомеризации и диспропорционирования щелочных солей нафталинкарбоновых кислот незначительно отличаются от условия превращения солей бензолкарбоновых кислот, то для осуществления этих реакций могут быть использованы те же самые реакционные аппараты и технологические приемы. Например, смесь нафталевого ангидрида, карбоната калия, иодида кадмия и нафталина в соотношении 1:1:0,1:2 нагревают до 723-733 К во вращающейся шаровой мельнице под давлением СО2 1,0 МПа. Охлажденный продукт реакции в виде порошка для растворения в воде подают элеватором в экстрактор с мешалкой. Нерастворимые примеси отделяют на фильтре, а фильтрат обрабатывают серной кислотой при 353-363 К. Осадок трудно растворимой нафталин-2,6-дикарбоновой кислоты отфильтровывают и промывают водой.
10.7. ТИОФЕН-2,5-ДИКАРБОНОВАЯ КИСЛОТА
Тиофен-2,5-дикарбоновая кислота
HOOC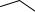 S
S  COOH
COOH
является мономером для получения электропроводящих полимеров. Тиофен-2,5-дикарбоновая кислота может быть получена из тиофена через
его металлорганическое производное, окислением природного антибиотика "юнипаль", на основе адипиновой кислоты или 2-метилтиофен-5- монокарбоновой кислоты. Все эти методы многостадийны и трудоемки.
Одним из путей промышленного производства этой кислоты является каталитическое диспропорционирование калиевой соли тиофен-2-карбоновой ки-

382
слоты, которая получается нейтрализацией продукта окисления 2- метилтиофена, получаемого, в свою очередь, из пиперилена и сероводорода.
|
10.8. АЗЕЛАИНОВАЯ КИСЛОТА |
|
||
Полиэфиры |
на |
основе |
азелаиновой |
кислоты |
НООС(СН2)7СООН
и этиленгликоля применяют при изготовлении бензо- и маслостойких трубопроводов, шлангов, электрошнуров. Дибутил-, диизобутил-, ди(2-этилбутил)-, диизооктил- и ди-(2-этилгексил)азелаинаты используют в качестве морозостойких пластификаторов поливинилхлорида, эфиров целлюлозы, каучуков.
В промышленности азелаиновую кислоту получают из олеиновой или линолевой кислоты озонолизом, а также окислением азотной кислотой или другими окислителями. В процессе озонолиза при комнатной температуре и атмосферном давлении образуется озонид, подвергающийся при 348-393 К термоокислительному разложению в среде монокарбоновой кислоты с образованием азелаиновой кислоты и пеларгоновой кислот:
О3
СН3(СН2)7СН=СН(СН2)7СООН 
Олеиновая кислота
 О
О 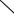 О2
О2  СН3(СН2)7СН СН(СН2)7СООН
СН3(СН2)7СН СН(СН2)7СООН 
О—О
 СН3(СН2)7СООН + НООС(СН2)7СООН .
СН3(СН2)7СООН + НООС(СН2)7СООН .
Пеларгоновая кислота |
Азелаиновая кислота |
При окислении кислородом продуктов озонолиза олеиновой кислоты в уксусной кислоте при 330-370 К в качестве катализатора применяют ацетат марганца.
Азелаиновую кислоту впервые выделил Лорен в 1837 г. из продуктов окисления олеиновой кислоты азотной кислотой. На этой реакции и был основан один из первых способов получения азелаиновой кислоты. К сожалению,
наряду с основным продуктом при этом образуется большое число короткоцепных фрагментов, поэтому выделение азелаиновой кислоты в таком процессе сопряжено со значительными трудностями.

383
10.9.ДИОЛЫ
10.9.1.Получение этиленгликоля
Этиленгликоль НОСН2СН2ОН – бесцветная вязкая гигроскопическая жидкость с т. кип. 470,6 К. Смешивается во всех отношениях с водой, различными спиртами, ацетоном, глицерином, не растворяется в ароматических углеводородах, хлороформе, сероуглероде и др.
Этиленгликоль (около половины его мирового производства) используют для получения синтетических полиэфирных волокон и пленок. Его применяют также в производстве полиуретанов, алкидных смол, в текстильной промышленности и др. Около 40% производимого этиленгликоля применяют в производстве антифризов.
Основным промышленным способом получения этиленгликоля является гидратация этиленоксида.
Гидратация этиленоксида
Гидратация этиленоксида является экзотермической реакцией:
CH2—CH2 + H2O |
HOCH2CH2OH H238 = -75 кДж/моль. |
O
Процесс получения этиленоксида включает следующие стадии:
-гидратация этиленоксида;
-нейтрализация кислого катализатора;
-перегонка и ректификация гликоля.
Гидратацию этиленгликоля водой проводят при 423-473 К, 1,5-2,0 МПа и соотношении вода:этиленоксид, равном 20:1. Большой ибыток воды необходим для того, чтобы минимизировать образование при гидратации нежелательных полигликолей. В табл. 10.3 приведен состав продуктов гидратации этиленоксида в зависимости от соотношения этиленоксида и воды.
Для ускорения процесса гидратации можно использовать кислый каталиатор, например серную кислоту. В этом случае после реакции ее нейтрализуют содой или щелочью. При времени пребывания реакционной смеси в условиях реакции в течении 1 ч достигается селективность по этиленгликолю ~90%, выход диэтиленгликоля составляет ~ 10% и триэтиленгликоля – 0,5%.
Водный раствор гликолей концентрируется в каскаде выпарных аппаратов, работающих при уменьшающемся давлении от первого к последнему ап

384
Таблица 10.3
Влияние соотношения вода:этиленоксид |
|
|
|||
на состав продуктов гидратации этиленоксида |
|
||||
Соотношение |
|
Содержание, % (в расчете на этиленоксид) |
|||
вода: этиленоксид, |
|
|
|
|
|
этилен- |
диэтилен- |
триэтилен- |
тетраэтилен- |
высшие |
|
моли |
гликоль |
гликоль |
гликоль |
гликоль |
полигликоли |
10,5 |
82,3 |
12,7 |
0 |
0 |
0 |
7,9 |
77,5 |
17,5 |
0 |
0 |
0 |
6,66 |
76,5 |
18,5 |
0 |
0 |
0 |
4,2 |
65,7 |
27,0 |
2,3 |
0 |
0 |
2,64 |
51,6 |
33,0 |
10,3 |
0 |
0 |
2,10 |
47,2 |
34,5 |
13,0 |
0,3 |
0 |
1,40 |
35,0 |
33,0 |
19,2 |
5,7 |
2,1 |
0,61 |
15,7 |
26,0 |
19,8 |
19,0 |
14,5 |
П р и м е ч н и е : Остальные продукты не идентифицированы.
парату от (0,6 МПа до 0,01 Мпа). Гликоли получают удалением воды в колонне, работающей под вакуумом. Далее гликоли разделяют в нескольких колоннах.
Другие методы получения этиленгликоля
Первое промышленное производство этиленгликоля основывалось на гидролизе этиленхлоргидрина водным раствором гидрокарбоната натрия:
HOCH2—CH2Cl + NaHCO3 + H2O  HOCH2—CH2OH + CO2 + H2O + NaCl.
HOCH2—CH2OH + CO2 + H2O + NaCl.
Хлоргидрин, в свою очередь, получали взаимодействием этилена и хлорноватистой кислоты:
CH2=CH2 + HClO HOCH2—CH2Cl
HOCH2—CH2Cl
Однако в настоящее время этот способ в промышленности не используется. По другому способу гидролиз дихлорэтана проводили водным раствором
соды при 473 К и 10 МПа:
ClCH2-CH2Cl + Na2CO3 + H2O  HOCH2-CH2OH + 2NaCl + CO2
HOCH2-CH2OH + 2NaCl + CO2
В настоящее время этот способ также не применяется.

385
Фирма "Дюпон" разработала и длительное время осуществляла промышленное производство этиленгликоля карбонилированием формальдегида до гликолевой кислоты с ее последующими этерификацией и гидрированием:
HCHO + CO + H2O  HOCH2—COOH,
HOCH2—COOH,
Гликолевая кислота
HOCH2—COOH + CH3OH  HOCH2—COOCH3 + H2O,
HOCH2—COOCH3 + H2O,
HOCH2—COOCH3 + 2H2  CH2—CH2OH + CH3OH.
CH2—CH2OH + CH3OH.
Способ в настоящее время не используется, за исключением стадии получения гликолевой кислоты, которая производится в незначительных количествах.
Этиленгликоль может быть получен карбоксилированием этиленоксида диоксидом углерода при 353-373 К и 2-5 МПа в присутствии в качестве катализатора галогенидов щелочных металлов или аминов с последующей гидратацией образующегося этиленкарбоната:
H2C—CH2 |
|
H2 |
|
C—O |
C=O Н2О |
CH2OH |
|
+ CO2 |
|||||||
|
|||||||
O |
H2C—O |
CH2OH |
|||||
|
|
||||||
Выход этиленгликоля составляет свыше 95%.
В промышленном масштабе разработан процесс ацетоксилирования этилена в диацетат гликоля в присутствии в качестве катализатора хлоридов палладия и лития, а также нитратов железа, никеля:
CH2=CH2 + 2HOOCCH3 + 0,5O2 |
CH3COOCH2—CH2OOСCH3 |
H238 = -125 кДж/моль,
который далее гидролизуют до этиленгликоля с селективностью свыше 98%:
CH3COOCH2—CH2OOСCH3 + 2H2O |
HOCH2CH2OH + 2CH3COOH |
H238 = -17 кДж/моль,
Процессы ацетоксилирования этилена разработаны фирмами "Халкон Интернейшнл", "Дюпон", "Селаниз", "АйСиАй", "Кураре". Недостаток метода – высокая коррозионность среды, трудность отделения катализатора, необходи
мость регенерации катализатора.

386
Разработан также промышленный одностадийный способ получения этиленгликоля из этилена:
CH2=CH2 + H2O + 0,5O2  HOCH2—CH2OH.
HOCH2—CH2OH.
В качестве катализаторов различные фирмы используют соли таллия, иодид меди, нитрат палладия.
Фирма "Юнион карбайд" разработала и реализовала процесс прямого превращения синтез-газа в этиленгликоль в присутствии комплексов карбонила родия в качестве катализатора при 403 К и давлении свыше 100 МПа.
В дальнейшем удалось значительно повысить эффективность процесса и понизить температуру реакции.
10.9.2. Получение пропандиола-1,2
Пропандиол-1,2 (пропиленгликоль-1,2; 1,2-дигидроксипропан) СН3СН(ОН)СН2ОН представляет собой бесцветную вязкую гигроскопичную жидкость без запаха с т. пл. 213 К, т. кип. 462 К. Растворяется в воде, диэтиловом эфире, одноатомных спиртах, карбоновых кислотах, альдегидах, аминах и др.
Пропиленгликоль-1,2 применяют для получения ненасыщенных полиэфирных смол, эластичных полиуретанов, алкидных смол, а также в фармацевтической, пищевой, парфюмерной промышленности и др. Наиболее крупным потребителем полипропиленгликоля является производство полиэфирных смол, отличающихся легкостью и прочностью. Практически полное отсутствие токсических свойств позволяет применять пропиленгликоль и полипропиленгликоль в пищевой, парфюмерной, фармацевтической промышленности.
Гидратация пропиленоксида
Основным промышленным способом получения пропиленгликоля является гидратация пропиленоксида в жидкой фазе при мольном соотношении вода:пропиленоксид, равном ~ 15, при 443-473 К и 2 МПа в отсутствие катализатора с селективностью 80-85% по отношению к оксиду:
|
|
CH3 |
|
|
CH3 |
|
|
|
|
|
|
||
CH2—CH + H2O |
|
|
CH2—CH |
|||
|
||||||
O |
|
|
|
|||
OH OH |
||||||
Помимо целевого продукта образуются значительные количества ди- и трипропиленгликолей. Селективность по монопропиленгликолю зависит от отношения вода:пропиленоксид на стадии гидратации: при увеличении этого отно-
387
шения от 5 до 25 содержание монопропиленгликоля в смеси продуктов реакции возрастает с 63 до 91%.
Гидратацию осуществляют в непрерывном режиме в реакторе трубчатого типа с рубашкой для отвода тепла реакции, продолжительность пребывания реакционной смеси в реакторе гидратации при температуре ~473 К и 1,5 МПа составляет 30 мин. В качестве катализатора гидратации могут быть использованы соединения фосфора и азота.
Каталитическую гидратацию пропиленоксида проводят в присутствии небольших количеств щелочи или серной кислоты при 423-453 К и 1,5-1,8 МПа. Содержание дипропиленгликоля и полигликолей не превышает 1,5-2,0%.
Главным недостатком промышленных методов получения пропиленгликоля гидратацией пропиленоксида является получение целевого продукта в виде очень разбавленных водных растворов, в связи с чем в схему процесса приходится включать дорогостоящую стадию выпаривания воды.
Большие перспективы имеет использование гетерогенных ионообменных катализаторов. Например, фирма "Тексако" разработала гетерогенные катализаторы в виде частично нейтрализованной амином сульфокислотной ионообменной смолы. Процесс гидратации проводят при 373-398 К, 1,5-2,5 МПа и мольном отношении вода:пропиленоксид, равном 2-2,5.
Одним из направлений повышения эффективности процесса является разработка высокоселективного способа гидратации при низком соотношении вода:пропиленоксид. Этому благоприятствует введение в реакционную смесь диоксида углерода. При проведении гидратации пропиленоксида в присутствии СО2 при 353-393 К первоначально образуется пропиленкарбонат, который затем разлагается до пропиленгликоля. В связи с тем, что образование пропиленкарбоната протекает с значительно большей скоростью, чем гидратация пропиленоксида, общая селективность процесса в присутствии СО2 возрастает.
353-393 |
K |
|
CH3CH(OH)CH2OH + CO2 |
|||
|
||||||
CH3—HC—CH2 + H2O + CO2 |
|
|
|
Пропиленгликоль |
||
|
|
|
||||
O |
|
|
CH3—HC—CH2 |
|||
|
|
|||||
|
|
|
|
|||
|
Пропиленкарбонат O O |
|||||
|
|
|
|
|
C=O |
|
388
Например, когда в качестве катализатора применяют четвертичные фос фониевые соли и СО2 (в пределах 0,1-0,5 моль на 1 моль исходного про-
пиленоксида) при ~ 423 К, 3-4 МПа и степени конверсии пропиленоксида, близкой к 100%, удается достигнуть селективности по монопропиленгликолю 9597%.
Другие методы синтеза пропандиола-1,2
Фирма "Халкон" разработала двухстадийный процесс получения 1,2- пропиленгликоля ацетоксилированием пропилена уксусной кислотой в присутствии кислорода.
На первой стадии пропилен в присутствии уксусной кислоты и кислорода с использованием в качестве катализатора оксида теллура и карбоната калия при 443 К превращается в диацетат пропиленгликоля:
СН3СН=СН2 СН3СООН СН3СH—СН2ОСОСН3
ОСОСН3 Селективность по диацетату пропиленгликоля достигает 92% при конверсии пропилена 98,5%.
На второй стадии диацетат гидролизуется в пропиленгликоль при 363 К и давлении 0,5 МПа в присутствии кислого катализатора:
СН3СH—СН2ОСОСН3 Н2О СН3СH—СН2ОН + 2СН3СООН. ОСОСН3 ОН
Мольный выход пропиленгликоля на пропилен составляет ~ 88%.
Очень интересны методы, в которых каталитическое окисление пропилена кислородом (чаще кислородом воздуха) осуществляется в воде; которая служит как растворителем, так и одним из реагентов. Это обеспечивает немедленную гидратацию образующегося пропиленоксида. Так, в процессе, разработанном фирмой "АйСиАй", реакция протекает в водном растворе, содержащем в качестве катализатора ионы меди и железа, а также некоторое количество растворенного СО2. Процесс осуществляют при 383-453 К и 0,1-5,0 МПа.
Окисление можно проводить и в отсутствие кислорода, например при использовании в качестве источника кислорода тетраоксида осмия.
Пропиленгликоль может быть получен также на основе синтез-газа. Процесс образования многоатомных спиртов из синтез-газа протекает согласно
уравнению:
nСО + (n+1)Н2 → Н-(-СНОН-)n-Н,
где n > 1.

389
Синтез гликоля проводят в жидкой фазе в среде органического растворителя при температуре 373-650 К и 3,5-350 МПа. Наибольшей активностью обладают катализаторы на основе карбонильных кластеров родия. Применяют также и рутениевые катализаторы, которые, хотя и менее активны, однако не так дороги, как родиевые.
Замена ископаемых углеводородов биомассой (древесина, хлопковая шелуха и др.) может обеспечить химическую промышленность дешевым сырьем. Основные компоненты биомассы - моносахариды (например, глюкоза, ксилит и прочие) - могут быть превращены в простые полиспирты: этиленгликоль, пропиленгликоль, глицерин. Таким образом, пропиленгликоль как составную часть реакционной смеси, содержащей помимо пропиленгликоля глицерин, этиленгликоль и небольшое количество других продуктов, можно получить взаимодействием моносахаридов с водородом в присутствии катализатора по схеме:
2Н2
2CH2(OH)CH(OH)CH2OH
C6H12O6 3H2
3CH2(OH)CH2OH
C5H10O5 + H2  CH2(OH)CH(OH)CH2OH + CH2(OH)CH2OH,
CH2(OH)CH(OH)CH2OH + CH2(OH)CH2OH,
C5H10O5 + 2H2 CH2(OH)CH(OH)CH(OH)CH2OH + CH3OH,
CH2(OH)CH(OH)CH(OH)CH2OH + CH3OH,
CH2OHCH(OH)CH2OH + H2  CH3CH(OH)CH2OH + H2O.
CH3CH(OH)CH2OH + H2O.
Соотношение образующихся продуктов зависит от условий процесса.
10.9.3. Получение бутандиола-1,4
Бутандиол-1,4 (бутиленгликоль-1,4) НО(СН2)4ОН представляет собой бесцветную вязкую низколетучую жидкость сладковатого вкуса с т. пл. 293,2 К, т. кип. 501 К. Хорошо растворяется в воде, спиртах, ацетоне. Бутандиол широко применяется в производстве полиэфиров (сополимеров с терефталевой кисло
той), полиуретанов, пластификаторов для термопластов, -бутиролактона
и др.
Основным промышленным способом получения бутандиола-1,4 является синтез из ацетилена и формальдегида, который был разработан В. Реппе в Германии во время Второй мировой войны для получения бутадиена дегидратацией бутандиола-1,4.

390
Синтез бутандиола-1,4 из ацетилена и формальдегида
Метод Реппе, основанный на конденсации ацетилена и формальдегида, включает стадии образования бутин-2-диола-1,4 и гидрирования бутиндиола в бутандиол.
Блок-схема производства бутандиола-1,4 конденсацией ацетилена и формальдегида представлена ниже (схема 10.2).
|
|
|
|
|
|
|
|
|
Схема 10.2 |
|
|
|
||||||
|
|
|
|
Рецикл бутанола |
|
|
|
|
|
|
|
|
|
|||||
Бутанол |
|
|
|
|
|
Рецикл |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Подготовка |
|
||||||
|
Подготовка |
|
|
|
|
|
|
|
||||||||||
|
|
|
катализатора |
|
катализатора |
|
|
катализатора |
|
|||||||||
Формальдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Бутин-2-диол-1,4 |
|
Гидрирование |
|||||
|
|
Образование |
|
|
|
|
|
|
||||||||||
|
|
|
Очистка |
|
|
|
||||||||||||
Ацетилен |
|
|
бутин-2-диола-1,4 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рецикл ацетилена |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Бутандиол-1,4 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Очистка |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Этинилирование формальдегида. Процесс включает взаимодействие ацетилена и формальдегида в присутствии в качестве катализатора ацетиленида меди, нанесенного на магнийсиликат. Основным продуктом реакции является бутин-2-диол-1,4, а в качестве побочного продукта образуется небольшое количество пропаргилового спирта (2-пропинол-1) – продукта конденсации ацетилена и одной молекулы формальдегида:
HC CH + HCHO  HC C-CH2OH,
HC C-CH2OH,
Пропаргиловый спирт
HC CCH2OH + HCHO |
HOCH2-C C-CH2OH. |
Бутин-2-диол-1,4
Высокая активность катализатора в целевой реакции позволяет избежать нежелательного образования полимера ацетилена - купрена. Реакцию проводят при атмосферном давлении и ~368 К в непрерывном реакторе. Свежий и рециркулируемый ацетилен вводят под давлением в реактор одновременно с разбавителем – азотом. Эта смесь проходит через водный раствор формальдегида. Не-
