
monomers-Платэ-книга
.pdf
351
Реакторы этерификации также расположены каскадом. В них из толуиловой кислоты и монометилтерефталата образуются соответствующие эфиры. Процесс этерификации протекает при 473-523 К. Реакционный поток направляют на дистилляцию, в первой колонне сверху отделяют смесь метанол-вода, а кубовый остаток подают в колонну выделения эфира, работающую под вакуумом. Метилтолуилат и непревращенный п-ксилол направляются в реактор окисления. Далее кубовый остаток, содержащий терефталат, разгоняют под вакуумом для удаления тяжелых фракций, затем он поступает на кристаллизацию под вакуумом 40-50 КПа. На заключительной стадии диметилтерефталат центрифугируют и перегоняют под вакуумом.
Выход целевого продукта на исходный п-ксилол составляет ~ 87%.
10.1.3. Процесс фирмы "Aмoкo"
Процесс получения ТФК для выработки волокна окислением п-ксилола был предложен "Мид Сенчури Корпорейшн" еще в 1958 г. в США. В настоящее время эта технология синтеза ТФК получила наибольшее распространение.
Процесс фирмы "Aмoкo" заключается в окислении п-ксилола в растворе уксусной кислоты воздухом при 448-503 К и 1,5-3,0 МПа в присутствии катализатора (ацетаты кобальта и марганца) и промотора (соединения, содержащие бром, преимущественно бромид натрия):
|
CH3 |
|
|
COOH |
Н = -1360 кДж/моль |
||
|
|
||||||
|
|
+ 3О2 |
|
|
|
+ 2Н2О |
|
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
COOH |
|
|||
|
CH3 |
|
|
|
|||
|
|
|
|||||
Вэтом случае растворители не являются инертной средой, а активно участвуют в процессе окисления. Проведение окисления п-ксилола в среде уксусной кислоты позволяет получить ТФК с большим выходом.
Вряду алифатических одноосновных кислот уксусная кислота является наиболее стабильной в условиях реакции окисления, так как не содержит вторичных и третичных С—Н-связей. Она оказывает двоякое действие: сокращает индукционный период вследствие активации катализатора и увеличивает скорость образования и разложения гидропероксидов.
Механизм окисления п-ксилола
Процесс получения терефталевой кислоты описывается следующими реакциями:
п-ксилол |
п-толуиловый альдегид |
п-толуиловая кислота |
п-карбоксибензальдегид |
терефталевая кислота. |
|

352
Окисление п-ксилола в среде уксусной кислоты, катализируемое солями кобальта и брома, является радикально-цепной реакцией с вырожденным разветвлением, в котором прослеживается ряд последовательных и параллельных превращений реагентов. В результате обменной реакции ацетата двухвалентного кобальта и бромида натрия образуется бромид ацетата кобальта:
Co(CH3COO)2 + NaBr |
|
OOCCH3 |
Co |
+ CH3COONa. |
|
|
|
Br |
Зарождение цепи в отсутствие катализатора начинается со взаимодействия п-ксилола и молекулярного кислорода по биили тримолекулярному механизму
H3C |
|
|
|
|
|
|
|
CH3 |
+ O=O |
t0 |
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
CH2 + HO2 , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
t0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 H3C |
|
|
|
|
|
|
|
CH3 |
+ O=O |
|
2 H3C |
|
|
|
|
|
|
|
|
|
|
|
|
CH2 + H2O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
или с катионом металла:
H3C |
|
|
|
|
|
|
|
CH3 + Co3+ |
H3C |
|
|
|
|
|
|
|
CH2 + Co2+ + H . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Радикал п-ксилола, присоединяя активированную молекулу кислорода, образует пероксидный радикал:
H3C |
CH2 + O=O |
H3C |
CH2OO |
Вклад реакций некаталитического взаимодействия п-ксилола и молекулярного кислорода в процесс инициирования незначительный.
Радикал НО2 в присутствии небольших количеств воды может образовывать пероксид водорода
HOO + H2O  H2O2 + HO ,
H2O2 + HO ,
который в дальнейшем может подвергаться мономолекулярному распаду с образованием гидроксильных радикалов или в присутствии катализаторов разлагаться по схеме:
H2O2 + Co2+  HO + HO- + Co3+
HO + HO- + Co3+

355
Пероксидный толуильный радикал, взаимодействуя с углеводородом, образует надтолуиловую кислоту и радикал:
H3C |
COO + ArH |
H3C |
COOH + Ar . |
|
O |
|
O |
Надтолуиловая кислота неустойчива и может последовательно распадаться с участием катализатора:
H3C |
COOH + Co2+ |
H C |
COO + Co3+ + HO-, |
|
O |
3 |
|
|
|
|
|
H C |
COO |
H3C |
+ CO2. |
3 |
|
|
|
Две последние реакции нежелательны, так как углеводород в итоге при высоких температурах и завышенных концентрациях катализатора подвергается окислительной деструкции. При умеренных режимах ведения процесса, когда надкислота не распадается, превалирует ее реакция с толуиловым альдегидом, при этом образовуется п-толуиловая кислота:
H C |
COOH + H3C |
CHO |
2 H3C |
COOH |
3 |
|
|
|
|
|
O |
|
|
|
Окисление метильной группы п-толуиловой кислоты осуществляется в основном аналогично окислению метильной группы п-ксилола с участием монобромида двухвалентного кобальта:
HOOC |
CH |
+ Co2++Br |
HOOC |
CH2 + Co2+ + HBr, |
|
3 |
|
|
|
HOOC |
CH2 + O2 |
HOOC |
CH2OO , |
356
HOOC |
CH2OO |
HOOC |
CHO + HO , |
HOOC |
CH2OO + |
H3C |
CH3 |
|
HOOC |
CHO + H3C |
CH2 + H2O . |
Две последние реакции в отсутствие катализатора и промотора не могут играть существенной роли. Вследствие электроноакцепторного воздействия карбоксильной группы на заместитель в пара-положении его направленное превращение происходит с участием монобромида кобальта:
HOOC |
|
|
|
|
|
|
|
|
|
|
|
|
CH2OO |
+ Co |
2+ |
|
+ H |
HOOC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHO + HO + Co3+ |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OOH + Co3+- |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
HOOC |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OOH + Co2+ |
|
HOOC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2O + Co3+ + OH, |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC

 CH2O
CH2O
 HOOC
HOOC

 + HCHO,
+ HCHO,
HOOC |
CH2O |
+ ArH |
HOOC |
CH2OH + Ar , |
HOOC |
CH OH + O2 |
HOOC |
CHOH + HO2 , |
|
|
2 |
|
|
|
HOOC |
CHO |
+ Co3+ |
HOOC |
CO + Co2+ + H+ , |
357
HOOC |
CO |
+ O2 |
HOOC |
COOO ; |
|
||||
HOOC |
COOO |
+ ArH |
HOOC |
COOOH + Ar . |
Мононадтерефталевая кислота взаимодействует с монобромидом кобаль-
та
HOOC |
COOOH |
2+ |
O |
|
O |
3+ |
|
|
|
C |
C |
|
|||||
+ Co +Br¯ |
|
+ Co +Br + |
|
OH |
||||
|
|
HO |
|
O |
|
или с п-карбоксибензальдегидом по бимолекулярному механизму с образованием ТФК:
HOOC |
COOOH + HOOC |
CHO |
2 HOOC |
COOH |
|
Радикал, полученный по реакции мононадтерефталевой кислоты с монобромидом кобальта, присоединяя водород, также дает ТФК:
HOOC |
COO |
H+ |
COOH |
HOOC |
или разлагается по схеме:
HOOC |
COO |
HOOC |
+ CO2 . |
В результате рекомбинации свободных радикалов в процессе каталитического жидкофазного окисления п-ксилола и его промежуточных продуктов могут получаться побочные ароматические одно- и многоядерные соединения.
Расчетные константы скорости и энергии активации взаимодействия продуктов реакции с ионом Со3+
ArH + Co3+  Ar + Co2+ + H+
Ar + Co2+ + H+
приведены ниже.

358
Окисляемое соединение |
k, л/г моль ч |
Еакт, кДж/моль |
(ArH) |
|
|
п-Толуиловый альдегид |
45,48 |
62,10 |
п-Ксилол |
15,67 |
68,00 |
п-Карбоксибензальдегид |
6,58 |
69,14 |
п-Толуиловая кислота |
2,321 |
73,74 |
Структуру активного каталитического комплекса, образующегося при окислении п-ксилола в среде уксусной кислоты, включающего ионы Со3+ и Со2+, можно представить следующим образом:
H2O OH
(R—C—O)2—Co2+ Co3+(O—C—R)3Co2+
|
|
|
|
|
|
O |
H2O OH |
O |
|||
Процесс получения ТФК с использованием кобальтового катализатора проводят в присутствии метилэтилкетона, ацетальдегида и паральдегида. Их
роль заключается в образовании с оптимальной скоростью радикалов, которые регенерируют кобальтовый (Со3+) катализатор. Последний необходим для начала окисления промежуточной п-толуиловой кислоты, которая в противоположном случае накапливалась бы в системе.
В отсутствие ацетата кобальта образования ТФК не происходит, хотя в системе имеются высокоактивные свободные радикалы СН3СО . Только при введении ацетата кобальта в результате перехода кобальта в состояние Со3+ начинается образование ТФК.
Промежуточные и побочные продукты окисления п-ксилола до терефталевой кислоты
При каталитическом окислении п-ксилола в среде уксусной кислоты при 453 К и 2,0 МПа в присутствии ацетатов кобальта и марганца, а также тетрабромэтана реализуется следующая последовательность образования промежуточных соединений:
|
CH3 |
|
CH3 |
|
CH3 |
|
|
|
|
CH3 |
|
CHO |
|
|
COOH |
|
|
|
||||
n-Ксилол п-Толуиловый |
п-Толуиловая |
|||||
|
|
альдегид |
кислота |
|||

CHO |
COOH |
359 |
|
|
COOH |
|
|
COOH |
|
|
|||
n-Карбокси- |
Терефталевая |
|||
бензальдегид |
кислота (ТФК) |
|||
В газовой фазе идентифицированы следующие продукты окисления п- ксилола:
Диоксид углерода ……….. |
………….CO2 |
Монооксид углерода …………..………….CO |
|
Гидропероксид п-ксилола . |
……..CH3C6H5CH2OOH |
п-Крезол ………………….. |
………CH3C6H5OH |
Формальдегид …………… |
………..HCHO |
Водород …………………... |
…….Незначительные |
Углеводороды C1-C3 …….. |
…… количества |
|
|
При окислении п-ксилола в уксусной кислоте в присутствии кобальтбро
мидного катализатора в случае низкого парциального давления кислорода образуются также следующие продукты:
Диметилбензил |
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Диметилстильбен |
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH=CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CHO |
4-Метил-4 -формилдибензил |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2CH |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
4-Метил-4 -формилстильбен |
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
CH=CH |
|
|
|
|
|
|
|
|
|
CHO |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Продукты уплотнения |
|
|
|
|
|
|
C24H24 и C24H26 |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
360
Технология получения терефталевой кислоты
Вэтом процессе применяют каталитическую систему, включающую ионы металлов переменной валентности и бромистые соединения. Другие галогенные соли металлов переменной валентности оказались малоактивными или вообще не обладали каталитической активностью.
Фирма "Стандард Ойл" усовершенствовала процесс фирмы "Амоко" и разработала технологию очистки ТФК, основанную на гидрировании п- карбоксибензальдегида и окрашенных примесей в водном растворе и кристаллизации продукта с контролируемой скоростью.
Принципиальная технологическая схема процесса окисления п-ксилола представлена на рис. 10.1.
Вреактор окисления 1, снабженной мешалкой для предотвраще -ния осаждения ТФК, непрерывно вводят воздух и раствор п-ксилола в уксусной кислоте, содержащий катализатор – ацетаты кобальта и марганца - и промотор – соединение брома. Процесс проводят при 473 К и 1,5-3,0 МПа. Время пребывания реакционной массы в реакторе составляет 40-60 мин. Реакция окисления п-ксилола сопровождается большим выделением тепла – ~ 1260 кДж/моль. Тепло отводится за счет испарения реакционной воды и уксусной ки слоты. Содержание кислорода в отходящих газах не должно превышать 5
-8% для исключения возможности образования взрывоопасных концентраций
Рис. 10.1. Принципиальная технологическая схема окисления п-ксилола в процессе фирмы "Амоко"
1 - реактор; 2 - газо-жидкостной сепаратор; 3 - кристаллизатор; 4 - центрифуга; 5 - сушилка; 6 - выпарной аппарат; 7 - колонна для отгонки воды.
Потоки: I - катализатор; II - ксилол; III - растворитель; IV - воздух; V - рецикл растворителя; VI - остаток.
продукта. Выход ТФК при непрерывном проведении процесса составляет более 90% (мол.), чистота продукта – более 99,5%.
Стадия очистки включает каталитическое гидрирование и кристаллизацию сырой ТФК в водном растворе при 500-550 К над палладиевым катализатором, нанесенным на активированный уголь. п-Карбоксибензальдегид гидрируется до п-толуиловой кислоты, окрашенные примеси превращаются в растворимые в воде соединения.


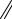

 CH
CH

 Co
Co HBr + Ar ,
HBr + Ar , CoСН
CoСН

 CH
CH


