
monomers-Платэ-книга
.pdf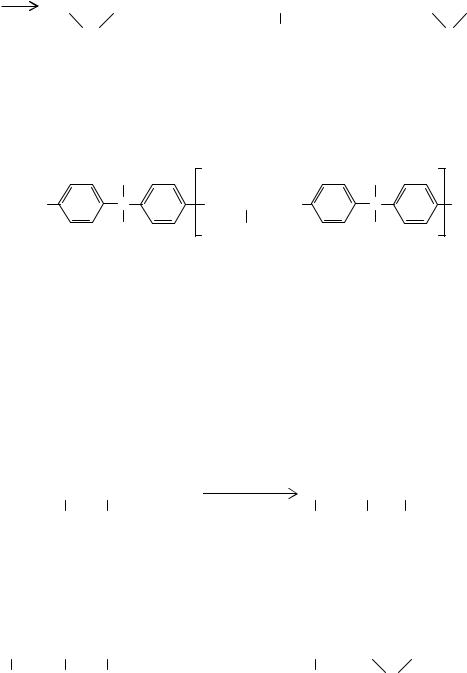
341
CH2—CH-CH2—R—[—CH2CHCH2R—]n—CH2CH—CH2
O |
OH |
O |
Наиболее широкое распространение получили эпоксидные олигомеры на основе 2,2-бис(4-гидроксифенил)пропана (бисфенол А), синтезируемого из ацетона, фенола и эпихлоргидрина:
|
CH3 |
|
CH3 |
|
R |
С |
OCH2CHCH2O |
С |
R |
|
CH3 |
OH |
CH3 |
n |
При реакции эпихлоргидрина с фенолами или спиртами получаются простые глицидные эфиры.
9.6.1. Получение эпихлоргидрина из глицерина
Эпихлоргидрин впервые был синтезирован в 1854 г. путем взаимодействия глицерина с хлоридом водорода:
|
|
|
373-393 К |
|
|
CH2—CH—CH2 + 2HCl |
CH2—CH—CH2 + 2H2O. |
|
|||
|
|
OH OH OH |
Cl OH Cl |
|
Для дегидрохлорирования дихлоргидринов глицерина 4-5%-ный водный раствор исходных веществ с Са(ОН)2 или NaOH нагревают до 373 К:
353-373 К
CH2—CH—CH2 + NaOH  CH2—CH—CH2 + NaCl + H2O.
CH2—CH—CH2 + NaCl + H2O.
Cl OH Cl |
Cl |
O |
Образующийся эпихлоргидрин быстро выводят из зоны реакции для предотвращения протекания дальнейших превращений. После конденсации и отделения от водного слоя перегоняют. Чистый продукт содержит более 99,5% эпихлоргидрина.
342
9.6.2. Получение эпихлоргидрина из аллилхлорида
Эпихлоргидрин получают также из аллилхлорида путем присоединения хлорноватистой кислоты через дихлоргидрин и дальнейшего отщепления соляной кислоты гидроксидом кальция:
|
|
|
CH2 |
—CH—CH |
2 30% |
|
||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2HOCl |
Cl |
OH |
Cl |
|
Ca(OH)2 |
||||
2CH2=CH-CH2Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CaCl2, H2O |
|
292-313K, pH 3-5 |
|
CH2—CH—CH2 |
70% |
|||||||
|
|
|
||||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
2H2C—CH—CH2Cl |
Cl |
Cl |
OH |
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
O |
|
|
|
|
|
|
|
|
|
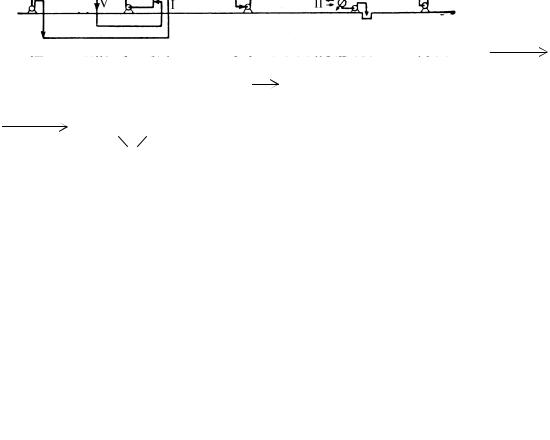
Принципиальная технологическая схема получения эпихлоргидрина из аллилхлорида представлена на рис. 9.7.
Рис. 9.7. Принципиальная технологическая схема получения эпихлоргидрина из аллилхлорида
1 – башня; 2 – реактор; 3 – разделительное устройство; 4 – смеситель; 5, 7 – реакционные колонны; 6 – сепаратор.
Потоки: I – аллилхлорид; II – вода; III –NaOH; IV – хлор; V - хлорноватистая
кислота; VI – дихлоргидрин; VII – Ca(OH)2; |
VIII – пар; IX – сырой эпихлор- |
|
гидрин; X – эпихлоргидрин; |
XI – смесь трихлорпропана и тетрахлор- |
|
диизопропилового эфира
Аллилхлорид вводят в реактор 2 вместе с хлорноватистой кислотой. Поскольку аллилхлорид плохо растворяется в воде [при комнатной температуре в водной фазе растворяется лишь 0,36% (мас.) аллилхлорида], необходимо принимать особые меры, чтобы препятствовать прямому контакту хлора и аллилхлорида. В противном случае в результате присоединения хлора образуется слишком большое количество трихлорпропана.
Во избежание непосредственного соприкосновения хлора с аллилхлоридом хлорноватистую кислоту получают в отдельной башне 1 с кислотоупорной

343
облицовкой путем непрерывного введения 1-2%-ного раствора едкого натра и хлора при большом разбавлении и низкой температуре. Это делается для того, чтобы введенный хлор по возможности без остатка перешел в хлорноватистую кислоту:
Cl2 + H2O HOCl + HCl.
HOCl + HCl.
Образовавшаяся кислота выходит из нижней части башни, затем при тщательном перемешивании реагирует с аллилхлоридом, давая дихлоргидрин. Далее реакционная смесь пропускается через разделительное устройство 3, в котором разделяются трихлорпропан и тетрахлордиизопропиловый эфир. В смесителе 4 дихлоргидрин смешивается с 15%-м Ca(OH)2 и поступает в реакционную колонну 5, в которой происходит образование эпихлоргидрина, а азеотропная смесь с водой отгоняется. Водный слой отделяется в сепараторе 6 и возвращается в реакционную колонну, а сырой эпихлоргидрин отделяется в колонне 7. Выход эпихлоргидрина превышает 90%.
9.7. СУЛЬФОНЫ
Сульфоны являются мономерами в производстве полисульфонов. Впервые полисульфон был получен в США в 1965 г.
Полисульфоны - гетероцепные полимеры, содержащие в основной цепи повторяющиеся группы –SO2–. Практическое значение имеют три ароматических полисульфона, формулы которых приведены ниже.
Полисульфон (юдель, ультразон S)
|
|
CH3 |
|
SO2 |
O |
C |
O |
|
|
CH3 |
n |
синтезируют поликонденсацией щелочных солей бисфенола А с 4,4 - дигалогендифенилсульфоном:
|
CH3 |
|
|
|
|
NaO |
C |
O |
+ n Cl |
SO |
Cl |
n |
|
Na |
2 |
||
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
SO2 |
O |
C |
O |
|
|
|
|
CH3 |
n |

344
Полиэфирсульфон (виктрекс, ультразон Е)
 SO2
SO2


 O
O




 O
O

n
получают поликонденсацией дикалиевой соли дигидроксидифенилсульфона с 4,4 -дихлордифенилсульфоном.
Полифениленсульфон (радель)
|
SO2 |
O |
|
|
|
|
n |
|
|
синтезируют |
поликонденсацией |
дикалиевой |
соли |
4,4- |
дигидроксидифенила с 4,4 - дихлордифенилсульфоном.
Полисульфоны обладают стойкостью к радиоактивному излучению и химической стойкостью. Они устойчивы в растворах щелочей, слабых растворах минеральных кислот, в алифатических углеводородах, моторных и дизельных топливах, нефтяных маслах. Полисульфоны негорючи и имеют температуру начала термического разложения выше 673 К, т.е. на 40-60о выше температуры переработки. Их применяют как конструкционные материалы для изготовления изделий, работающих длительное время в экстремальных условиях - при температурах в интервале от 373 до 473 К под нагрузкой в агрессивных средах, а также в производстве электроизоляционных пленок.
Сульфоны – соединения общей формулы RR SO2, где R и R = Alk, Alkenyl, Alkinyl, Ar. Это бесцветные, большей частью кристаллические вещества, хорошо растворимые во многих органических растворителях.
Сульфоны получают окислением сульфидов или сульфооксидов. В качестве окислителей используют H2O2, KMnO4, Na2Cr2O7 и др.:
RSR [O] RSO2R [O] RSOR
Сульфоны могут быть получены также алкилированием сульфоновых кислот или сульфинатов:
RS(O)OH + R OH  RSO2R
RSO2R  RS(O)ONa + R X, где X – Hal,
RS(O)ONa + R X, где X – Hal,
или перегруппировкой аллилсульфинатов:
RSO2CH2-CH=CHR
RS(O)OCH2-CH=CHR
RSO2CHR -CH=CH2
345
Другим способом получения сульфонов является свободнорадикальное присоединение сульфонилгалогенидов к ненасыщенным соединениям:
RSO2Cl + R CH=CH2 |
CaCl2 R CH(Cl)CH2SO2R |
или SO2 к диенам:
R |
|
|
|
R |
|
|
|
||
RCH=CH-CH=CHR + SO2 |
|
SO2 |
||
|
|
|||
Для получения дисульфонов используют те же методы, что и для синтеза сульфонов.
Свойствами сульфонов обладает также сульфолан
 ,
,
S O
O O
O
который используется как растворитель полиакриланитрила, полистирола, поливинлхлорида.
346
ЧАСТЬ ТРЕТЬЯ
МОНОМЕРЫ ДЛЯ ПОЛИМЕРОВ, ПОЛУЧАЕМЫХ
ПО РЕАКЦИЯМ ПОЛИКОНДЕНСАЦИИ
Глава 10
МОНОМЕРЫ ДЛЯ СЛОЖНЫХ ПОЛИЭФИРОВ
Сложные полиэфиры – гетероцепные полимеры, содержащие в основной цепи регулярно повторяющиеся группировки —С(О)—О—:
[—(O)-CR-C(O)—O-R'-O—]n и [—R-C(O) —O—]n
где R и R' –двухвалентные органические радикалы.
Сложные полиэфиры обычно получают поликонденсацией двухосновных кислот с диолами. Наибольшее распространение из полиэфиров получили полиэтиленгликольтерефталаты, которые синтезируют поликонденсацией терефталевой кислоты или ее диметилового эфира с этиленгликолем. Кроме терефталевой кислоты в качестве насыщенных двухосновных кислот применяют фталевую кислоту в форме ангидрида, а также изофталевую, адипиновую, себациновую кислоты. В качестве ненасыщенных двухосновных кислот используют малеиновую кислоту в форме ангидрида и фумаровую. В качестве диолов обычно применяют этиленгликоль, затем бутандиол-1,4 и, наконец, 1,4- дигидроксиметилциклогексан (НОСН2-С6Н10—СН2ОН). Бутандиол-1,4 используют преимущественно в реакции конденсации с терефталевой кислотой для получения полибутиленгликольтерефталата.
Сложные полиэфиры применяют для изготовления волокон, пленок, лаков, эмалей и покрытий. Основное промышленное значение имеет полиэтилентерефталат, из которого вырабатывают полиэтилентерефталатные волокна: лавсан, терилен, дакрон и другие, а также прочные и прозрачные пленки для кинофотопромышленности и упаковочных материалов.
Полиэтилентерефталатное волокно имеет влагопоглощение при 293 К и 65%-ной влажности воздуха 0,3-0,4%, сохранение прочности в мокром состоя-
347
нии 100%, в петле 80-90%, модуль сдвига при кручении 80-150 МПа, усадка в кипящей воде не подвергнутого термообработке 5-10%. Т. пл. волокна составляет 533 К, интервал рабочих температур - от 213 до 443 К.
Волокнообразующие полимеры, обладающие высокой кристалличностью и термостойкостью, получаются на основе нафталин-2,6-дикарбоновой кислоты (2,6-НДК). Введение этой кислоты в состав полиэтилентерефталата увеличивает прочность, растяжимость, накрашиваемость полимера, повышает температуру плавления и стеклования. Это волокно может быть использо-
вано для изготовления шинного корда, тканей бытового назначения и т.д. Нафталин-2,6-дикарбоновая кислота в составе смешанных полиэфиров
ациклических дикарбоновых кислот, этиленгликоля и гексаметиленгликоля образует прочное волокно. Полиэтилен-2,6-нафталиндикарбоксилат в пять раз устойчивее лавсана к ионизирующим излучениям. На основе 2,6-НДК получают пленки и волокна с низким коэффициентом трения, а также термопластичные полимеры, используемые для изготовления жаростойких клеев, термостойких герметизирующих пленок, формованных изделий и покрытий.
10.1.ТЕРЕФТАЛЕВАЯ КИСЛОТА И ДИМЕТИЛТЕРЕФТАЛАТ
Внастоящее время терефталевую кислоту (ТФК) или ее диметиловый эфир получают окислением п-ксилола:
|
|
CH3 |
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
COOCH3 |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
Co, Mn, O2 |
|
|
|
|
|
|
CH3OH |
|
|
|
|
|
|
|
|
|
|
|
Co, Mn, O2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
п-Ксилол |
п-Толуиловая кислота |
Метиловый эфир |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
п-толуиловой кислоты |
||||||||||||
|
|
|
|
COOCH3 |
|
|
CH3OH |
|
|
COOCH3 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
COOCH3 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
Монометиловый эфир |
Диметиловый эфир |
|||||||||||||||||||||
|
|
|
терефталевой кислоты |
терефталевой кислоты |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
( диметилтерефталат) |
||||||||||||

348
Количество получаемой кислоты можно увеличить, если включить в технологическую схему стадию термического превращения щелочных солей бензолкарбоновых кислот. В этом случае в качестве сырья можно использовать толуол, индивидуальные о- и м-ксилолы или смесь ксилолов без их предварительного разделения (рис. 10.1).
Получение терефталевой кислоты со степенью чистоты, необходимой для поликонденсации, представляет собой трудную задачу. Вот почему обычно для этой цели используют диметилтерефталат (ДМТ) требуемой чистоты, который получается значительно легче, хотя при его использовании приходится в процессе поликонденсации удалять метанол. Поэтому в последнее время предложены другие варианты очистки ТФК.
Одним из таких вариантов является получение "преполимера"- бисгидроксиэтилтерефталата - взаимодействием двух молекул гликоля и одной молекулы терефталевой кислоты:
НООСС6Н4СООН + 2 НОСН2СН2ОН
→ НОСН2СН2ОСОС6Н4СООСН2СН2ОН + 2Н2О.
Благодаря хорошей растворимости преполимера в воде и органических растворителях очистка его не представляет большой сложности.
Схема 10.1
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Бензойная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
Толуол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Бензол |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
Терефталевая |
|||||||||
|
|
|
|
|
|
|
|
Смесь ароматиче- |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
ских кислот |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Продукты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
перера- |
|
|
|
|
|
I |
|
|
|
|
II |
|
|
Ортофталевая |
|
III |
|||||||||||||||
|
|
Ксилолы |
|
||||||||||||||||||||||||||||
ботки |
I |
|
|
|
|
|
|
|
Этилбензол |
|
|
|
|
|
кислота или ее |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
нефти или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ангидрид |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
коксохи- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
II |
|
|
|
|
о-Ксилол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Нафталин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
III |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
м-Ксилол |
|
|
|
Изофталевая |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
|||
|
|
|
|
|
|
|
|
|
|
|
п-Ксилол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
П Р И М Е Ч А Н И Е. I - разделение углеводородов; II - окисление; III - термокаталитическое превращение с последующим разделением продуктов реакции.


350
Полученная кислота не растворялась в реакционной смеси и ее отделяли осаждением. После сушки ТФК этерифицировали метанолом в присутствии в качестве катализатора серной кислоты при 423 К. Выход целевого продукта составлял 90%.
Основным недостатком процесса являлось образование нитросоединений, что затрудняло очистку продукта и значительно ухудшало экономику процесса.
В настоящее время метод окисления п-ксилола азотной кислотой потерял свое значение.
10.1.2. Процесс фирмы "Виттен"
Процесс включает несколько стадий.
Сначала окисляют п-ксилол кислородом воздуха до п-толуиловой кисло-
ты:
С6Н4(СН3)2 + 1,5О2 |
СН3С6Н4СООН + Н2О Н = -690 кДж/моль. |
Окисление проводят в каскаде реакторов в присутствии в качестве катализатора нафтената кобальта при 413-443 К и 0,4-0,7 МПа.
Полученную п-толуиловую кислоту этерифицируют метанолом до п- метилтолуилата:
СН3С6Н4СООН + СН3ОН |
СН3С6Н4СООСН3 + Н2О Н = -30 кДж/моль. |
Этерификацию проводят при 473-523 К в присутствии в качестве катализатора толуолсульфокислоты.
Далее n-метилтолуилат окисляют до метилтерефталата:
СН3С6Н4СООСН3 + 1,5О2  НООСС6Н4СООСН3 + Н2О Н = -675 кДж/моль и этерифицируют до диметилтерефталата:
НООСС6Н4СООСН3 + Н2О Н = -675 кДж/моль и этерифицируют до диметилтерефталата:
НООС6Н4СООСН3 + СН3ОН (СН3СОО)2С6Н4 + Н2О Н = -30 кДж/моль.
(СН3СОО)2С6Н4 + Н2О Н = -30 кДж/моль.
Одна метильная группа п-ксилола окисляется с высокой скоростью, образуя п-толуиловую кислоту, другая группа окисляется значительно медленнее.Фактически процесс осуществляют в две стадии: окисление и этерификация.
Реакторы окисления расположены каскадом. В них подают катализатор – нафтенат кобальта, свежий и рециркулирующий п-ксилол и метил-п-толуилат. Воздух вводится в нижнюю часть реакторов. Реакцию проводят при 413-443 К
и 0,4-0,7 МПа.
