
monomers-Платэ-книга
.pdf
231
вии оксида ртути и малых количеств п-толуолсульфокислоты. Другой подход основывается на том, что поскольку роль сильной кислоты (кроме полимеризации образующихся мономеров) сводится к ионизации соли ртути, при использовании для катализа солей ртути, способных хорошо ионизироваться в органических растворителях, добавки сильных кислот необязательны. В качестве такой соли можно применять трифторацетат ртути. Карбазол в реакции с винилэтиловым или винилбутиловым эфиром в присутствии 1-10% (мас.) трифторацетата ртути в виниловом эфире в отсутствие инертного растворителя легко образует N-винилкарбазол в качестве единственного продукта. Отношение виниловый эфир : карбазол должно составлять не менее 6. При использовании меньших относительных количеств виниловых эфиров и при разбавлении их инертными растворителями наряду с N-винилкарбазолом образуется N-(1- этоксиэтил)карбазол:
Y |
X |
|
Hg(OCOCF3)2 |
|
|
|
|
|
|
+ CH2=CH—OR |
|
|
N |
|
|
|
H |
|
|
Y |
X |
Y |
X |
|
|
+ |
|
|
N |
|
N Me |
|
CH=CH2 |
RO |
|
где X = H, COMe, Cl, Br, I, Me, -бензо[c]-; Y = H, Cl, Br, I; R = Et.
К сожалению метод транс-винилирования карбазолов простыми виниловыми эфирами в присутствии трифторацетата ртути, несмотря на свою простоту и эффективность, из-за токсичности солей ртути не может конкурировать с прямым винилированием ацетиленом в промышленном производстве, но он очень удобен как препаративный метод.
6.4.3. Получение 9-винилкарбазолов многостадийными методами
Многостадийные методы синтеза N-винилкарбазолов основаны на реакции разложения 1- и 2-замещенных N-этилкарбазолов.
Разложение N-(2-гидроксиэтил)карбазола
N-(2-Гидросиэтил)карбазол легко образуется с почти количественным выходом из карбазола и этиленоксида в среде ацетона или метилэтилкетона в присутствии едких щелочей или из карбазола и этиленхлоргидрина, или из карбазола и этиленкарбоната:
232
|
H2C—CH2 |
|
|
|
O |
|
|
|
HOCH2CH2Cl |
|
|
N |
H2C—CH2 |
N |
|
O O |
|||
H |
|||
CH2CH2-OH |
|||
|
CO |
||
|
|
Путем промежуточного бромирования гидроксиэтилкарбазолов с помощью N-бромсукцинимида (БСИ) и брома с дальнейшим элиминированием тозилатных производных (соли и эфиры п-толуолсульфокислоты) могут быть получены 3-бром- и 3,6-дибром-9-винилкарбазолы с достаточно высоким выходом:
 N
N
CH2CH2-OH
Br
|
|
|
|
Br |
БСИ |
|
|
|
TsCl |
CCl4 |
|
N |
|
C5H5N |
|
|
|
|
|
|
|
CH2CH2-OH |
||
|
Br |
KOH |
|
Br |
|
|
|
|
|
|
|
Диметил- |
|
|
N |
|
сульфоксид |
|
N |
CH2CH2-OTs |
|
|
CH=CH2 |
|
|
|
Br |
|
Br |
|
|
Br2 |
|
TsCl |
|
|
CCl4 |
|
|
N |
|
|
|
N |
CH CH -OH |
|
|
CH2CH2-OH |
|
2 |
2 |
|
|
|
|
Br |
KOH |
Br |
Br |
|
|
|
|
|
|
|
Диметил- |
|
|
N |
|
сульфоксид |
|
N |
|
|
|
||
CH2CH2-OTs |
|
|
CH=CH2 |
|
Гидроксиэтилирование и гидроксипропилирование карбазола проводят при 423-453 К в диметилформамиде в присутствии едкого кали.
К первой группе методов относится дегидратация N-(2-гидроксиэтил)- карбазола или его эфиров. Процесс проводят в присутствии в качестве дегидра-
233
тирующего компонента едкого кали при 443-543 К в высококипящих растворителях. Выход N-винилкарбазола достигает 80%.
Достоинством метода дегидратации является доступность исходного N- (2-гидроксиэтил)карбазола или его эфиров. Гидроксиалкильные производные карбазолов - важнейшие полупродукты в синтезах N-винилкарбазола и других мономеров.
В более мягких условиях, чем при прямой дегидратации, происходит разложение арилсульфонатных производных N-(2-гидроксиэтил)карбазолов. Этим методом получен ряд 3-ацил- и 3-метил-N-винилкарбазолов:
COR |
|
|
|
|
COR |
N |
ArSO2Cl |
KOH |
|
|
|
CH2-CH2OH |
COR |
N |
|
|
CH2-CH2OSO2Ar |
 N
N
CH=CH2
Разложение 1-замещенных N-этилкарбазолов
Вторая группа методов синтеза N-винилкарбазолов основана на реакциях разложения 1-замещенных этилкарбазолов, в качестве которых используют N- (1-ациклоксиэтил)карбазолы:
Y
 X Y
X Y X
X
N |
|
ROH |
|
N |
|
RO |
Me |
CH=CH2 |
|
где R = СОАlk; Х =Y = Aik.
Разложение 1-замещенных этилкарбозолов на уксусную кислоту, карбазол и N-винилкарбазол осуществляют при температуре ~ 473 К в вакууме с одновременной отгонкой N-винилкарбазола в присутствии порошкообразной щелочи, связывающей уксусную кислоту. Выход целевого продукта достигает 7080%.
Термическое разложение N-(1-ацетоксиэтил)карбазола является надежным лабораторным методом синтеза 9-винилкарбазола. Поскольку основная трудность при проведении этого процесса стоит в возможности термической и кислотной (под действием уксусной кислоты) полимеризации винилкарбазола,
234
пиролиз проводят в вакууме не ниже 19,6-49 Па с отгонкой образующегося мономера.
Исходные N-(1-ацетоксиэтил)карбазолы получают по реакции соответствующих карбазолов с винилацетатом в присутствии щелочей. Карбазол со сложными виниловыми эфирами в основной среде образует кроме N-(1-ацил- оксиэтил)карбазолов продукты ацилирования:
 N
N
CH2=CH—OCOR RCOO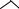
 Me
Me
 N
N
H
 N
N
COR
Решающее влияние на направление реакции карбазола с винилацетатом оказывает температура: она должна быть не выше 263 К, что обеспечивает преимущественное образование N-(1-ацетоксиэтил)карбазола. Удлинение ацильного радикала или замена его фенацильной группой (винилбензоат) мало влияетна селективность процесса. Реакцию проводят в ацетоне, метилэтилкетоне, диметилформамиде, диметилсульфоксиде и других апротонных полярных растворителях.
В качестве катализаторов применяют гидроксиды щелочных металлов, а также их 40-50%-е водные растворы и калийкарбазол.
6.5. ДРУГИЕ ВИНИЛОВЫЕ МОНОМЕРЫ
6.5.1. Получение этилиденнорборнена
Этилиденнонборнен используется в качестве сомономера в производстве терполимеров - этилен-пропилен-диеновых каучуков. Производство тройных сополимеров этилена, пропилена и диена составляет 95% от мирового производства этилен-пропиленовых эластомеров. В качестве третьего компонента термополимера помимо этилиденнорборнена используют дициклопентадиен, гексадиен-1,4 и метилтетрагидроинден. Однако этилиденнорборнен превосходит другие диены по скорости сополимеризации и времени вулканизации резиновых смесей.
Этилиденнорборнен получают изомеризацией винилнорборнена в присутствии основных катализаторов - щелочных металлов или их амидов в аммиачном растворе и на носителях:
235
CH=CH |
2 |
CHCH3 |
|
|
Винилнорборнен Этилиденнорборнен
Винилнорборнен в промышленностисинтезируют термической содимеризацией циклопентадиена с бутадиеном-1,3:
t0 |
CH=CH2 |
||
+ CH2=CH—CH=CH2 |
|
|
|
|
|
|
|
6.5.2. Получение винилтолуола
Полимеры и сополимеры на основе винилтолуола по ряду свойств превосходят полимеры и сополимеры стирола, получаемого из дефицитного бензола, хотя само производство винилтолуола довольно ограничено.
В промышленности используют три основных метода двухстадийного синтеза винилтолуола: получение винилтолуола из толуола и этилена, алкилирование толуола ацетиленом, конденсация толуола с ацетальдегидом.
Получение винилтолуола из толуола и этилена. Процесс проводят в две стадии.
На первой стадии проводят алкилирование толуола этиленом
C6H5CH3 + CH2=CH2  CH3C6H4C2H5
CH3C6H4C2H5
при атмосферном давлении, температуре 348-368 К и мольном соотношении толуол : этилен, равном 1,7- (3:1). В качестве катализатора используют АlСl3.
На второй стадии этилтолуол дегидрируют:
CH3C6H4C2H5 -H2 CH3C6H4CН=СH2.
Дегидрирование смеси м- и п-этилтолуолов осуществляют в присутствии смеси оксидов металлов, основными компонентами которых являются ZnO, Fе2O3 или MgO. Дегидрирование проводят при температуре ~ 873 К и соотношении пар : этилен, равном 2,5:1. При атмосферном давлении степень превращения этилтолуола составляет 28-32% (остаточное давление 10 кПа). Выход винилтолуола достигает 90-92%.
Этот способ реализован в промышленности фирмой "Дау Кемикал" (США).

236
Получение винилтолуола алкилированием толуола ацетиленом. Про-
цесс получения винилтолуола включает две стадии:
- алкилирование толуола ацетиленом при температуре около 573 К с получением дитолилэтана
2C6H5CH3 + CH=CH  CH3C6H4CH(CH3)C6H4CH3
CH3C6H4CH(CH3)C6H4CH3
- крекинг дитолилэтана
CH3C6H4CH(CH3)C6H4CH3 |
Т |
CH3C6H4CН=СH2 |
+ Побочные продукты |
|
Получение винилтолуола конденсацией толуола с ацетальдегидом.
Первую стадию - конденсацию толуола с ацетальдегидом проводят при низких температурах:
2C6H5CH3 + CH3CHO CH3C6H4CH(CH3)C6H4CH3 + H2O
CH3C6H4CH(CH3)C6H4CH3 + H2O
На второй стадии дитолилэтаны подвергают каталитическому крекингу с образованием винилтолуола.
6.5.3. Получение винилкетонов
Большинство винилкетонов легко сополимеризуется с другими мономерами. Например, метилвинилкетон сополимеризуется со стиролом, винилхлоридом, бутадиеном. Точно так же винилфенилкетон сополимеризуется со стиролом, винилиденхлоридом, винилацетатом, этилакрилатом, метилметакрилатом и бутадиеном. Сополимеры стирола с винилметилкетоном или изопропенилметилкетоном имеют более высокую термостойкость и более низкую горючесть по сравнению с полистиролом.
Синтез винилметилкетона
Впервые винилметилкетон (бутен-1-он-3) СН2=СН-СО-СН3 в 1908 г. получили Блез и Мэр путем отщепления хлорида водорода от метил- - хлорэтилкетона. Они также описали его способность легко превращаться в полимер, особенно под влиянием сильнощелочных агентов. В настоящее время винилметилкетон применяется главным образом для получения некоторых сополимеров, например с бутадиеном или изопреном.
Существует два промышленных способа синтеза винилметилкетона: присоединение воды к винилацетилену, получаемому димеризацией ацетилена, и дегидратация ацетоина (ацетилметилкарбинол).
Получение винилметилкетона гидратацией винилацетилена. По это-
му методу винилметилкетон получают из ацетилена путем гидратации по Кучерову за счет присоединения воды к винилацетилену в кислой среде в присутствии катализаторов.В качестве катализаторов используют ртутные соли, в основном сульфат или фторборат. Присоединение воды может протекать в среде уксусной кислоты или ароматического углеводорода:
CH2=CH—C CH + H2O |
333-335 К |
|
|
|
|
|
CH2=CH—C=CH2 |
||||||
HgSO4 + Fe(SO4)3 |
||||||
|
|
OH |
|
|||
|
|
|
|
|||
Енол винилметилкетона

237
 CH2=CH—CO—CH3.
CH2=CH—CO—CH3.
Поскольку в этом процессе двухвалентная ртуть восстанавливается до одновалентной ртути, к реакционной смеси прибавляют окислитель, например сульфат трехвалентного железа, который переводит соль одновалентный ртути в активную соль двухвалентной ртути.
Получение винилметилкетона дегидратацией ацетоина. Дегидратация ацетоина является более современным промышленным способом синтеза винилметилкетона
OH
|
|
573 К |
H2O + CH3—CO—CH=CH2 |
CH3—CO—CH—CH3 |
|||
Ацетоин |
[Al2O3 + SiO2 + WO3] |
Винилметилкетон |
|
Ацетоин получают либо полной гидратацией винилацетилена в присутствии сульфата двухвалентной ртути:
OH
CH2=CH—C CH + 2H2O CH3—CO—CH—CH3 + побочные продукты,
CH3—CO—CH—CH3 + побочные продукты,
либо частичным окислением бутиленгликоля-2,3. При использовании в качестве катализатора меди окисление протекает практически количественно.
Ацетоин можно постучать также совместно с этиленгликолем аэробным брожением растворов углеводородов под влиянием микроорганизмов семейства
Bacillus subtilis.
Получение винилметилкетона из бутиленгликоля-1,3. Винилметилке-
тон можно получить из бутиленгликоля-1,3 путем последовательных реакций: сначала синтезируют циклический эфир действием дымящей серной кислоты (47%-й олеум) на бутиленгликоль в среде хлороформа при низкой температуре, а затем кипячением с водой образовавшийся сульфат гидролизуют с образованием 3-гидроксибутил-1-серной кислоты. При окислении последней вторичная спиртовая группа превращается в оксогруппу и одновременно отщепляется серная кислота.
|
CH2—OH |
CH2—O |
H2O |
||||||
H2C |
|
|
+ SO3 |
273-283 К H2C |
SO2 |
||||
|
|
|
|||||||
|
CH—OH |
CH—O |
|
||||||
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
||||||
|
|
|
|
|
|||||
H2C CH2—OSO3H |
Cr2O3; [O] HC CH2 |
+ H2SO4 + Н2О. |
|||||||
|
|
CH—OH |
|
|
CO |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
|
|
||

238
Синтез изопропенилметилкетона
Изопропенилметилкетон СН2=С(СН3)-СО-СН3 был впервые получен в 1891 г. О.Валлахом путем гидролиза оксима этого соединения кислотами. Способность ненасыщенного кетона переходить в прозрачный твердый полимер была описана в 1910 г. В промышленности его начали применять с 1935 г. В настоящее время изопропенилметилкетон является основой для производства некоторых термопластов.
Получение изопропенилметилкетона дегидратацией 1-гидрокси-2-
метилбутанона-3. В промышленности изопропенилметилкетон получают либо дегидратацией 1-гидрокси-2-метилбутанона-3, либо кратковременным нагреванием с безводной щавелевой кислотой, либо действием фосфорного ангидрида на безводный кетон, растворенный в хлороформе:
|
|
CH3 |
367-369 К |
|
|
CH3 |
|
|
|||||
CH2 |
|
—CH—CO—CH3 |
H2O + CH2 |
|
=C—CO—CH3 . |
|
|
|
|||||
|
|
|
||||
OH |
|
|
|
|
||
Самым эффективным катализатором является щавелевая кислота. Дегидратацию щавелевой кислотой осуществляют следующим образом: смесь обоих соединений, к которой добавляют гидрохинон, подают в реактор, нагретый до 403 К, с такой скоростью, чтобы кетон, получающийся в результате дегидратации, как можно быстрее удалялся из зоны реакции.
Исходный кетоспирт 1-гидрокси-2-метилбутанон-3 получают из метилэтилкетона и формальдегида при рН = 8,2-8,6. Обе реакции можно проводить одновременно в одну стадию в газовой фазе. В качестве катализатора используют силикагель или оксид алюминия, содержащий оксиды циркония, церия, тория, цинка. Процесс проводят при 588-693 К. Недостатком процесса является наличие примесей в получаемом изопропенилметилкетоне - формальдегида и продуктов побочных реакций (углеводороды, спирты, смолы).
Получение изопропенилметилкетона из ацетона и ацетилена. Этот промышленный процесс был разработан в 1945 году. Синтез диметилэтинилкарбинола проводят в безводной среде при 288 К. Растворителем служит диэтилацеталь, катализатором является едкое кали:
|
CH3 |
KOH |
|
CH3 |
|
|
|
CH3 |
|
|
|
|
|
H2O |
|
|
H2O |
||
|
|
|
|
|
|
||||
CH3—CO + CH CH |
|
CH3C—C CH |
|
CH3- |
|
C—C CH Hg2+ |
, H+ |
||
|
|
|
|||||||
|
|
|
OK |
|
OH |
|
|||
Диметилэтинилкарбинол
239
CH3- |
CH3 |
P2O5 |
в CHCl3 |
|
|
CH3 |
|
|
|||||||
|
|
|
|
|
|||
|
C—CO—CH3 -H2O |
CH2=C—CO—CH3. |
|||||
|
|||||||
|
OH |
|
|
|
|
|
|
Образующийся алкоголят разлагают водой при 278 К, выделяющуюся щелочь нейтрализуют диоксидом углерода, и диметилэтинилкарбинол очищают перегонкой. Полученный продукт непрерывно гидратируют разбавленной серной кислотой в присутствии катализатора - сульфата двухвалентной ртути. Из водного дистиллята высаливают гидроксикетон и после сушки снова перегоняют. Превращение гидроксикетона в изопропенилметилкетон осуществляют действием фосфорного ангидрида в среде безводного хлороформа. Изопропенилметилкетон выделяют путем фракционированной перегонки.
Синтез винилфенилкетона
Винилфенилкетон С6Н5СО-СН=СН2 впервые был получен в 1906 г. Л.Шефером и Б.Толленсом, которые описали также и его полимеризацию. В качестве мономера его начали применять приблизительно с 1936 г. в производстве ряда сополимеров.
Винилфенилкетон в промышленности получают по реакции отщепления молекулы бромида водорода от -бромпропиофенона действием ацетата калия в кипящем спиртовом растворе:
CO-CH2-CH2-Br |
CH3COОK |
|
|
|
CO-CH=CH2 |
+ HBr . |
||
C2H5OH |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
После охлаждения реакционную смесь обрабатывают хлороформом и хлороформную вытяжку освобождают от спирта. Остаток после упаривания
растворителя стабилизируют присадкой N-фенил- -нафталинамина или ацетата меди и подвергают перегонке при пониженном давлении. Выход винилфенилкетона составляет ~ 75%. Продукт, полученный перегонкой с водяным паром, можно непосредственно подвергать полимеризации.
Синтез виниленкарбоната
Виниленкарбонат легко полимеризуется в поливиниленкарбонат, который при гидролизе образует полимерный спирт с гидроксильными группами
при каждом атоме углерода: |
|
|
|
|
|
nH2O |
|
|
|
|
|
|
||
nHC=CH |
—HC—CH— |
—CH—CH— |
|
|||||||||||
-CO2 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O O |
|
O O |
|
OH OH |
|
|||||||||
|
n |
|
n |
|||||||||||
|
CO |
|
|
CO |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||||||

240
Мономер виниленкарбонат получают хлорированием этиленкарбоната с последующим дегидpoxлopиpoвaниeм с применением третичных аминов.
H2 |
|
C—CH2 |
Cl2 |
H2 |
C—CHCl |
R3N |
HC=CH |
|||
|
HCl |
-R3N HCl |
||||||||
|
|
|
|
|
|
|||||
O O |
|
O O |
O O |
|||||||
|
|
|||||||||
|
|
CO |
|
|
CO |
|
|
CO |
||
