
monomers-Платэ-книга
.pdf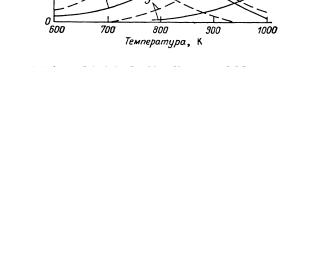
131
Окислительное дегидрирование н-бутана можно осуществлять и в присутствии катализаторов, например молибдата кобальта. Однако предложенные на сегодня катализаторы пока недостаточно эффективны.
Каталитическое дегидрирование. Реакция окислительного дегидрирования бутенов в бутадиен практически необратима, и поэтому можно достигнуть практически полного превращения бутенов:
C4H8 + 0,5O2  C4H6 + H2O.
C4H6 + H2O.
Основной побочной реакцией является предельное окисление (горение) углеводородов с образованием СО2 и Н2О. В процессе окислительного дегидрирования бутенов протекают побочные реакции, приводящие к образованию кислородсодержащих соединений: фурана, формальдегида, ацетальдегида, акролеина, метакролеинов, муравьиной, уксусной, пропионовой и малеиновой кислот. Реакцию осуществляют при 723-773 К.
Окислительное дегидрирование олефинов до диолефинов можно проводить в присутствии например кальцийникельфосфатных или оксидных катализаторов или тех же катализаторов, что и при обычном дегидрировании, в качестве которых используют вольфрамат висмута и фосфат висмута, смесь оксидов олова и сурьмы, висмутмолибденовые и другие.
Одностадийное дегидирование бутана в бутадиен
Одностадийный процесс дегидрирования алканов:
C4H10  C4H6 + 2H2
C4H6 + 2H2
имеет очевидные преимущества перед двухстадийным процессом ввиду отсутствия необходимости разделения газовых смесей после каждой стадии и более низких энерго- и капитальных затрат. На рис. 4.2 представлена зависимость состава равновесной смеси при дегидрировании бутана в бутены и бутадиен от температуры и давления.
Рис. 4.2. Зависимость состава равновесной смеси при дегидрировании бутана в бутены и бутадиен от температуры и давления
Сплошные линии - 0,1 МПа, штриховые
- 0,01 МПа.
1 – бутан; 2 – бутены; 3 – бутадиен

132
Термодинамические расчеты показывают, что равновесный выход диена существенно возрастает с повышением температуры и с уменьшением парциального давления алкана. Поскольку повышение температуры связано с потерей селективности реакции, одностадийное получение диенов из алканов было реализовано в условиях вакуумного дегидрирования. В одностадийном процессе дегидрирования используют алюмохромовые катализаторы, содержащие 1830% оксида хрома.
Фирма "Гудри" (США) впервые реализовала процесс получения бутадиена из бутана в одну стадию (аналогично процессу получения изопрена из изопентана). В присутствии алюмохромового катализатора протекают побочные превращения бутана, бутенов и бутадиена. Применение алюмохромового катализатора исключает использование водяного пара в качестве разбавителя. Принципиальная технологическая схема этого процесса, который проводят под вакуумом (0,015-0,020 МПа) в стационарном слое катализатора, приведена на рис. 4.3.
Рис. 4.3. Принципиальная технологическая схема процесса одностадийного дегидрирования бутана
1 - испаритель; 2 - трубчатая печь; 3 - топка; 4 - реакторы; 5 - котелутилизатор; 6 - скруббер; 7 - холодильник; 8 - турбокомпрессор; 9 - абсорбер; 10 - десорбер; 11, 12 - ректификационные колонны; 13 - узел экстрактивной ректификации.
Потоки: I - свежий бутан; II - возвратная бутан-бутиленовая фракция; III - воздух; IV - топливный газ; V - линия вакуума; VI - сброс в атмосферу; VII - отдувкн в топливную сеть; VIII - углеводороды С3 на сжигание; IX - фракция С4-С12; X - бутадиен
Сырье - смесь бутана и возвратной бутан-бутеновой фракции - испаряется в испарителе 1 и при 313 К поступает в трубчатую печь 2. Перегретые пары сырья со скоростью 240 ч-1 направляют в реактор 4, где при 863-898 К и остаточном давлении 11,3-22,7 кПа происходит процесс дегидрирования. Реактор представляет собой горизонтальный цилиндрический аппарат диаметром 6 м и длиной 12 м. Полный рабочий цикл продолжается 21 мин. 30 с., дегидрирова-
133
ние - 8 мин. 15 с., продувка паром, опорожнение реактора - 2 мин. 35 с. Из реакторного блока контактный газ подают в орошаемый охлаждающим маслом скруббер 6, в котором его охлаждают до 328 К, и затем в блок выделения бутадиена.
Конверсия бутана в одностадийном процессе составляет ~20%, а выход бутадиена 50-55% на превращенное сырье. Контактный газ содержит 37-39% бутана, 23-25% бутенов, 12-13% бутадиена.
Основные параметры процессов дегидрирования алкенов С4-С5 приведены ниже:
Параметр |
Фракция |
Фракция |
|
бутенов |
изопентенов |
||
|
|||
Температура в реакторе, К |
873-923 |
873-923 |
|
Объемная скорость подачи сырья, ч-1 |
130-180 |
150-220 |
|
Мольное соотношение алкен:водяной пар |
1:20 |
1:20 |
|
Температура регенерации катализатора, К |
873-923 |
873-923 |
|
Перепад давления по слою катализатора, МПа |
0,05-0,09 |
0,04-0,09 |
|
Степень конверсии исходного сырья, % |
40 |
40-43 |
|
Селективность образования диена, % |
85 |
76 |
|
Выход диена в расчете на пропущенное сырье, % |
33 |
32-33 |
|
Содержание в контактном газе, % |
|
|
|
Алкенов |
59 |
45 |
|
Диена |
24 |
25 |
Выделение бутадиена
Во всех процессах бутадиен получается в смеси с другими углеводородами, близкими к нему по летучести. Выделение из таких смесей концентрированного бутадиена, используемого для производства каучука, является весьма сложной задачей. Для стереоспецифической полимеризации необходим бутадиен, тщательно очищенный от примесей других углеводородов диенового и ацетиленового ряда и соединений неуглеводородного характера. В России для стереоспецифической полимеризации применяется бутадиен с концентрацией не ниже 99% (масс.) и содержанием примесей в нем не выше (% мас.):
Ацетиленовые углеводороды……………………0,005
Алленовые углеводороды………………………..0,01-0,03
Циклопентадиен……………………………….….0,001
Карбонильные соединения……………………….0,01
Азотистые соединения…………………………0,001-0,002 (в расчете на азот)
В табл. 4.2 приведен углеводородный состав продуктов дегидрирования бутана, бутенов и фракции С4 пиролиза бензина.

134
Таблица 4.2. Углеводородный состав продуктов дегидрирования бутана, бутенов
и фракции С4 пиролиза бензина ( в % (мас.))
|
Дегидрирование бутана |
Дегидрирование бутенов |
Пиролиз бензина |
|||||
|
обычное |
вакуумное |
окисли- |
обычное на |
окислительное |
средний |
жесткий |
|
Компонент |
на алю- |
на алюмо- |
тельное с |
кальций- |
на фосфор- |
при |
при |
|
мохромо- |
хромовом |
иодом и |
никель- |
висмут- |
1033 К |
1123 К |
||
|
вом ката- |
катализа- |
акцепто- |
фосфатном |
молибденовом |
|
|
|
|
лизаторе |
торе |
ром |
катализаторе |
катализаторе |
|
|
|
|
|
|
|
|
|
|
|
|
С1-С3 |
9,48 |
4,75 |
9,20 |
2,45 |
0,05 |
1,1 |
0,31 |
|
Изобутан |
22,45 |
2,05 |
0,10 |
0,40 |
0,25 |
2,5 |
6,68 |
|
н-Бутан |
50,60 |
47,35 |
14,50 |
7,30 |
8,50 |
9,3 |
||
|
||||||||
Изобутен |
1,90 |
5,5 |
1,50 |
8,55 |
- |
29,0 |
23,98 |
|
Бутен-1 |
10,40 |
9,90 |
2,90 |
18,30 |
4,80 |
14,0 |
6,27 |
|
Бутен-2 |
23,30 |
15,75 |
7,80 |
29,32 |
16,80 |
10,0 |
7,75 |
|
Бутадиен |
1,50 |
14,00 |
63,10 |
32,95 |
68,80 |
32,7 |
50,08 |
|
С5 |
0,31 |
0,63 |
0,70 |
0,50 |
0,74 |
0,5 |
0,6 |
|
|
|
|
Вредные |
примеси |
|
|
|
|
Пропин |
0,002 |
0,005 |
0,20 |
0,013 |
0,003 |
0,24 |
0,86 |
|
Бутин-1 |
0,005 |
0,005 |
0,07 |
0,040 |
- |
0,11 |
- |
|
Аллен |
- |
0,003 |
0,04 |
0,015 |
0,008 |
0,17 |
- |
|
Метилаллен |
0,003 |
0,025 |
0,09 |
0,09 |
- |
0,04 |
- |
|
Циклопента- |
0,04 |
0,02 |
0,2 |
0,1 |
0,03 |
0,03 |
- |
|
диен |
|
|
|
|
|
|
|
|
Для выделения бутадиена из различных бутадиенсодержащих фракций в промышленности используют два метода: экстрактивную ректификацию с различными полярными агентами и хемосорбцию медноаммиачноацетатными растворами.
При экстрактивной ректификации в качестве разделяющих агентов используют N-метилпирролидон, диметилформамид и диметилацетамид.
Хемосорбция основана на образовании комплексных соединений ненасыщнных углеводородов (преимущественно диенов) с солями металлов переменной валентности. Промышленное применение для выделения бутадиена хемосорбцией нашел способ с использованием водноаммиачного раствора ацетата одновалентной меди. Взаимодействие бутадиена и бутенов с медноаммиачным раствором происходит с образованием комплексов:
(CH3COO)2Cu2(NH3)4 + C4H6  C4H6(NH3)3Cu2(CH3COO)2 + NH3.
C4H6(NH3)3Cu2(CH3COO)2 + NH3.
Процесс связывания бутадиена носит характер вытеснения молекулы аммиака из внутренней координационной сферы центрального атома молекулой углеводорода.
Технологические схемы установок хемосорбции включают три основные стадии:
135
-поглощение, на которой бутадиен вместе с небольшим количеством других ненасыщенных углеводородов растворяется в экстрагенте;
-обогащение, при котором бутены удаляются из раствора;
-десорбция, при которой бутадиен практически полностью отгоняется из раствора.
Обогащение бутадиена осуществляется за счет подачи части десорбированного бутадиена противотоком к насыщенному хемосорбенту, в результате чего поглощенные бутилены замещаются в комплексе на бутадиен.
Десорбция бутадиена может осуществляться за счет разрушения комплекса нагреванием или уменьшением парциального давления бутадиена в системе путем создания вакуума или продувкой хемосорбента инертным газом или паром.
4.2. ИЗОПРЕН
Более 130 лет известно, что изопрен является основным звеном макромолекул натурального каучука, однако до конца 1940-х годов ни один синтетический каучук не мог по комплексу свойств заменить натуральный. Ситуация в корне изменилась после открытия К. Циглером и Дж. Натта новых каталитических систем для стереоспецифической полимеризации ненасыщенных углеводородов. В результате усилий ученых многих стран (США, СССР, Италии и др.) были разработаны эффективные способы получения цис-1,4-полиизопрена, являющегося структурным аналогом и заменителем натурального каучука. Мировые мощности по производству синтетического изопренового каучука сегодня превышают 1,3 млн т/ год.
Впромышленном масштабе освоены шесть методов получения изопрена:
-из изобутилена и формальдегида;
-дегидрированием изопентана;
-окислительным дегидрированием изопентана;
-из пропилена;
-из ацетилена и ацетона;
-жидкофазным окислением углеводородов.
Почти каждый из перечисленных методов существует в нескольких технических вариантах. Одной из причин такого многообразия методов получения изопрена, в первую очередь, является возможность использования многих видов сырья.
Наиболее простой вариант получения изопрена - извлечение из фракций С5 пиролиза нефти, содержащей обычно 15-20% изопрена. Эта фракция образуется в качестве побочного продукта при получении этилена и пропилена в количествах, не превышающих 15-20% от выхода этилена. Однако для промышленной реализации метода необходимо транспортировать эту фракцию с различных нефтеперерабатывающих заводов, что создает определенные трудности.
136
Изопентан и изопентены, обладающие углеводородным скелетом конечного продукта, являются дефицитными продуктами в связи с тем, что они широко применяются как высокооктановая добавка к качественным бензинам (не содержащим тетраэтилсвинец). Это ограничивает возможность их применения для получения изопрена.
4.2.1. Двухстадийное получение изопрена из изобутилена и формальдегида
Реакцию взаимодействия непредельных соединений с формальдегидом впервые описал Х. Принс в 1917 г. Он изучал взаимодействие стирола с формальдегидом в присутствии серной кислоты как катализатора. В результате были получены формали диоксана-1,3. На возможность использования реакции Принса для получения диеновых углеводородов указывали еще в 1932 г. Фицки и Фридрихсен. В 1946 г. советские ученые М.И. Фарберов и М.С. Немцов с сотр. показали принципиальную возможность разработки высокоэффективного процесса получения изопрена этим методом. Метод был реализован в 1964 г.
Синтез изопрена из изобутилена и формальдегида осуществляется в две стадии.
На первой стадии изобутилен конденсируется с формальдегидом в присутствии кислотного катализатора, например разбавленной серной кислоты, в
4,4-диметилдиоксан-1,3: |
|
|
||||
|
|
|
|
CH3 |
CH3 |
|
|
|
|
||||
CH3—C=CH2 + 2CH2O |
CH3—C—CH2—CH2 |
|||||
|
|
|
|
|
O—CH2—O |
|
|
|
|
|
|
4,4-Диметилдиоксан-1,3 |
|
На второй стадии 4,4-диметилдиоксан-1,3 расщепляется до изопрена на |
||||||
твердом катализаторе фосфатного типа, например на фосфате кальция: |
||||||
|
CH3 |
CH3 |
||||
CH3—C—CH2—CH2 |
CH2=C—CH=CH2 + CH2O + H2O. |
|||||
|
|
O—CH2—O |
Изопрен |
|||
|
||||||
Основные реакции на каждой стадии сопровождаются многочисленными побочными превращениями. На первой стадии образуются триметилкарбинол, метилаль, диоксановые спирты, диолы, эфиры и другие соединения. Образование изопрена на второй стадии сопровождается распадом диметилдиоксана до изобутилена и формальдегида, метилдигидропирана, гексадиена, пиперилена, соединений терпенового ряда (зеленое масло) и других.
В качестве сырья преимущественно используют изобутилен, содержащийся во фракциях С4, выделенных из продуктов пиролиза или крекинга жидких углеводородов. Присутствие в сырье н-бутенов и бутадиена приводит к образованию изомерных диоксанов, при расщеплении которых получается большой набор побочных продуктов:
137
CH3—CH2—CH=CH2 + 2CH2O  C2H5—CH—CH2—CH2
C2H5—CH—CH2—CH2
-Бутен |
|
|
O— CH2 — O |
||||||||||||
|
|
|
|
|
|
|
|
4-Этилдиоксан-1,3 |
|||||||
CH3—CH=CH—CH=CH2 + CH2O + H2O. |
|
||||||||||||||
Пиперилен |
|
|
|
|
|
|
|
|
|||||||
CH3—CH=CH—CH2 + 2CH2O |
|
|
|
CH3 |
|
||||||||||
|
|
-Бутен |
|
|
|
|
|||||||||
|
|
CH3 |
|
|
CH2=C—CH=CH2 + CH2O + H2O |
||||||||||
|
|||||||||||||||
|
|
|
|||||||||||||
CH3—CH—CH2—CH2 |
|
|
|
|
|
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
O— CH2 —O |
|
|
|
|
C2H5—CH—C |
+ CH2O |
|||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||
4,4-Диметилдиоксан-1,3 |
|
|
|
CH3 |
H |
||||||||||
|
|
|
|
|
|
|
|
Изовалериановый альдегид |
|||||||
CH2=CH—CH=CH2 + 2CH2O |
CH |
|
CH |
|
|||||||||||
CH2=CH—CH—CH2—CH2 |
|
|
|||||||||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
|||||||||
|
CH |
|
CH + CH2O + H2O. |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
O— CH2 —O |
|
|
CH 2 |
|
|||||||||
4-Винилдиоксан-1,3 |
Циклопентадиен |
|
|||||||||||||
Наряду с основным продуктом реакции - диметилдиоксаном (ДМД) образуются также 3-метилбутандиол-1,3
CH3 CH3—C—CH2—CH2OH
OH
Очевидно, что образование 1,3-диметилдиоксанов может протекать параллельно с синтезом гликолей-1,3 или последовательно через стадию взаимодействия метилбутандиола с еще одной молекулой формальдегида:
|
|
|
|
CH3 |
|
|
|
H2O |
|||
|
|
|
|
|
|
изо-C4H8 + CH2O |
|
CH3—C—CH2—CH2OH |
|||
|
|
||||
|
|
||||
|
|
OH |
|||
|
|
||||
|
|
CH2O |
CH3 |
||
|
|
|
|
|
|
|
|
CH3—C—CH2—CH2 |
|||
|
|
|
|||
|
|
|
|
|
|
|
|
|
O—CH2—O |
||
Однако концентрация воды в условиях синтеза значительно выше, чем формальдегида, и более вероятным представляется синтез диметилдиоксана через метилбутандиол.
Механизм реакции

138
Реакция конденсации изобутилена с формальдегидом катализируется кислотами и относится к реакциям кислотного катализа. Скорость таких реакций линейно зависит от функции кислотности Гаммета. Роль катализатора заключается в протонировании кислородного атома карбонильной группы с образованием оксиметиленкарбкатиона:
+ |
К + |
CH2O + H |
CH2O , |
|
1 |
где К- константа равновесия, равная 105 л/моль, при концентрации Н2SО4 1-10% (мас.) и 70-1000С.
Последний присоединяется к олефину, который выступает в качестве
нуклеофильного агента: |
+ |
+ |
|
CH2OН + H2C=C(CH3)2 |
HOCH2CH2C(CH3)2 . |
2
Лимитирующей стадией взаимодействия изобутилена и формальдегида является образование карбониевого иона 1, который затем быстро подвергается последовательным превращениям. Протонизация формальдегида является быстрой обратимой реакций, причем ее равновесие сильно смещено в сторону протонированной формы. Это означает, что в условиях катализа концентрация непротонированной формы формальдегида очень низка и в лимитирующей стадии участвует протонированная форма формальдегида. Проведенное различными исследователями изучение кинетики процесса свидетельствуют в пользу образования карбкатиона 2 как лимитирующего акта процесса. Кинетическое уравнение конденсации изобутилена и формальдегида имеет вид:
d(изо C4 H8 ) |
K CH2 O изо C4 H8 |
d |
|
где k - экспериментальная константа скорости.
Таким образом, скорость конденсации описывается уравнением второго порядка, в котором порядок реакции по каждому реагенту равен 1. Экспериментально найденная энергия активация взаимодействия изобутилена с формальдегидом составляет 80-85 кДж/моль.
В водных растворах формальдегид присутствует, как правило, не в виде свободного карбонильного соединения, а в связанном состоянии - в виде равновесной смеси мономера, тримера (СН2О)3, моногидрата-метиленгликоля СН2(ОН)2 и полимергидратов НО(СН2)nН. Концентрация различных гидратов зависит от температуры и содержания альдегида в растворе. При высокой температуре и низкой концентрации формальдегида в растворе преобладает метиленгликоль. Снижение температуры и увеличение содержания формальдегида благоприятствуют образованию полимергидратов.
В условиях реакции Принса протекает также гидратация олефина с образованием триметилкарбинола.
139
Обе реакции, в которых участвует изобутилен - взаимодействие с формальдегидом и гидратация - являются конкурирующими. При высоком соотношении формальдегид: изобутилен вклад реакции гидратации чрезвычайно мал и возрастает по мере расходования формальдегида.
Реакционная способность непредельных углеводородов в реакции Принса убывает в порядке:
изобутилен > бутен-2, бутадиен > бутен-1 Аналогичная последовательность наблюдается и для реакции гидратации.
Такой порядок изменения реакционной способности непредельных соединений связан с тем, что скорость и направление атаки электрофильного агента определяется, в первую очередь, стабильностью возникающего в процессе реакции переходного комплекса.
Изобутилен реагирует с формальдегидом на два порядка быстрее, чем другие алкены. Это позволяет использовать в качестве сырья в промышленности не чистый изобутилен, а более дешевые С4-фракции каталитического крекинга или пиролиза, которые содержат наряду с изобутиленом и алканами н- бутилены и бутадиен. Однако диоксаны-1,3, образующиеся при конденсации этих олефинов с формальдегидом, за исключением 4,5-диметилдиоксана-1,3, образуют при разложении диены, являющиеся нежелательными примесями или ядами, например циклопентадиен. Поэтому содержание н-бутиленов и, особенно, бутадиена в сырье жестко регламентируется, для того чтобы не усложнять последующую очистку мономера.
Превращение гликолей-1,3 в диоксаны
При превращении изобутилена и формальдегида в диметилдиоксан протекает обратимая ацетализация метилбутандиола:
|
|
CH3 |
H+ |
|
|
CH3 |
|
|
|||||
CH3—C—CH2—CH2OH + CH2O |
|
CH3—C—CH2—CH2 |
||||
ОН |
|
O—CH2—O |
||||
Эта реакция протекает значительно быстрее, чем образование гликоля, и ее равновесие, также как и других реакций образования диоксанов-1,3, сдвинуто в сторону образования последних.
Образование изопентеновых спиртов
Наряду с диметилдиоксаном и бутандиолом в результате конденсации изобутилена с формальдегидом образуются в небольших количествах три изомерных изоамиленовых спирта:
OH
CH2=C—CH2—CH2OH |
CH3 |
|
—C=CH—CH2OH CH3 |
|
—C—CH=CH2 |
|
|
|
|||||
|
||||||
CH3 |
CH3 |
CH3 |
||||
3-Метилбутен-3-ол-1 |
3-Метилбутен-2-ол-1 |
3-Метилбутен-1-ол-3 |
изопропенилэтиловый |
диметилаллиловый |
диметилвинилкар- |
спирт (ИПЭС) |
спирт (ДМАС) |
бинол (ДМВК) |
140
Эти спирты являются следствием вторичных превращений метилбутандиола.
Схема превращений, протекающих при дегидратации метилбутандиола (МБД), представлена ниже:
CH3  HO—CH2—CH2—C—CH3
HO—CH2—CH2—C—CH3 
|
|
МБД |
OH |
|
|
||
CH2 |
|
=C—CH2—CH2OH |
CH3 |
|
—C=CH—CH2OH |
|
|
|
|
|
|||||
|
|
||||||
|
|
|
|
|
CH3 |
ДМАС |
|
|
CH3 ИПЭС |
|
|
||||
|
|
|
|
|
|
OH |
|
||
|
|
|
|
|
CH3 |
|
—C—CH=CH2 |
ВПП |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||
СH2 |
|
=C—CH=CH2 |
|
|
ДМВК |
|
|||
|
|
|
|
||||||
CH3 |
|
|
|
|
|
|
|||
Изопрен
В образующихся спиртах преобладает ИПЭС, содержание которого в смеси изомерных изопентеновых спиртов составляет 55-66%. ДМВК является продуктом быстрой равновесной изомеризации диметилаллилового спирта. Более сложен вопрос о происхождении ДМАС и ИПЭС. Оба спирта могут образоваться и при дегидратации метилбутандиола и при непосредственном взаимодействии изобутилена с формальдегидом, а также по обоим вариантам. Экспериментально установлено, что ИПЭС образуется преимущественно в результате прямого взаимодействия изобутилена с формальдегидом.
Все первичные продукты реакции Принса - метилбутандиол и три изоамиленовых спирта - могут быть превращены в изопрен. В процессе конденсации изобутилена с формальдегидом эти соединения вследствие высокой реакционной способности с большой скоростью превращаются в конечные продукты реакции - диметилдиоксан и высококипящий побочный продукт (ВПП). Поэтому синтез изопрена осуществляют через стадию получения диметилдиоксана, хотя его разложение протекает в более жестких условиях, чем дегидратация спиртов и гликоля.
Превращение 4,4-диметилдиоксана-1,3 в изопрен
Вторая стадия синтеза изопрена из изобутилена и формальдегида - разложение диметилдиоксана с получением изопрена - осуществляется в реакторах секционного типа с подводом тепла - перегретого до 973 К водяного пара. В качестве катализаторов используют кислые фосфаты металлов второй груп-
