
monomers-Платэ-книга
.pdf
201
В качестве примера ниже приведена реакция фторирования пентахлорэтана при 363 К, сопровождающаяся образованием продуктов димеризации и диспропорционирования:
CCl3CCl2H + F2  CCl3ĊCl2 + HF + F ,
CCl3ĊCl2 + HF + F ,
CCl3CCl2H + F  CCl3ĊCl2 + HF,
CCl3ĊCl2 + HF,
2CCl3CCl2  CCl3CCl2CCl2CCl3,
CCl3CCl2CCl2CCl3,
|
|
|
CCl2=CCl2 + CCl3CCl3, |
2CCl3CCl2 |
|
|
|
CCl3ĊCl2 + F2  CCl3CCl2F + F ,
CCl3CCl2F + F ,
CCl3ĊCl2 + F |
CCl3CCl2F. |
Введение в систему ненасыщенных соединений способствует развитию
цепи.
5.2.3. Способы фторирования алканов
Вследствие очень высокой активности фтора реакции фторирования характеризуются низкой избирательностью. Например, при фторировании алканов всегда образуется сложная смесь разнообразных фторпроизводных, а выход монофторида или низших продуктов фторирования оказывается небольшим.
Самым эффективным средством регулирования направления реакций фторирования является использование фторидов металлов в высшем валентном состоянии. Фториды кобальта СоF3, серебра AgF2, марганца MnF3 являются весьма эффективными как в реакциях замещения водорода, так и в реакцияхприсоединения фтора по ненасыщенным связям, причем в обоих случаях наблюдается более низкий тепловой эффект реакции:
—С—Н + 2CoF3 |
—C—F + HF + 2CoF2 Н = 217,9 кДж/моль. |
Фториды двухвалентных металлов затем фтoрируются с регенерацией фтoрида металла в высшей степени окисления:
2СоF2 + F2  2CoF3 Н = 243 кДж/моль.
2CoF3 Н = 243 кДж/моль.
Монофторирование жидкого бутана и изобутана можно осуществить в низкокипящем растворителе (240-354 К) при освещении лампой в 100 Вт.
202
Полифторирование алкильных заместителей в различных соединениях проводят смесью молекулярного фтора с инертными газами (гелий) в интервале температур от 293 до 383 К в растворителях. Фторирование осуществляют в аппаратах, изготовляемых из латуни, никеля, иногда даже из стали. Используемые в качестве катализаторов фториды металлов наносят на носитель, например на медную стружку.
Металлфторидный процесс
Наибольшее распространение в промышленности получил металлфторидный процесс. Пары фторируемого вещества, сильно разбавленные азотом, пропускают через горизонтальную стальную трубу, заполненную СоF3, с лопастной мешалкой. На фторирование в реактор поступают пары углеводорода, разбавленные пяти-десятикратным избытком азота. На входе в реактор поддерживается температура 423-473 К, а на выходе из реактора - 573-653 К. Время контакта равняется 2-3 мин. Выход перфторуглеводородов составляет 8085%. Процесс проводят до 50%-го превращения трифторида кобальта, после чего в реактор подают фтор, разбавленный азотом, для регенерации катализатора. Периодический характер работы реактора является основным недостатком процесса.
Криогенное фторирование
В последнее время разработан способ криогенного контролируемого фторирования. Схематически устройство криогенного реактора представлено на рис. 5.9.
Рис. 5.9. Горизонтальный криогенный реактор фторирования
1 - охлаждаемый бокс; 2 - реактор; 3 - сосуд со фторируемым реагентом; 4 - камера; 5 - ловушка
Реактор 2 представляет собой цилиндрическую горизонтальную колонку, стенки которой выполнены из никеля. Он заполнен инертным наполнителем в виде медных стружек для поглощения выделяющегося тепла и увеличения по-
203
верхности контакта реагентов. Реактор помещен в охлаждаемый жидким азотом бокс 1, наружные стенки которого выполнены из нержавеющей стали. Внутренняя изоляция стенок реактора изготовлена из пенополиуретана или пенополистирола, что обеспечивает поддержание криогенных температур в зонах З1-З4. Реагенты поступают в реактор 2 через медную трубку, соединенную с камерой для реагентов 4. Азот и фтор подаются из баллонов в камеру 4, фторированные продукты и непревращенные реагенты выводятся из реактора через ловушку 5. Фторируемое вещество из сосуда 3 выпаривается в охлажденную зону З1, в которой конденсируется на медных стружках. Затем дозированно вводят фтор, после чего нагревают зону З1, что обеспечивает перемещение реагентов из зоны З1 последовательно в зоны З2, З3, З4. При последовательном прохождении реагентов через эти зоны происходит образование перфторированных углеводородов.
В последние годы в промышленности широко используется электрохимическое фторирование.
Электрохимическое фторирование
При электролизе безводного фторида водорода выделяющийся на аноде фтор быстро реагирует с растворенным в жидкости органическим веществом. Основными материалами для изготовления анода являются никель и графит. Электрохимическое фторирование проводят обычно при температуре ниже или вблизи температуры кипения фторида водорода. Электрохимическое фторирование метана, этана, изобутана проходит с образованием монофторзамещенных. Например, при фторировании этана селективность образования C2H5F достигает 75%.
Механизм электрохимического фторирования включает участие промежуточных комплексов типа (RH)2NiF6, (RH)3NiF6 (RH-исходный углеводород). В результате электрохимической реакции на аноде, в зависимости от природы фторируемого соединения, образуются катион-радикалы или свободные радикалы. Например, процесс фторирования уксусной кислоты можно представить следующим образом:
CH3COO-(адс.) |
|
|
|
CH3COO (адс.) |
CH3 (адс.) + CO2 , |
|||||||
|
|
2CH3 (адс.) |
|
|
C2H6 , |
|
|
|
||||
СH |
|
(адс.) + NiF |
|
F |
- |
CH NiF |
|
2F (адс.) |
|
2F (адс.) |
||
|
|
|
|
-HF |
CH FNiF |
|
- HF |
|||||
3 |
|
|
x |
- е- |
3 |
|
x+1 |
2 |
x+1 |
|||
|
|
CHF2NiFX+1 |
|
|
F (адс.) CHF3 |
F (адс.) |
CF4 |
|
|
|||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
2F (адс.) |
CF3NiFx+1 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
- HF |
|
|
|
|
|
|
2CF3NiFx+1  C2F6 .
C2F6 .
204
5.2.4. Фторирующие агенты
Гомолитическое фторирование углеводородов протекает при непосредственном воздействии на них молекулярным фтором или фтором, образующимся из гипофторитов.
Молекулярный фтор
Взаимодействие углеводородов с молекулярным фтором обычно приводит к образованию углерода и фторида углерода, так как вследствие экзотермичности реакции происходит крекинг углеводородной цепи.
Фторирование функциональных производных углеводородов молекулярных фтором в ряде случаев проводят при облучении УФ-светом, причем фторирующий агент - газовая смесь F2—Не - содержит 2% (об.) F2. Процесс проводят при температурах от 353 до 288 К в жидком HF, насыщенном ВF3. В качестве инициатора используют также кислород.
При фторировании молекулярным фтором высокомолекулярных соединений оптимальное соотношение кислорода и фтора равно 1:5.
Фторирование углеводородов в газовой фазе проводят в струйном реакторе. Углеводород и азот, подаваемые под небольшим давлением, образуют турбулентную струю в неразбавленном фторе.
Гипофториты
Простые и доступные методы синтеза гипофторитов позволяют широко применять их при гомолитическом фторировании. Гипофториты получают фторированием перфторацилфторидов в присутствии Na, K, Pb, Mg, Ca и др.:
O
RFC + F2 |
RFCF2OF. |
F
Реакция протекает по радикальному механизму:
F2 |
Кат. |
2F , |
F + COF2 |
CF3O , |
|
CF3O + F |
|
CF3OF, |
2CF3O |
|
CF3OOCF3. |
Простейшие гипофториты CF3OF и CF2(OF)2 получают фторированием CО. Трифторметилгипофторит с выходом 80% образуется при облучении COF2
205
и F2 УФ-светом. Разложение трифторметилгипофторита начинается при температуре ~473 К и с заметной скоростью протекает при температуре выше 523 К:
CF3OF 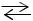 COF2 + F2
COF2 + F2
Углеводороды и их хлорпроизводные фторируются гипофторитами ROF (R—фтор или перфторалкил-группы C1-C5) и SF5OF при УФили ионизирующем облучении ( - или -лучи) при температуре от 193 до 283 К в инертных растворителях (например, FСС13). В этих условиях атом водорода в хлороформе легко замещается на фтор.
Монофторирование алкильных заместителей в ароматических углеводородах идет также при УФ-облучении. Селективность действия гипофторитов используется для монофторирования циклических систем и аминокислот, причем процесс идет в растворе фтористого водорода.
Фторид водорода
Реакция замещения в органических соединениях хлора на фтор действием трифторида сурьмы SbF3 была открыта бельгийским химиком Ф. Свартсом в конце XIX века. Важное промышленное значение эта реакция приобрела для получения фтор- и фторхлоруглеводородов путем фторирования безводным фторидом водорода. Для замещения атомов галогена в углеводородах могут использоваться фториды серебра, ртути и сурьмы, однако наибольшее распространение получил фторид сурьмы. Он способен замещать атом хлора в соединениях, имеющих не менее двух атомов хлора при одном углеродном атоме. Активность трифторида сурьмы повышается при добавлении пентахлорида или пентафторида сурьмы. Образующиеся в процессе фторирования хлориды сурьмы можно перевести во фториды с помощью фторида водорода:
SbCl3 + 3HF |
SbF3 + 3HCl |
Процесс фторирования фторидом водорода осуществляют как в жидкой, так и в газовой фазах. Жидкофазное фторирование проводят при 323-373 К и давлении от атмосферного до 3,0 МПа. В газовой фазе фторирование проводят при атмосферном давлении и температуре 473-723 К.
Синтез монофторалканов осуществляют разнообразными методами. Простейший из них - присоединение фтористого водорода к олефинам (добавление олефина к избытку НF). Из этилена и НF получают монофторэтан с выходом 81%. Пропилен реагирует с НF на активированном угле с почти количественным выходом. Реакцию проводят в газовой фазе при 325 К, время пребывания реагентов в реакционной зоне ~36 с. Реакция идет по правилу Марковникова:
CH3CH=CH2 + HF 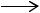 CH3CHFCH3
CH3CHFCH3

206
Прямое замещение НО-группы на фтор осуществляется при действии HF на третичные, аллиловые и бензиловые спирты.Так, трет-бутиловый спирт реагирует с 60%-ной фтороводородной кислотой при 335 К с образованием трет-бутилфторида (выход 60%):
(СН3)3СОН + HF → (СН3)3СF + Н2О.
5.2.5. Получение винилфторида
Винилфторид (фторэтилен) СН2=СНF – простейший фторолефинпредставляет собой бесцветный газ с т. кип. 200,7 К, т. пл. 112,5 К и относительной плотностью при 200,7 К, равной 0,853. Винилфторид в воде практически не растворим, плохо растворяется в спирте и ацетоне.
В промышленности винилфторид получают газофазным присоединением фторида водорода к ацетилену в присутствии соединений ртути как катализатора в трех последовательно расположенных реакторах.
СН СН + НF  CH2=CHF.
CH2=CHF.
Соли ртути наносят на активированный уголь и сушат до содержания остаточной влаги менее 0,01% при 373 К и давлении 19,6-29,4 Па. Побочным продуктом реакции является этилиденфторид, который при 673 К может быть дегидрофторирован до винилфторида.
Винилфторид можно получать непосредственно из этана окислительным фторированием:
2CH3—CH3 + F2 + 1,5O2 |
2CH2=CHF + 3H2O, |
а также фторированием этилена:
CH2=CH2 + F2  CH2=CHF + HF
CH2=CHF + HF
или винилхлорида:
CH2=CHCl |
HF F |
CH—CH3 → CH2=CHF + HCl . |
|
|
Cl |
Фторирование винилхлорида фторидом водорода приводит к образованию 1,1-фторхлор- и 1,1-дифторэтана, пиролизом которых при 673-1073 К получают винилфторид с выходом 85%.

207
5.2.6. Получение винилиденфторида
Винилиденфторид ( 1,1- дифторэтилен) CH2=CF2 представляет собой бесцветный газ с т. кип. 187,3 К, т. пл. 129 К, плотностью 0,580 при 298 К.
В промышленности винилиденфторид получают дегидрохлорированием 1,1-дифтор-1-хлорэтана при 873-973 К, который образуется при фотохимическом хлорировании 1,1-дифторэтана при 293-343 К и мольном соотношении 1,1-дифторэтан : хлор, равном 1,1:1,2, в течение 20-90 с. Дегидрохлорирование проводят в присутствии теплопроводящего материала (например, опилок никеля) при давлении не выше 108 кПа:
CHF2CH3 |
+ Cl2 |
h |
ClCF2CH4 |
923-993 К |
CF2=CH2. |
|
|
- HCl |
|
- HCl |
|
Пиролиз 1,1-дифтор-1-хлорэтана рекомендуется проводить в присутствии 20-60% (мол.) воды при атмосферном или пониженном давлении и пребывании смеси в реакторе 1-15 с. Степень конверсии 1,1-дифтор-1-хлорэтана - ~ 48%, выход винилиденфторида на прореагировавший исходный продукт - более 98%.
1,1-Дифторэтан можно получать гидрофторированием ацетилена и не выделять его в чистом виде:
CH≡CH + 2HF |
HCF2—CH3 . |
Сырой продукт содержит не менее 3% C2H2 и 8% CH2=CHF. Катализатор получают пропиткой -Al2O3 раствором соли Bi с добавкой Mn. Катализатор содержит 0,1-20% Bi, 35-66% F, 24-42% Al, 0,1-10% Mn.
5.2.7. Получение перфторпроизводных углеводородов
Синтез тетрафторэтилена
Тетрафторэтилен (перфторэтилен) СF2=CF2 - газ без цвета и запаха с т.
кип. 196,7 К, т. пл. 130,4 К, плотностью 1,519 при 196,7 К.
Перфторэтилен является важнейшим фтормономером. На его основе синтезируют политетрафторэтилен, который по объему производства превосходит все остальные фторполимеры.
Перфторэтилен может быть получен пиролизом дифторхлорметана при
923-973 К:
2CHF2Cl  2CF2
2CF2  F2C=CF2 .
F2C=CF2 .
Пиролиз дифторхлорметана происходит согласно механизму:
CHF2Cl  CF2 + HCl
CF2 + HCl

208
|
CF2=CF2 |
|
2CF2 |
:CF2 HCF2CF2CF2Cl и т.д. |
|
CHF2Cl + :CF2 |
HCF2CF2Cl |
CF2=CF2 + :CF2  CF2—CF2
CF2—CF2  CF3─CF=CF2
CF3─CF=CF2
CF2 2CF2=CF2  CF2—CF2
CF2—CF2
CF2—CF2
Выход перфторэтилена возрастает с понижением давления, например путем разбавления инертным газом. Так, при давлении 49 кПа конверсия дихлорфторметана составляет 50%, а выход перфторэтилена - 90%. С увеличением степени конверсии возрастает доля высококипящих примесей в сырье. При разбавлении дифторхлорметана водяным паром в интервале соотношений (3:1)- (1:2), температуре пиролиза 1023-1173 К, времени пребывания реагентов 0,1- 0,4с степень конверсии дифторхлорметана составляет 65-70%, а выход перфторэтилена - 90-94%.
Перфторэтилен и перфторпропилен могут быть получены совместно при пиролизе фтороформа:
СF4  CF2=CF2 + CF2=CF—CF3.
CF2=CF2 + CF2=CF—CF3.
Фтороформ образуется как побочный продукт при производстве дифторхлорметана. Пиролиз фтороформа проводят в реакторе, изготовленном из никеля, при 1173-1473 К. Конверсия фтороформа при температуре пиролиза 1373 К, давлении 980 Па и времени контакта 0,03 с составляет 52,1%, выход целевых продуктов достигает 72,1%.
Продукты пиролиза разделяют экстрактивной дистилляцией с применением в качестве экстрагента перфторпропилена - одного из продуктов реакции. Перфторэтилен выделяют экстракцией растворителями с т. кип. 323-403 К.
Синтез гексафторбутадиена
Гексафторбутадиен (перфторбутадиен) CF2=CF—CF=CF2 получают по схеме:
CHF2CF2CF=CF2 Cl2 CHF2CF2CFClCF2Cl Br2
Zn
→ СBrF2CF2CFClCF2Cl → CF2=CF—CF=CF2.
Выход мономера составляет 72%.
Синтез перфторалленов
Перфтораллены получают из диперфторметилацетилена и перфторалкилиодидов в две стадии.
209
На первой стадии происходит гомолитическое присоединение перфто-
ралкилиодида по тройной связи (513 К): |
|
|
|
|
CF3C CCF3 + RFI |
CF3 |
I |
CF3 |
CF3 |
C=C |
+ |
C=C |
|
|
|
RF |
CF3 |
RF |
I |
На второй стадии перфториодэтилены подвергают пиролизу над свежеосажденным порошком меди:
Cu
RF(CF3)C=C(l)CF3 473→ К RF(CF3)C=C=CF2.
5.2.8. Получение других фторпроизводных углеводородов
Синтез трифторхлорэтилена
Трифторхлорэтилен (перфторвинилхлорид) CCIF=CF2 - газ с т. кип. 246,2 К, т. пл. 115,8 К, nD20 1,3960, d420 0,934. Его получают жидкофазным дехлорированием CCl2FCClF2 в среде метилового спирта при 323-423 К, 2 МПа, времени контакта 3-4 с в присутствии в качестве катализатора цинка:
CCl2F—CClF2 - Zn CClF=CF2.
ZnCl2
Газофазное дехлорирование проводят в среде водорода при 763-823 К и давлении 0,1 МПа в реакторе с медной сеткой.
Cинтез симм-дихлордифторэтилена
симм-Дихлордифторэтилен с выходом 90-95% получают дегалогенированием тетрахлордифторэтана цинком в среде этилового спирта:
CFCl2—CFCl2 Zn CFCl=CFCl.
C2H5OH
Синтез 3,3,3-трифторпропилена
3,3,3-Трифторпропилен CF3CH=CH2 - газ с т. кип. 498 К и d420 0,996 при
298 К.
3,3,3-Трифторпропилен получают в основном из акриловой кислоты:
СН2=CHCOOH HX (X=Cl, Br) XCH2CH2COOH SF4
|
Спирт. р-р KOH |
|
XCH2CH2CF3 |
--HX |
CH2=CH-CF3. |
Представляет интерес также синтез этого соединения при совместном электролизе пропионовой и трифторуксусной кислот:
CF3COOH  CF3, C2H5COOH -CO2,-Н2О CH2=CH2,
CF3, C2H5COOH -CO2,-Н2О CH2=CH2,

210
CH2=CH2 + CF3 |
|
|
|
|
CF3CH2—CH2, |
||
CF3CH2CH2 |
R |
CF3CH=CH2. |
|
-RH |
|||
|
|
5.2.9. Получение хладонов (фреонов)
Хладоны (фреоны) - хлорфторпроизводные алифатических углеводородов - широко используют в качестве хладоагентов холодильных установок. Фреоны обладают большими преимуществами по сравнению с другими хладагентами, например аммиаком. Они отличаются низкой токсичностью, не воспламеняются и не образуют взрывчатых смесей с воздухом, не оказывают коррозионного воздействия на металлы. Важной областью применения фреонов является аэрозольное распыление веществ. Некоторые фреоны являются промежуточными продуктами в производстве фторолефинов.
Для фреонов введены сокращенные обозначения соответствующие их химической формуле. Первая цифра справа обозначает число атомов фтора в молекуле фреона; вторая цифра (средняя) - на единицу больше числа атомов водорода; третья цифра - на единицу меньше числа атомов углерода. В цифровом обозначении фреонов - хлорфторпроизводных метана - третьей цифрой является ноль, который опускается. В табл. 5.2 приведены физические свойства наиболее важных фреонов.
Таблица 5.2.
|
Физические свойства фреонов |
|
|
||
|
|
|
|
|
|
Условное |
Формула |
Т. затв., К |
Т.кип., К |
Т.кр., К |
Ркр, |
обозначение |
|
|
|
|
МПа |
Ф-11 |
CCl3F |
162 |
296,8 |
471 |
4,32 |
Ф-12 |
CCl2F2 |
115 |
243,2 |
385 |
4,01 |
Ф-13 |
CClF3 |
92 |
191,5 |
301,8 |
3,81 |
Ф-14 |
CF4 |
89 |
145,1 |
- |
- |
Ф-21 |
CHCl2F |
138 |
281,9 |
451,5 |
5,10 |
Ф-22 |
CHClF2 |
113 |
232,2 |
369 |
4,87 |
Ф-23 |
CHF3 |
110 |
198,8 |
- |
- |
Ф-112 |
CCl2F-CCl2F |
299 |
365,8 |
551 |
3,40 |
Ф-113 |
CClF2-CCl2F |
238 |
320,6 |
487 |
3,37 |
Ф-114 |
CClF2-CClF2 |
179 |
276,6 |
418,7 |
3,21 |
Ф-124а |
CClF2-CHF2 |
156 |
262,8 |
399,7 |
3,67 |
Ф-142 |
C2H3ClF2 |
142,2 |
263,2 |
- |
- |
Ф-143 |
C2H3F3 |
261,7 |
225,4 |
- |
- |
Основным методом синтеза хлорфторуглеводородов является гидрофторирование соответствующих хлорпроизводных. При гидрофторировании тетрахлорметана получают преимущественно дифтордихлорметан:
nCCl4 |
HF |
CCl3F + CCl2F2 |
+ CClF3 |
|
|
||||
|
|
3% |
90% |
0,5% |
