
monomers-Платэ-книга
.pdf
291
ние получил жидкофазный синтез в барботажных реакторах. Без растворителя в таких реакторах можно винилировать спирты с т. кип. 393 К и выше. Катализаторами реакции служат гидроксиды щелочных металлов: NаОН, КОН, LiОН или их алкоголяты. Процесс осуществляют при 453-473 К. Выход эфира за один проход достигает 75%.
Содержание побочных продуктов при винилировании гликолей в оптимальных условиях не превышает 10%: предполагаемое образование циклических ацеталей в качестве основных продуктов винилирования гликолей с ОНгруппами в 1,2- и 1,3- положениях не реализуется.
Влияние длины углеводородного фрагмента молекулы спирта на содержание некоторых виниловых эфиров высших жирных спиртов представлено на рис. 8.2.
Рис. 8.2. Зависимость содержания простых виниловых эфиров от длины цепи углеводородных радикалов высших насыщенных спиртов.
Температура винилирования 453 К; концентрация
KOH - 5%.
1 – деканол-1 СН3(СН2)8СН2ОН;
2 – додеканол-1 СН3(СН2)10СН2ОН; 3 – тетрадеканол-1 СН3(СН2)12СН2ОН; 4 – гексадеканол-1 СН3(СН2)14СН2ОН; 5 – октадеканол-1 СН3(СН2)16СН2ОН.
Как видно из рисунка, с увеличением длины молекулы спирта время, необходимое для достижения равных степеней конверсии и одного и того выхода, уменьшается. Так, для достижения 90%-й конверсии в соответствующий эфир при винилировании децилового спирта требуется 5 ч, а при винилировании стеарилового спирта ~ 3 ч.
Высшие спирты являются ингибиторами полимеризации, поэтому чистота мономера оказывает существенное влияние на молекулярную массу образующегося полимера. Для получения полимеров с заданными свойствами содержание высших спиртов в исходном мономере не должно превышать 2%. Очистка виниловых эфиров высших спиртов проводится перегонкой под вакуумом при остаточном давлении 9,8-19,6 Па.
Из одноатомных спиртов легко винилируются первичные и вторичные спирты, в то время как третичные винилируются очень медленно и с низкими выходами. Эта закономерность характерна для всего гомологического ряда одноатомных спиртов.
В барботажных реакторах с применением растворителей можно получать виниловые эфиры спиртов С1-С5. В качестве растворителей используют высшие спирты, растворяющие 5-15% гидроксидов щелочных металлов.
292
Сравнивая способы получения виниловых эфиров винилированием спиртов С4 и выше ацетиленом, предпочтение следует отдать жидкофазным процессам при атмосферном давлении в отсутствие растворителя. Для винилирования спиртов С1-С3 этот способ неприменим, более удобным является непрерывное винилирование при повышенном давлении.
Винилирование спиртов при повышенном давлении
Основной способ получения поливиниловых эфиров в промышленности - винилирование спиртов при повышенном давлении ацетилена в присутствии гидроксидов щелочных металлов или их алкоголятов при повышенных температурах в среде растворителя ацетилена или без него.
Промышленное производство поливиниловых эфиров стало возможным после разработки безопасной технологии синтеза эфиров на основе ацетилена при повышенных температурах и давлении, поскольку при повышенном давлении ацетилен обладает способностью к спонтанному разложению. Разложение может закончиться взрывом, если поблизости имеется сильный источник энергии, причем взрыв происходит даже при отсутствии воздуха. Работы В. Реппе и его школы наметили два общих метода предотвращения взрывного разложения ацетилена.
Если необходимо использовать ацетилен с относительно небольшим парциальным давлением, его можно разбавлять инертным газом, например, азотом или пропаном. Степень разбавления должна быть достаточной для обеспечения безопасного ведения процесса: она зависит то температуры, природы газаразбавителя и давления процесса.
Однако этот метод неприменим, когда требуется высокое парциальное давление ацетилена. В этом случае свободное реакционное пространство в аппаратах ограничивают до минимума и для подвода ацетилена используют трубы малого диаметра, а трубопроводы диаметром более 25 мм заполняют насадкой типа стальных колец Рашига диаметром 12,5 мм или еще меньше. Такое разбиение свободного пространства в аппаратах весьма эффективно предотвращает образование и распространение взрывной волны. В таком случае вместо взрывного разложения ацетилена происходит его медленное разложение, сопровождающееся 12-кратным повышением давления по сравнению с первоначальным.
Винилирование можно проводить как периодическим, так и непрерывным способом.
Непрерывное винилирование осуществляют по следующей схеме. В реактор башенного типа загружают безводный спирт и щелочь или алкоголят щелочного металла. Смесь ацетилена с инертным газом проходит через компрессор, где сжимается требуемого давления, и поступает в нижнюю часть реактора. Пары винилового эфира направляются в ректификационную колонну, кото-

293
рая служит для отделения образовавшегося винилового эфира от непрореагировавшего спирта, ацетилена и инертного газа.
Периодические процессы проводят в автоклавах высокого давления с применением соответствующих защитных мер при 400-530 К в присутствии растворителя ацетилена с периодической с периодической подачей ацетилена в автоклав.
Общими недостатками непрерывных и периодических способов производства поливиниловых эфиров при повышенном давлении являются взрывоопасность, снижение концентрации ацетилена в реакционной зоне за счет разбавления его инертным газом или исходным спиртом, что ведет к снижению скорости процесса и степени конверсии, а также к необходимости применения специального оборудования.
8.3.2. Другие методы получения простых виниловых эфиров
Пиролиз ацеталей ацетальдегида. Виниловые эфиры могут быть полу-
чены пиролизом ацеталей ацетальдегида при 473-673 К над катализатором – мелкораздробленным благородным металлом:
OR
CH3—CH |
CH2=CH—OR + ROH |
OR
Например, винилэтиловый эфир получают пропусканием паров диэтилацеталя ацетальдегида через палладий на асбесте при 543 К, а н-винилбутиловый эфир из дибутилацеталя - при 573 К.
Применяемые для пиролиза ацетали получают взаимодействием ацетальдегида с соответствующими спиртами. Реакция легко протекает с первичными спиртами, но довольно трудно с вторичными.
Несмотря на такие недостатки процесса, как многостадийность, необходимость предварительного синтеза ацеталей, применение дорогостоящего катализатора, высокая температура синтеза, пиролиз виниловых эфиров соответствующих ацеталей ацетальдегида осуществляется в промышленном масштабе.
Переэтерификация. Виниловые эфиры получают также реакцией обмена низших винилалкиловых эфиров с соответствующим спиртом. Синтез осуществляется как в жидкой, так и в паровой фазах, реакция катализируется солями
ртути: |
Hg2+ |
CH2=CH + R OH |
CH2=CH + ROH. |
OR |
OR |
Переэтерификацию в жидкой фазе проводят простым смешением реагентов вместе с катализатором и выдерживанием смеси при комнатной температуре в течение длительного времени. Степень конверсии в соответствующий эфир можно увеличить, непрерывно удаляя образующийся спирт из сферы реакции.
Переэтерификацию в паровой фазе проводят при 523-573 К.

294
Виниловые эфиры высших спиртов получают также переэтерификацией с низшими виниловыми эфирами в жидкой фазе в присутствии ацетата ртути.
В лабораторной практике используют алкоголиз винилацетата в присутствии солей ртути минеральных кислот:
CH2=CH—OCOCH3 + ROH  CH2=CH—OR + CH3COOH.
CH2=CH—OR + CH3COOH.
Хотя переэтерификация и реализована в промышленности, этот метод обладает рядом серьезных недостатков по сравнению с прямым винилированием спиртов. Основные недостатки метода: это токсичность применяемого катализатора; необходимость получения низшего винилового эфира; продолжительное время реакции, снижающее производительность установки.
Дегидрирование -галогенэфиров. Этот метод используют для получения винил-2-хлорэтилового эфира. При нагревании жидкого 2,2- дихлордиэтилового эфира с твердым гидроксидом натрия образуются винил-2- хлорэтиловый эфир, диоксан и небольшие количества ацетальдегида и дивинилового эфира:
ClCH2CH2OCH2CH2Cl |
NaOH |
CH2=CH—OCH2CH2Cl + NaCl + H2O. |
|
Исходный дихлорэтиловый эфир является побочным продуктом при синтезе этиленхлоргидрина из этиленоксида и хлорида водорода.
Получение из этилена и спиртов. Простые виниловые эфиры получают также взаимодействием соответствующих спиртов и этилена в присутствии комплексов двухвалентного хлорида палладия или металлического палладия.
Из сравнения способов получения виниловых эфиров очевидно, что наиболее эффективным является синтез из ацетилена и соответствующих спиртов при атмосферном давлении. Достоинства этого способа: высокий выход продукта, непрерывность и одностадийность, доступность и низкая стоимость сырья. Все другие процессы протекают при высоких температурах в присутствии дорогостоящих катализаторов и требуют предварительного синтеза либо ацеталей ацетальдегида, либо винилалкиловых эфиров.
8.4. СЛОЖНЫЕ ВИНИЛОВЫЕ ЭФИРЫ. ВИНИЛАЦЕТАТ
Сложные виниловые эфиры RCOO—CH=CH2 получают винилированием карбоновых кислот при давлении ~ 1,5 МПа и температуре ~ 423-523 К в присутствии солей цинка соответствующих кислот.
Полимеры сложных виниловых эфиров карбоновых кислот - термопластичные, эластичные (R = C5-C12) или воскообразные (R>C12) полимеры. Наибольшее значение из сложных поливиниловых эфиров имеет поливинилацетат. Полимер винилпропионата – ингибитор неблагоприятных биологических про
295
цессов при длительном хранении зерна, а сам винилпропионат - внутренний пластификатор при сополимеризации с винилхлоридом, винилиденхлоридом, винилацетатом.
Винилацетат (виниловый эфир уксусной кислоты) является одним из важнейших мономеров в производстве пластических масс, в частности поливинилацетатных полимеров. Первое упоминание о винилацетате относится к 1909 г., а в 1912 г. он был впервые получен и выделен Ф. Клатте.
Винилацетат - бесцветная жидкость с т. пл. - 373,2 К, т. кип.- 345,7 К, nd20 1,3953, d420 0,9342. Хорошо растворим в обычных органических растворителях, растворимость в воде при 293 К составляет 2,0-2,4% (мас.). Винилацетат образует азеотропные смеси с водой, спиртами, углеводородами.
Полимерные материалы, полученные на основе винилацетата, обладают рядом ценных свойств: хорошими адгезионными и связующими свойствами, светостойкостью, хорошими оптическими, электроизоляционными, волокнообразующими, механическими свойствами. Это определяет широкий спектр использования полимерных материалов на основе винилацетата в различных областях промышленности. Винилацетат хорош и для совместной полимеризации с этиленом и винилхлоридом. Из производных винилацетата наибольшим спросом пользуются сополимеры винилацетата с дибутилмалеатом, дибутилфумаратом, 2-этилгексилакрилатом. Широко применяется также поливинилбутираль, предназначенный для изготовления безосколочных стекол.
На схеме 8.1 показаны основные направления применения винилацетата.
Впроизводстве винилацетата в качестве сырья используют ацетилен, этилен, ацетальдегид или метанол. Конкурентоспособность того или иного метода
взначительной степени определяется доступностью и стоимостью исходных продуктов. До 1967 г. винилацетат производился только из ацетилена и уксусной кислоты парофазным методом.
В1981 г. уже 66% производимого в мире винилацетата вырабатывалось на базе этилена и уксусной кислоты, 33% - на основе ацетилена и уксусной кислоты и 1% - из ацетальдегида и уксусного ангидрида. В последние годы наблюдается тенденция к переходу на более дешевые и доступные виды сырья. Например, в США винилацетат производят на основе метанола, в Западной Европе - в основном производят на базе этилена.

297
Жидкофазную технологию производства винилацетата в промышленности в настоящее время практически не применяют из-за ее нерентабельности.
Парофазный метод получения винилацетата. Впервые промышленное производство винилацетата в паровой фазе из ацетилена было организовано в Германии в 1928 г.
Как катализатор в процессе парофазного синтеза используется ацетат цинка, нанесенный на активированный уголь или другой носитель с развитой поверхностью. В качестве активного компонента можно применять также ацетат кадмия или смесь ацетатов цинка и кадмия. Кроме активированного угля носителями могут служить также оксид алюминия, пемза, силикагель. Как промотирующую добавку используют бихромат калия.
Парофазный синтез винилацетата сопровождается образованием до 60% побочных продуктов, из которых самым значительным является ацетальдегид; его содержание в винилацетате-сырце составляет 0,5-1,8%. В условиях синтеза ацетальдегид может получаться в результате протекания следующих реакций:
- гидратации ацетилена
CH CH + H2O  CH3CHO;
CH3CHO;
-разложения винилацетата с образованием кетена
CH2=CH―OCOCH3 CH3CHO + CH2=C=O;
CH3CHO + CH2=C=O;
кетен далее присоединяется к уксусной кислоте с образованием уксусного ангидрида:
CH2=C=O + CH3COOH  (CH3CO)2O
(CH3CO)2O
- гидролиза винилацетата
СH2=CH―OCOCH3 + H2O |
CH3CHO + CH3COOH. |
Вода, необходимая для этой реакции, содержится в качестве примеси в уксусной кислоте или образуется в результате разложения уксусной кислоты:
2CH3COOH  CH3COCH3 + CO2 + H2O .
CH3COCH3 + CO2 + H2O .

299
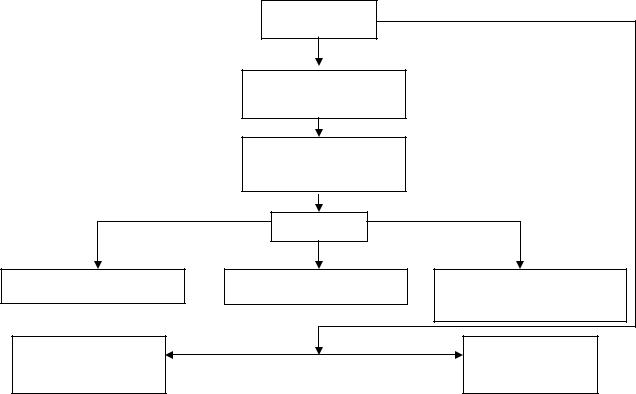
Реакцию проводят в жидкой фазе в присутствии в качестве катализатора 0,4% серной кислоты. В качестве катализатора можно использовать также бензол- или толуолсульфоновую кислоту. При 383-390 К реакция протекает с 50- 60%-ным выходом целевого продукта. Один из вариантов этого процесса реализован в колонне, состоящей из 60 тарелок, при температуре в нижней части колонны 413 К и в верхней - 363-383 К. Принципиальная технологическая схема производства винилацетата по этому методу представлена на рис. 8.3.
Ацетальдегид и уксусный ангидрид вводят в реакционный аппарат 1. Продукты реакции в виде дистиллята выводят из реактора сверху, жидкий остаток подают в испаритель 2, работающий под вакуумом, в котором происходит отделение твердых частиц. Продукты испарения конденсируют и возвращают в реактор. Из дистиллята, поступающего из реактора 1 в колонну 4, выделяют высококипящие побочные продукты, а из верхней части колонны отбирают легкокипящие продукты, которые и подают в ректификационную колонну 5.
Рис. 8.3. Принципиальная технологическая схема производства винилацетата (ВА) из ацетальдегида и уксусного ангидрида
1 – реактор; 2 – испаритель; 3, 8-11 – теплообменники; 4 – реакционная колонна; 5 – ректификационная колонна отделения легких фракций; 6 – ректификационная колонна выделения уксусной кислоты; 7 - ректификационная колонна выделения винилацетата ВА.
Потоки: I – ацетальдегид; IIуксусный ангидрид; III – винилацетат; IV – твердые отходы; V – уксусная кислота
300
Головную фракцию колонны 5, содержащую ацетальдегид и другие низкокипящие соединения, смешивают с кубовой жидкостью реакционной колонны 4 и возвращают в реактор 1. Кубовую жидкость ректификационной колонны 5 подают в колонну 6, из которой удаляют уксусную кислоту .
Кубовый остаток возвращают в реакционную колонну и колонну для разделения легких фракций. Головная фракция колонны 6 поступает в ректификационную колонну 7, из которой винилацетат выделяют в виде бокового потока. Дистиллят направляют в колонну 5 для разделения легких фракций, а кубовую жидкость - в колонну 6 выделения уксусной кислоты.
Синтез винилацетата из этилена и уксусной кислоты
Жидкофазный метод получения винилацетата. В промышленности получение винилацетата из этилена и уксусной кислоты осуществляют двумя методами: жидкофазным и парофазным. Научные основы жидкофазного способа получения винилацетата из этилена и уксусной кислоты были разработаны в Советском Союзе И.И. Моисеевым и М.Н. Варгафтиком. В качестве катализатора применяли соли палладия, а в качестве сокатализатора для окисления металлического палладия - карбоновые кислоты, соли меди или кислород. Промышленное производство винилацетата на основе этилена жидкофазным методом впервые было осуществлено в 1966 г. английской фирмой "АйСиАй".
Процесс осуществляют в интервале температур 353-403 К и давлении 1,0- 7,0 МПа. Образование винилацетата из этилена и уксусной кислоты в присутствии соли палладия можно представить следующим уравнением:
CH2=CH2 + CH3COOH + PdCl2 CH2=CH―OCOCH3 + 2HCl + Pd.
CH2=CH―OCOCH3 + 2HCl + Pd.
Высвобождающийся в результате каталитического цикла металлический палладий вновь переводится в степень окисления +2 путем взаимодействия с редокс-системой, в качестве которой используют соли любого поливалентного металла, имеющего большой потенциал окисления, предпочтительно соли меди. Для поддержания меди в степени окисления +2 в реактор периодически или непрерывно добавляют соляную кислоту:
Pd + 2CuCl2 PdCl2 + 2CuCl
PdCl2 + 2CuCl
2CuCl + 2HCl + 0,5O2 2CuCl2 + H2O.
2CuCl2 + H2O.
Как правило, к катализаторному раствору добавляют карбоксилаты щелочных или щелочноземельных металлов, например ацетаты лития, калия, натрия и

 CH
CH CH
CH CH
CH CH
CH CH
CH CH
CH CH
CH ZnO + CH
ZnO + CH CH
CH