
monomers-Платэ-книга
.pdf
331
9.3. ПРОПИЛЕНОКСИД
Пропиленоксид (метилоксиран; 1,2-пропиленоксид) H2C—CH-CH3
O
- бесцветная прозрачная жидкость с т. пл. 161 К, т. кип. 307,3 К, растворяется в большинстве органических растворителей и в воде: при 283 К растворяется 40,8% (мас.) пропиленоксида.
Пропиленоксид был получен Озером по реакции 1-хлорпропанола-2 с оксидом свинца и водой:
ClCH2CH(OH)CH3 H2C—CH-CH3
H2C—CH-CH3
O
Сополимеры полипропиленоксида получают полиприсоединением пропиленоксида к гликолям – моно- и дипропиленгликолям, бутандиолам, триолам
– глицерину, триметилолпропану, пентаэритриту, сорбиту, глюкозе - и другим полифункциональным спиртам.
Низкомолекулярный полипропиленокcид и его сополимеры с этиленоксидом, тетрагидрофураном используют для производства полиуретанов, а сополимеры пропиленоксида с аллилглицидиловым эфиром - в качестве эпоксидных каучуков (дайнаджен, парел):
[—OCH2CH—]n—[—OCH2CH—]n
CH3 CH2OCH2CH=CH2
Эти каучуки применяют главным образом в производстве деталей для автомобилей (шланги, прокладки и др.), в перспективе их можно будет использовать для изготовления озоностойких покрытий, антивибраторов, амортизаторов.
Пропиленоксид находит также применение во многих областях народного хозяйства: для получения полипропиленгликолей, пропиленгликоля-1,2 и его производных, используемых в производстве ненасыщенных полиэфиров, изопропаноламинов, исходных продуктов для получения ПАВ и главным образом гибких пенополиуретанов. В некоторых случаях пропиленоксид вытеснил этиленоксид, так как его применение в качестве сырья оказалось намного эффективнее с точки зрения охраны окружающей среды (например, в производстве эфиргликолей). Основные способы получения пропиленоксида представлены на схеме 9.1.
В отличие от способа получения этиленоксида окислением этилена, характеризующегося высоким выходом основного продукта и низким образованием СО2 и различных примесей, для большинства способов получения пропиленоксида характерно образование значительных количеств побочных продуктов, которые в мольном соотношении превосходят выход основного продукта.
333
9.3.1. Получение пропиленоксида прямым окислением кислородом
При прямом окислении пропилена, как каталитическом, так и некаталитическом, выход пропиленоксида не превышает 25% (при окислении этилена выход оксида составляет 40%).
Окисление пропана
Пропиленоксид в США и Японии производится как побочный продукт при окислении пропана при 673 К и давлении 2,0 МПа до метанола, формальдегида, ацетальдегида и уксусной кислоты. Кроме пропиленоксида образуются акролеин, ацетальдегид, формальдегид и диоксид углерода.
Примерно четвертая часть от вводимого сырья окисляется в ходе процесса до СО2, другая четверть превращается в оксид пропилена, а оставшееся сырье – в ацетальдегид и формальдегид. Стадия выделения и очистки пропилена является наиболее дорогостоящей. На 1 т пропиленоксида образуется ~12 т сточных вод, загрязненных большими количествами токсичных веществ.
Ниже приведены параметры процесса получения пропиленоксида окислением пропана:
Компоненты |
Расход пропана, |
Селективность, |
|
кг/кг пропиленоксида |
кг/кг пропана |
||
|
|||
Пропан |
3,11 |
- |
|
Кислород |
4,17 |
- |
|
Технологическая вода |
10,20 |
- |
|
Оксид кальция |
- |
- |
|
Охлаждающая вода |
0,3 |
- |
|
Ацетальдегид |
- |
0,77 |
|
Формальдегид |
- |
0,66 |
|
СО2/СО |
- |
2,43 |
|
Другие вещества |
- |
0,10 |
|
Сточные воды |
- |
12,00 |
Этот метод, однако, не получил большого распространения.
Некаталитическое жидкофазное окисление пропилена
Окисление пропилена проводят молекулярным кислородом в жидкой фазе при температуре ~ 433 К и давлении 5,0-6,0 МПа. По технологии, разработанной фирмой "Монсанто", в качестве растворителя используют диацетат пропиленгликоля, фирма "Петрокарбон Девелопмент" (США) применяет смесь изопропанола с уксусной кислотой. Выход пропиленоксида по технологии фирмы "Монсанто" достигает 40%. В получаемой смеси продуктов содержание уксусной кислоты равно ~11%, а 30-40% составляют другие продукты.
334
Хотя по сравнению с парофазными методами в данном методе выход продукта более высокий, однако из-за образования большого количества побочных продуктов, сложности их разделения, очистки, а также проблем, возникающих вследствие коррозии оборудования из-за присутствия уксусной и муравьиной кислот, он не нашел применения в промышленности.
Каталитическое жидкофазное окисление пропилена
В качестве катализаторов окисления применяютиспользуют неорганические и органические соединения кобальта, марганца, хрома, рения, меди, арсениты, соединения фосфора, хлоруксусной кислоты, эфиры борной кислоты. Избирательность по пропиленоксиду составляет 50-70%. Выход, равный 87%, наблюдался при использовании в качестве катализатора суспензии серебра в среде эфиров фталевой кислоты при 433 К. В промышленности этот способ не нашел применения.
Жидкофазное окисление пропилена пероксисоединениями
Более перспективными являются процессы, в которых окисляющий агент (пероксид, надкислоты, гидропероксиды) образуется не in situ из кислорода и пропилена, а вводится в реактор.
Окисление пропилена пероксидом водорода. Реакция окисления про-
пилена пероксидом водорода осуществляется только в присутствии органических кислот (уксусной или муравьиной), катализаторов (осмия, рения, молибдена) или специальных органических растворителей при 288-353 К.
Теоретически при взаимодействии пропилена с Н2О2 в присутствии карбоновых кислот должны образовываться пропиленоксид и вода. На практике в результате протекания побочных реакций выход гликолей и их эфиров превышает выход пропиленоксида. Промышленное применение данного способа определяется стоимостью Н2О2. Полузаводская установка по производству пропиленоксида с применением пероксида водорода создана в Бельгии фирмой "Пропилокс СА".
Фирмы "Байер" и "Дегусса" (ФРГ) разработали непрерывный метод получения пропиленоксида с применением в качестве окислителя надропионовой кислоты, образующейся при рециркуляции пропионовой кислоты и Н2О2 в присутствии серной кислоты.
Окисление пропилена пероксидами. Различные пути прямого окисле-
ния пропилена до пропиленоксида в промышленном плане потерпели неудачу. Это связано с тем, что при прямом окислении пропилена именно метильная группа окисляется легче всего, что приводит к существенному снижению селективности и образованию большого количества трудно разделяемых кислородсодержащих продуктов. Проблема была решена при использовании вместо кислорода в качестве окислителя гидропероксидов (ROOH) или надкислот
(RCOOOH).
Основная трудность в случае применения гидропероксидов или надкислот для фиксации кислорода заключается в том, что использование этих со-

335
единений в количествах, близких к стехиометрии, приводит к одновременному получению спирта или кислоты:
СН3—СН=СН2 + ROOH  СН3-СН—СН2 + ROH,
СН3-СН—СН2 + ROH,
СН3—СН=СН2 + RCOOOH |
О |
СН3-СН—СН2 + RСОOH |
О
Существует много пероксидных соединений, которые могут выполнять функцию окислителя в процессах получения пропиленоксида, однако, из-за экономических соображений используют гидропероксиды трет-бутила и этилбензола, а также надуксусную и надпропионовую кислоты в качестве перкислот.
Окисление органическими надкислотами. Органические надкислоты -
надмуравьиная, надуксусная, надмалеиновая, надфталевая и другие реагируют с пропиленом с образованием пропиленоксида и соответствующих карбоновых кислот. Скорость эпоксидирования во многом зависит от природы растворителя и снижается в ряду: уксусная кислота, тетрахлорид углерода, бензол, метилэтилкетон, метанол, ацетон, этилацетат. Предпочтительной является надуксусная кислота, которая получается в процессе окисления пропилена в этилацетате или уксусной кислоте. Фирма "Дайсел" (Япония) реализовала этот метод на установке мощностью ~ 120000 т/год.
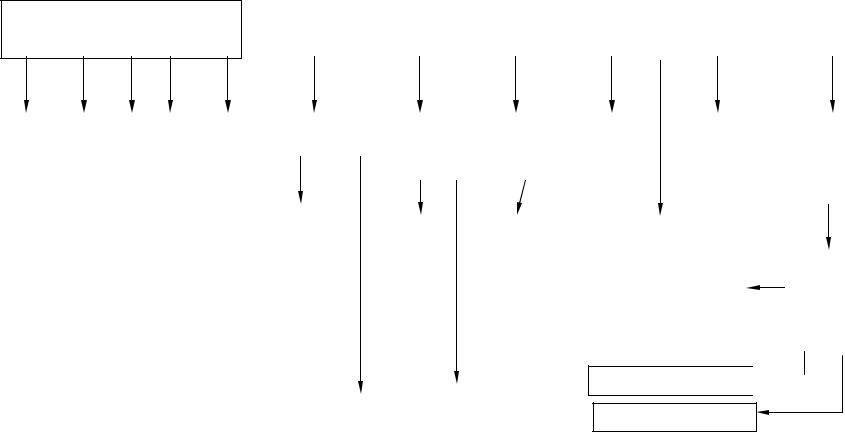
На рис. 9.6 приведена схема установки синтеза пропиленоксида с использованием надуксусной кислоты.
Рис. 9.6. Схема установки синтеза пропиленоксида с применением надуксусной кислоты (по данным компании "Дайсел")
1 - абсорбер; 2 - концентратор; 3 - реакция; 4 – блок отделения пропиленоксида; 5 – блок перегонки под давлением; 6 – блок отделения приме-

336
сей из этилацетата; 7 – блок разложения надкислоты; 8 – блок отделения уксусной кислоты; 9 – блок очистки оксида пропилена; 10 – блок отгонки легких фракций.
Потоки: I – уксусная кислота; II – этилацетат; III - надуксусная кислота; IV – газообразные продукты (СО2, СН4, С2Н4, О2, С3Н6); V - смесь продуктов; VI – пропилен+пропан; VII – пропилен; VIII – пропан; IX – уксусная кислота+надуксусная кислота; X – этилацетат; XI – азот; XII – эфиры гликоля; XIII –этилацетат и другие продукты; XIV – легкие фракции; XV – оксид пропилена
Окисление органическими гидропероксидами. Окисление пропилена органическими гидропероксидами нашло уже применение в промышленности и рассматривается как весьма перспективное.
Для получения органических гидропероксидов можно использовать изобутан, при окислении которого образуется трет-бутилгидропероксид:
CH3 |
CH3 |
CH3 |
||||
|
|
|
|
|
|
|
2CH3—C—H + 1,5O2 |
CH3 |
|
—C—OOH + CH3—C—OH |
|||
|
||||||
CH3 |
CH3 |
CH3 |
||||
|
|
трет-Бутил- |
трет-Бутанол |
|||
гидропероксид
Окисление кислородом протекает в жидкой фазе в отсутствие катализатора при 383-403 К, давлении 3-3,5 МПа, продолжительности процесса ~ 7 ч при конверсии изобутана ~ 35%. Общий выход гидропероксида и спирта на прореагировавший изобутан равен ~ 95%.
Эпоксидирование пропилена
Эпоксидирование проводят в жидкой фазе с использованием в качестве катализатора раствора нафтената молибдена в смеси гидропероксида и пропилена:
CH3 |
|
CH3 |
||
|
|
|
|
|
CH3—C—OOH + CH3—CH=CH2 |
CH3—HC—CH2 + CH3—C—OH |
|||
CH3 |
O |
CH3 |
||
Процесс протекает при 353-383 К, 3-4 МПа при мольном соотношении гидропероксид:спирт:пропилен, равном 1:1:3. Общее время пребывания реагентов в реакторах составляет 2,5 ч. Степень конверсии гидропероксида достигает 90-95%, пропилена - 15%. Селективность образования пропиленоксида и спирта по гидропероксиду составляет соответственно 85% и 95%.
Теоретически на каждый моль пропиленоксида должно образоваться два моля трет-бутанола, т.е. 2,51 т трет-бутанола на 1 т пропиленоксида. Практически же образуется ~ 3 т трет-бутанола на 1 т пропиленоксида, что несколько ухудшает технико-экономические показатели процесса.

337
Процесс осуществляют в жидкой фазе в присутствии в качестве катализатора М2О3 и нафтената калия для регулирования рН реакционной смеси.
В табл. 9.3 приведены носители кислорода (пероксидные соединения), способные вступать в реакцию с образованием конечных продуктов.
Таблица 9.3
Реакционные системы, применяемые при синтезе пропиленоксида
Сырье |
Пероксидное соединение |
Побочный |
Конечный |
|
продукт |
продукт( |
|||
|
|
|||
Ацетальдегид |
Надуксусная кислота |
Уксусная кислота |
- |
|
|
|
|
|
|
Изопропиловый |
То же |
Ацетон |
Изопропиловый |
|
спирт |
спирт |
|||
|
|
|||
Изобутан |
трет-Бутилгидропероксид |
трет-Бутанол |
Изобутан |
|
|
|
|
|
|
Изопентан |
трет- |
трет-Пентанол |
Стирол |
|
Пентилгидропероксид |
||||
|
|
|
||
|
|
Метилфенил- |
|
|
Этилбензол |
Этилбензилгидропероксид |
Стирол |
||
карбинол |
||||
|
|
|
||
Кумол |
Кумилгидропероксид |
Диметилфенил- |
Метилстирол |
|
карбинол |
||||
|
|
|
||
Циклогексан |
Циклогексилпероксид |
Циклогексанол |
Циклогексанон |
|
|
|
|
|
Метод получения пропиленоксида с применением гидропероксидов реализован в промышленном масштабе фирмой "Оксиран Корпорейшн" (Голландия)
иимеет широкие перспективы.
9.3.2.Получение пропиленоксида окислением пропилена через пропиленхлоргидрин
Пропиленоксид может быть получен по такому же способу, что и этиленоксид, т.е. путем гидролиза хлоргидрина щелочами. В промышленности взаимодействие пропилена и электролизного хлора происходит в присутствии воды, при этом от образовавшихся пропиленхлоргидринов под действием избытка Са(ОН)2 отщепляется HCl с образованием пропиленоксида и СаС12. При этом протекают следующие реакции:
Cl2 + H2O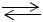 HOCl + HCl
HOCl + HCl
 ClCH2CH(OH)CH3
ClCH2CH(OH)CH3
2CH2=CHCH3 + 2HOCl
 CH3(OH)CHClCH3 ClCH2CH(OH)CH3 + 0,5Ca(OH)2
CH3(OH)CHClCH3 ClCH2CH(OH)CH3 + 0,5Ca(OH)2
H2C—CH-CH3 + 0,5CaCl2 + H2O. O

338
В результате взаимодействия хлора с пропиленом и хлоргидрином в качестве побочных продуктов образуются дихлорпропан и дихлордиизопропиловый эфир:
ClCH2CH(OH)CH3 + 0,5Cl2 |
ClCH2CH(OCl)CH3, |
ClCH2CH(OCl)CH3 + CH2=CHCH3  ClCH2CH(CH3)—O—CH(CH3)CH2Cl,
ClCH2CH(CH3)—O—CH(CH3)CH2Cl,
CH2=CHCH3 + Cl2 ClCH2CH(Cl)CH3
Как и в случае этиленхлогидрина, для подавления побочных реакций желательно вести процесс при температуре ниже 323-333 К. Омыление пропиленхлоргидрина в пропиленоксид происходит в основном аналогично образованию этиленоксида. Скорость образования пропиленоксида значительно ниже (примерно в 10 раз), чем при производстве этиленоксида.
9.4. ФЕНИЛЕНОКСИД
Фениленоксид является гипотетическим мономером для получения полифениленоксидов - твердых термопластичных бесцветных полимеров преимущественно линейного строения общей формулы (—OC6H4-xRx—)n, где
R= Alk, Hal, C6H5, All (х=0÷2).
Впромышленности выпускают поли-2,6-диметил-п-фениленоксид (арилокс), который сочетает высокую прочность поликарбонатов и хорошие диэлектрические свойства фторопластов. Его применяют в качестве конструкционного и электроизоляционного материала в автомобилестроении, электронике, электро- и радиотехнике, для изготовления высокочастотной изоляции радарных установок, типографских матриц, печатных схем, деталей протезов.
Полифениленоксид получают окислительной дегидрополиконденсацией замещенных (преимущественно в положениях 2 и 6) фенолов и п- галогенфенолов:
|
|
|
|
|
|
|
|
Rx |
OH + n/2 О2 |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R xO |
|
|
|
|
|
H + Н2О, |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Rx |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rx |
|
|
|
|
|
H |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
n X |
|
|
|
|
|
|
|
|
|
|
|
OH |
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
М |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
где М - щелочной металл, Х – Hal.

339
9.5. АЛЛИЛГЛИЦИДИЛОВЫЙ ЭФИР
Аллилглицидиловый эфир
CH2=CH—CH2—O—CH2—НС—CH2 \ /
О
применяется для получения пропиленоксидного каучука – сополимера пропиленоксида с аллилглицидиловым эфиром:
[—OCH2CH—]n—[—OCH2CH—]m
CH3 CH2—O—CH2—CH=CH2
Содержание аллилглицидилового эфира составляет ~ 2% (мол.). Каучук может эксплуатироваться в широком интервале температур от 213 до 423 К, обладает высокой термо- и озоностойкостью, низкой степенью набухания в минеральных маслах. Пропиленоксидный каучук применяют в производстве деталей для автомобилей (шланги, прокладки и др.). Он может также использоваться в производстве шин, озоностойких покрытий, амортизаторов.
Аллилглицидиловый эфир - бесцветная жидкость, т. кип. 426,9 К, ограниченно смешивается с водой, хорошо растворяется в спирте, эфире.
В промышленности аллилглицидиловый эфир получают конденсацией аллилового спирта с эпихлоргидрином в присутствии кислых катализаторов.
Технология получения аллилглицидилового эфира из аллилового спирта и эпихлоргидрина, разработанная специалистами Всесоюзного научноисследовательского института органических соединений (ВНИИОС, г.Москва), включает две стадии.
На первой стадии происходит катализируемое кислотами присоединение аллилового спирта к эпихлоргидрину с раскрытием оксиранового кольца и образованием гидроксиэфира:
CH2=CH—CH2OH + H2C—CHCH2Cl  CH2=CH-CH2OCH2CH(OH)CH2Cl.
CH2=CH-CH2OCH2CH(OH)CH2Cl.
O
В качестве катализатора применяют серную кислоту в концентрации 1,2% от массы реакционной смеси. Реакцию проводят при 373 К. Аллиловый спирт берут с избытком (5:1). Полное превращение эпихлоргидрина происходит за 1,5- 2,5 часа.
На второй стадии полученную реакционную массу нейтрализуют раствором гидроксида натрия при охлаждении:
CH2=CH-CH2OCH2CH(OH)CH2Cl + NaOH
 CH2=CH-CH2OCH2—HC—CH2 + NaCl.
CH2=CH-CH2OCH2—HC—CH2 + NaCl.
O

340
Затем отделяют хлористый натрий и при пониженном давлении отгоняют непрореагировавший аллиловый спирт.
9.6.ЭПИХЛОРГИДРИН
Впромышленности выпускают эпихлоргидриновые каучуки двух типов:
гомополимер эпихлоргидрина [—СН2СН(СН2С1)О—]n, сополимер эпихлоргидрина с этиленоксидом [—СН2СН(СН2С1)ОСН2СН2O—]n и терполимер эпихлоргидрина, этиленоксида и аллилглицидилового эфира
[—СН2СН(СН2С1)ОСН2СН2O—]n-СН2—СН(CH2OCH2CH=CH2)O.
Эпихлоргидриновые каучуки применяют для производства маслостойких деталей (шланги, прокладки, рукава и др.), используемых в нефтяной промышленности, авто- и авиастроении. Гомополимер применяют также как огнестойкий материал.
Эпихлоргидрин (1-хлор-2,3-эпоксипропан; хлорметилоксиран) – бесцветная жидкость с резким неприятным запахом; т. пл. 216 К, т. кип. 389,11 К.
H2C—CH-CH2Cl
\ /
О
Помимо производства эпихлоргидриновых каучуков эпихлоргидрин используют также для получения эпоксидных олигомеров, содержащих глицидиловые (I), либо эпоксидные (II) группы
—CH2—CH—CH2 ; |
С—С |
O |
О |
(I) |
(II) |
Эпоксидные олигомеры, содержащие в молекуле глицидиловые группы, синтезируют из эпихлоргидрина или глицидола и соединений с активным атомом водорода - спиртами, фенолами, тиофенолами, карбоновыми кислотами, аминами, амидами и т.д.
Кат. NаОН
RH2 + CH2—CH-CH2Cl HRCH2CHCH2Cl
HRCH2CHCH2Cl
O |
OH |
RН2
HRCH2-CH—CH2 |
|
HRCH2 |
|
CHCH2RH |
и т.д. |
|
|
||||
O |
Кат. |
|
|
OH |
|
|
|


