
monomers-Платэ-книга
.pdf321
ния с хладоагентом. Закалку проводят путем впрыскивания формалина, воды или охлажденных отходящих газов в продукты реакции. Чаще всего для охлаждения продуктов реакции используют установку теплообменника под слоем катализатора.
Вреакции окислительного дегидрирования метанола стехиометрически на 1 моль метанола расходуется 0,5 моля кислорода. Однако если использовать
метанольно-воздушную смесь с мольным отношением О2:СН3ОН, равным 0,5, то система будет находиться во взрывоопасном состоянии. Поэтому па практи-
ке мольное отношение О2:СН3ОН поддерживают на уровне 0,3-0,33. Разбавление исходной смеси инертными газами или абгазами сужает концентрационные пределы взрывоопасной области, так как парциальное давление паров метанола
ивоздуха уменьшается, что позволяет значительно увеличить мольное соотношение кислород : метанол без изменения температуры. Разбавление спиртовоздушной смеси инертными газами является одним из способов повышения общей конверсии метанола, которая достигает в этом случае 85-90%.
Противоположный характер носит изменение конверсии метанола: сначала она заметно возрастет, а затем ее рост замедляется, ассимтотически приближаясь к 97-98%. Таким образом, оптимальным разбавлением является соотношение инертный газ : метанол, равное (5-3) : 1. Мольное соотношение кислород:метанол в этих случаях достигает 0,35-0,42. В качестве разбавителя применяют азот, аргон, абгазы.
Впромышленных аппаратах линейная скорость поддерживается на уров-
не 0,7-1,5 м/с, что соответствует объемной скорости по жидкому сырью 2433 ч-1. Сопоставление этой величины с объемной скоростью процесса в кинетической области (0,2 ч-1) свидетельствует о том, что производительность серебряного катализатора во внешнедиффузионной области примерно на два порядка выше, чем в кинетической.
Катализаторы окислительного дегидрирования метанола
На промышленных установках по получению формальдегида из метанола используют катализаторы трех типов: трегерные (нанесенные) серебряные, компактные серебряные и оксидные.
В качестве трегерного катализатора наибольшее распространение получил катализатор серебро на пемзе. Компактные катализаторы представлены серебряными сетками, губчатым серебром, кристаллами. В качестве оксидных катализаторов применяют оксиды кобальта, меди, марганца, кальция, бария и др.
Катализатор серебро на пемзе готовят путем пропитки пемзы водным раствором какой-либо соли серебра с последующим ее разложением и восстановлением до металла. Предварительно пемзу измельчают, просеивают и отмывают азотной кислотой от ионов железа.
Опыт эксплуатации серебряных катализаторов позволил сформулировать требования, которым должен удовлетворять носитель для серебра:
322
-устойчивость к нагреванию и колебаниям температуры в пределах 6231173 К;
-сравнительно небольшая цельная поверхность, отсутствие пор небольшого диаметра (по этой причине для приготовления серебряных катализаторов неприменимы такие носители как силикагель, активный оксид алюминия, цеолиты);
-отсутствие четко выраженных кислотно-основных свойств, что повышало бы крекирующую способность и углеотложение (пемза практически нейтральна).
Пемза представляет собой пористый вулканический продукт, который образовался при быстром охлаждении лав, сопровождающемся интенсивным
газовыделением. Ее усредненный химический массовый состав (в %): SiO2 6770, Al2O3 14,0-17,0, Fе2О3 0,9-1,6, TiO2 0,13-0,24, МnО 0,06-0,09, MgO до 0,08, СаО 1,6-2,5, Na2O 3,0-4,1, K2O 3,0-3,9. На практике содержание серебра на носителе, как правило, составляет ~ 40%.
Общие сведения о технологии окислительного дегидрирования метанола
По своим каталитическим свойствам нанесенные серебряные катализаторы и массивное серебро практически не различаются.
Большое распространение получило модифицирование серебряного катализатора различными металлами и их оксидами. В качестве промоторов могут применяться оксиды цинка, берилия, циркония, сурьмы и некоторых других.
Срок службы серебряных катализаторов существенно зависит от целого ряда параметров: от способа приготовления и состава контакта, от степени чистоты сырья, от природы материалов, из которых изготовлена аппаратура, от резких колебаний температуры и т.д. На практике продолжительность непрерывной работы образца колеблется от 2-3 до 18-24 мес. Активность катализатора может снижаться из-за отравления поверхности катализатора ядами, зауглероживания поверхности, изменения дисперсности серебра, потери механической прочности.
Дезактивирующее влияние на катализатор оказывают примеси, содержащиеся в исходном метаноле (они же могут образовываться в ходе превращения метанола в формальдегид): формиаты, карбонаты и бикарбонаты натрия. Кроме этого ядами являются соединения серы, свинца, железа и некоторых других элементов. Наиболее активным каталитическим ядом является легколетучий пентакарбонил железа. Чистоту применяемого метанола контролируют методом УФ-спектроскопии.
Каталитическими ядами являются также примеси, содержащиеся в "возвратном" метаноле, т.е. метаноле, отогнанном из формалина-сырца или из продуктов дальнейшей переработки формалина. К числу таких примесей относятся фенол, ацетальдегид, уксусная и муравьиная кислоты и некоторые другие соединения.
323
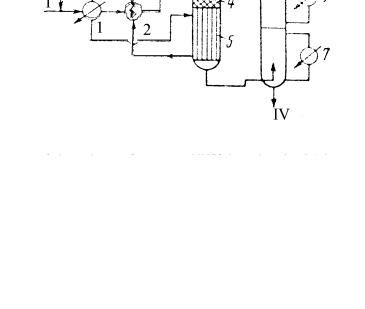
На рис. 9.4 представлена принципиальная технологическая схема производства формальдегида окислительным дегидрированием метанола на серебряном катализаторе.
Рис. 9.4. Принципиальная технологическая схема получения формальдегида окислительным дегидрированием метанола на серебряном катализаторе
1 - испаритель; 2 - теплообменник; 3 - реактор; 4 - катализатор; 5 - подконтактный холодильник; 6 - абсорбер; 7 - теплообменник.
Потоки: I - воздух; II - метанол; III -
вода; IV - метанольный формалин
Метанол, содержащий 2025% воды, nocтyпaет в испаритель 1, в котором испаряется в токе воздуха. Паровоздушная смесь нагревается до 383 К в те-
плообменнике 2 и подается в верхнюю часть реактора 3. При пуске системы слой катализатора в реакторе разогревается до 523-573 К с помощью специальных электроподогревателей, а после "зажигания" слоя температура катализатора (873-973 К) поддерживается на заданном уровне за счет тепла реакции. Реакционная смесь затем охлаждается в подконтактном холодильнике 5, выполненном как одно целое с реактором. Далее газообразные продукты реакции поступают в абсорбер 6, где из них извлекают формальдегид и непрореагировавший метанол. Абсорбер, представляющий собой тарельчатую колонну, разделен на три секции. Нижняя секция орошается формалином, средняя - раствором, содержащим 15-20% формальдегида, а верхняя - чистой водой. Из низа абсорбера выходит товарный формалин. Степень конверсии метанола в зависимости от типа используемого серебряного катализатора может составлять от 77 до
97%.
Промышленные установки могут работать и под умеренным вакуумом, что улучшает экологическую обстановку на производстве. Однако большинство установок работает под небольшим избыточным давлением.
9.1.2. Получение формальдегида
Синтез формальдегида на оксидных катализаторах
На практике в качестве оксидных катализаторов наибольшее распространение получила смесь оксидов железа (III) и молибдена (VI) с атомным соотношением молибдена и железа от 1,7 до 2,5. Катализатор готовят соосаждением соли трехвалентного железа, например нитрата или хлорида, с молибдатом аммония. При нагревании и прокалке исходная смесь превращается в твердый

324
раствор оксида молибдена (VI) в молибдате железа. Окисление метанола на оксидных катализаторах протекает по окислительно-восстановительному механизму:
|
CH3OH + 2MoO3 |
CH2O + H2O + Mo2O5, |
||
|
Mo2O5 + 0,5O2 |
2MoO3 |
||
или |
CH3OH + 0,5O2 |
CH2O + H2O |
Н = 147кДж/моль. |
|
|
На оксидных катализаторах процесс проводят при 523-673 К и степени |
|||
конверсии метанола 98-99%. |
|
|
|
|
|
В табл. 9.2 сопоставляются процессы |
окислительного дегидрирования |
||
метанола на серебряных и оксидных катализаторах. Как видно из таблицы, оба метода имеют определенные достоинства и недостатки. Однако различия в расчетной себестоимости формальдегида не выходят за пределы погрешности расчетов.
Метод окислительного дегидрирования метанола на оксидном катализаторе реализован в промышленности фирмой "Монтэдисон".
Таблица 9.2
Сопоставление методов окислительной конверсии метанола |
|
|
||
|
|
|
|
|
Метод |
Достоинства |
Недостатки |
|
|
|
|
|
|
|
Серебряный |
Практически нет ограничений по |
Высокий расходный |
коэффици- |
|
|
мощности единичной установки |
ент по сырью |
|
|
|
Простота конструкции реактора |
Наличие в формалине до 8-11% |
||
|
|
метанола |
|
|
|
Низкая металлоемкость и энер- |
Повышенное содержание муравь- |
||
|
гоемкость |
иной кислоты в обезметаноленном |
||
|
|
формалине |
|
|
|
Высокая производительность |
Расход драгоценного |
металла |
- |
|
|
серебра |
|
|
Оксидный |
Низкий расходный коэффициент |
Повышенный расход |
энергии |
и |
|
по сырью |
воздуха |
|
|
|
Товарный формалин содержит |
Ограничения по единичной мощ- |
||
|
не более 0,6-1% метанола и не |
ности установки |
|
|
|
выше 0,02% муравьиной кисло- |
Сложность эксплуатации и ре- |
||
|
ты |
монта реактора |
|
|
|
|
Повышенная металлоемкость |
|
|
Окисление природных газов и низших алканов
Получение формальдегида прямым окислением природных газов с точки зрения доступности, низкой стоимости сырья и простоты технологии является предпочтительным по сравнению с довольно сложным многостадийным синтезом формальдегида через метанол. Однако на практике получение формальдегида окислением метана сопряжено с целым рядом трудностей, связанных в ос-
325
новном с недостаточной устойчивостью формальдегида в условиях реакции. Некаталитическое окисление метана с заметной скоростью происходит при температуре выше 873 К. В то же время термическое разложение формальдегида наблюдается уже при 673 К. Кроме того, образовавшийся формальдегид в присутствии кислорода легко подвергается дальнейшему окислению. Поэтому на практике окисление метана проводят при малых степенях конверсии, причем и в этих условиях селективность образования формальдегида невысока. В силу этих обстоятельств рассматриваемый метод не получил большого промышленного распространения.
Гомогенное окисление метана представляет собой типичную свободнорадикальную реакцию. В отсутствие инициатора реакция характеризуется наличием индукционного периода. Для его устранения или уменьшения к метановоздушной смеси добавляют вещества, легко распадающиеся на свободные радикалы - чаще всего азотную кислоту или оксид азота, а также озон, пероксид водорода, летучие алкилы свинца, диметиловый эфир и др. В некоторых случаях в качестве окислителя можно применять диоксид углерода. Механизм окисления метана может быть описан следующей схемой:
NO + O2 |
NO2 + ·O |
|
зарождение цепи (а) |
O + CH4 |
CH3 + ·OH |
CH3 + O2 |
k1 |
|
CH3OO |
|
|
|
|||
|
|
CH2O + ·OH |
|
|
|
|
|
|
|
CH3OO |
|
|
||
k2 |
CH2O + OH |
|
||
CH3OO + NO |
CH3O + NO2 |
|
||
CH3OO + CH4 |
|
CH3OH + CH3O |
|
|
OH + CH2O |
|
H2O + HCO |
Рост цепи (б) |
|
|
|
|
CO + HO2 |
|
|
|
|
|
|
HCO + O2
 CO2 + ·OH
CO2 + ·OH
CH3 + HO2  CH3O + ·ОН
CH3O + ·ОН
HO2 + CH2O  CO + H2O + ·OH
CO + H2O + ·OH
CH3O + CH4 CH3OH + CH3
CH3OH + CH3
326
Вырожденное разветвление (в)
 CO + 2·OH
CO + 2·OH
CH2O + O2
 HCO + HO2
HCO + HO2
CH3OO |
Стенка |
гибель |
|
|
|
|
|
HO2 |
k3 |
гибель |
|
|
|
Стенка |
Обрыв цепи (г) |
|
|
k4 |
|
·OH |
|
Гибель |
|
|
Стенка |
||
CH3O + NO |
[CH3NO2] |
||
|
|
Стенка |
|
Энергия активации суммарной реакции (а) равна 117, а реакции (б) 301 13 кДж.
Превращение метана ускоряется при добавлении к исходной смеси продуктов окисления.
Для интенсификации процесса окисления можно использовать гетерогенные катализаторы, в частности кварц, алюмосиликаты и другие, и проводить процесс при 773-973 К. Для повышения активности алюмосиликаты пропитывают кислотами, например, фосфорной или борной.
Как правило, степень конверсии метана в процессе окисления не превышает 20% при селективности по формальдегиду 30-40%.
Получение формальдегида инициированным гомогенным газофазным окислением природного газа осуществлено в Германии. В качестве инициатора применяется смесь оксидов азота. Исходный природный газ смешивается с воздухом в соотношении 1:3,7. Полученную газовую смесь нагревают до 673 К за счет тепла продуктов окисления, после чего к ней добавляют 0,08% оксидов азота. Нагретую смесь направляют в трубчатый стальной реактор печного типа, футерованный керамикой. Температура реактора доводится до 873 К за счет сжигания части отходящих газов.
Продукты реакции охлаждаются до 473 К в теплообменнике и поступают в скруббер, орошаемый водой, в котором поглощается формальдегид с примесями метанола и муравьиной кислоты. Полученный раствор нейтрализуют и направляют на ректификацию. В качестве погона ректификационной колонны отбирают формалин, содержащий 34% формальдегида и 3% метанола. Выход формальдегида за проход (в расчете на свежий метан) равен ~ 3-5% при селективности по формальдегиду 10%. Из побочных продуктов 97% составляют оксиды углерода.
Окисление углеводородов С2-С4 имеет много общих характеристик с окислением метана, хотя имеются и специфические особенности. Технология этого процесса была реализована фирмой "Селаниз Кемикал" (США).
328
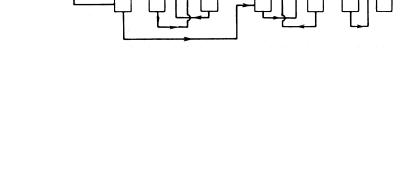
+
[RCHCH2Cl] + [RCH(OH)CH2CI] RCH(CH2Cl)OCH(CH2Cl)R.
Дихлордиалкиловый эфир
При гидролизе 1,2-хлоргидринов в основной среде образуются -оксиды олефинов и гликоли-1,2:
 RCH—CH2 + Cl- + H2O RCH(OH)CH2Cl + OH- O
RCH—CH2 + Cl- + H2O RCH(OH)CH2Cl + OH- O
RCH(OH)CH2OH + Cl-
Процесс получения этиленоксида через этиленхлоргидрин протекает в две стадии.
На первой стадии из этилена и хлора в водной среде получают этиленхлоргидрин (гипохлорирование):
CH2=CH2 + Cl2 + H2O  ClCH2CH2OH + HCl .
ClCH2CH2OH + HCl .
На второй - взаимодействием этиленхлоргидрина с основанием, например c Са(ОН)2, получают этиленоксид:
2ClCH2CH2OH + Ca(OH)2 |
2H2C |
|
CH2 + CaCl2 + H2O |
|
O
Этиленоксид
Гипохлорирование проводят при 318 К. Этилен подают с 10%-ным избытком по отношению хлору. Концентрацию этиленхлоргидрина в реакционной смеси поддерживают на уровне 5%, чтобы свести к минимуму образование побочных продуктов. Выходящие из реактора газы, содержащие 10-20% этилена, охлаждают водой и нейтрализуют щелочью. Часть этих газов возвращают в реактор, а остальное, во избежание накопления в системе инертных примесей, сбрасывают в атмосферу.
Раствор этиленхлоргидрина, выходящий из реактора, смешивают с 10- 12%-ным раствором известкового молока и подают в омылитель, в котором его подогревают острым паром до 369-375 К. Пары этиленоксида, воды, дихлорэтана и других хлорорганических продуктов из омылителя охлаждают до 313323 К и направляют в ректификационную колонну для отделения этиленоксида.
Способ получения этиленоксида через этиленхлоргидрин отличается простотой оформления, низкими капиталовложениями и невысоким расходом электроэнергии.
Кнедостаткам процесса можно отнести большой расход хлора и Са(ОН)2,
атакже то обстоятельство, что получаемый в процессе разбавленный водный раствор хлорида кальция загрязнен различными примесями и не может быть
329
использован в промышленности. Поэтому производство этиленоксида через этиленхлоргидрин сопряжено с образованием большого количества сточных вод.
Этот способ получения этиленоксида устарел и в настоящее время теряет свое промышленное значение.
9.2.2. Прямое окисление этилена
Впервые этиленоксид был получен прямым окислением этилена в 1931 г. одновременно Ленером в США и Лефортом во Франции.
Все промышленные процессы прямого окисления этилена до этиленоксида можно разделить на две группы: процессы, в которых используют воздух или обогащенный кислородом воздух, и процессы, в которых для применяютокисления 99,5%-й кислород.
Первая установка по производству этиленоксида с использованием воздуха в качестве окислителя была введена в действие в 1937 г. фирмой "Юнион Карбайд". Прямое окисление этилена протекает в соответствии со схемой
CH2=CH2 + 0,5O2 |
H2C |
|
CH2 |
|
O
Одновременно происходят реакции:
CH2=CH2 + 3O2  2CO2 + 2H2O,
2CO2 + 2H2O,
H2C |
|
CH2 |
CH3CHO, |
|
|||
|
O |
|
|
CH2=CH2 + 0,5O2  CH3CHO,
CH3CHO,
CH2=CH2 + O2  2CH2O.
2CH2O.
Процесс окисления проводят при 473-573 К. Реакция окисления этилена до этиленоксида экзотермична, выделяющееся тепло может значительно повысить температуру реакционной среды, вызвать образование точек перегрева в катализаторе и привести к снижению его производительности. Образование точек перегрева можно уменьшить путем осуществления процесса в двух реакционных зонах, расположенных последовательно.
Давление не оказывает прямого воздействия на выход целевого продукта. В промышленности процесс обычно проводят под давлением 1,0-2,3 МПа.
Обычно в промышленности применяют нанесенные серебряные катализаторы. В качестве носителей используют -А12О3 размером 3-8 мм. Катализаторы готовят, пропитывая измельченный гранулированный носитель солями серебра, как правило, карбонатами, нитратами, лактатами или оксалатами. Про-

 RCH(OH)CH
RCH(OH)CH