
monomers-Платэ-книга
.pdf
421
На стадии изомеризации циклогексаноноксима чрезвычайно важно выдерживать два основных параметра - соотношение концентраций циклогексаноноксим:олеум и температуру. Критерием оптимального соотношения циклогексаноноксим:олеум является содержание свободного SO3 в продукте перегруппировки: оно должно составлять ~ 1, 5%.
Принципиальная технологическая схема изомеризации циклогексаноноксима представлена на рис. 11.5.
Рис. 11.5. Принципиальная технологическая схема изомеризации циклогексаноноксима
1 – реактор; 2 – циклон; 3, 7 – насосы; 4, 8 – холодильники; |
5 – |
сепаратор; 6 – нейтрализатор; 9 – отстойник. |
|
Потоки: I – циклогексаноноксим; II – азот; III – олеум; IV – вода; |
V – |
аммиачная вода; VI – лактамное масло; VII - раствор сульфата аммония |
|
Циклогексаноноксим со стадии оксимирования подается в реактор 1, в котором поддерживается вакуум (остаточное давление 10 кПа). Для предотвращения сублимации циклогексаноноксима в линию его подачи вводят азот, что одновременно исключает переброс продукта. Олеум поступает во всасывающую линию циркуляционного насоса 3. Тепло реакции изомеризации снимается за счет циркуляции реакционной смеси между реактором 1 и холодильником 4. Процесс ведут при температуре ~ 398 К.
Все технологическое оборудование стадии изомеризации изготавливается из кислотоупорной стали во избежание попадания в капролактам соединений железа и других металлов.
Недостатком описанного метода изомеризации циклогексаноноксима в капролактам являются образование значительных количеств побочного продукта - сульфата аммония - и связанный с этим дополнительный расход олеума и аммиака.
Японская фирма "Канебо" разработала способ превращения циклогеканоноксима в капролактам, который заключается во взаимодействии циклогекса-
422
ноноксима с N-ацетилкапролактамом, в результате чего между молекулами обоих продуктов происходит обмен ацетильной группой. Реакцию проводят в интервале температур 403-503 К, в качестве катализатора используют уксусную кислоту. Образующиеся ацетилциклогексаноноксим и капролактам выделяют ректификацией. Капролактам направляют на очистку, а ацетилциклогексаноноксим в паровой фазе превращается на алюмосиликатном катализаторе в N- ацетилкапролактам:
NOH |
|
O |
O |
NOCOCH3 |
+ |
|
NH + |
||
|
NCOCH3 |
|
||
|
|
|
|
Ацетилпроизводные циклогексаноноксима и капролактама являются термически нестойкими продуктами: при нагревании они частично деацетилируются, в связи с чем в продуктах превращения ацетилциклогексаноноксима в N- ацетилкапролактам содержится от 2 до 10% капролактама.
По другому варианту для превращения циклогексаноноксима в капролактам через ацетильные производные используется реакция циклогексаноноксима с кетеном, протекающая на алюмосиликатном катализаторе при 573 К с образованием ацетилкапролактама:
NOH |
O |
+ CH2=C=O |
NCOCH3 |
Последующий гидролиз парами воды позволяет получить два продукта - капролактам и уксусную кислоту.
В большинстве современных промышленных схем для выделения капролактама применяется двухступенчатая экстракция. На первой стадии проводят экстракцию органическими растворителями (бензол, толуол, трихлорэтилен), а на второй - реэкстракцию капролактама водой.
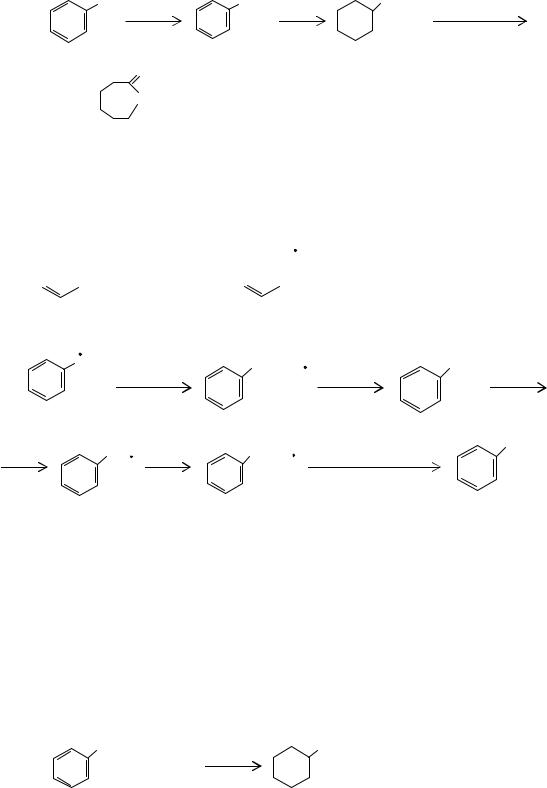
Синтез капролактама из толуола
Процесс производства капролактама из толуола был разработан итальянской фирмой "СНИА Вискоза" совместно с Миланским политехническим институтом. Процесс включает окисление толуола до бензойной кислоты, гидрирование бензойной кислоты, нитрозирование циклогексанкарбоновой кислоты
423
с превращением ее в капролактам:
CH3 |
O2 |
COOH |
H2 |
COOH |
NOHSO4 |
|
|
|
|
|
H2SO4; CO2 |
O
→NH
Окисление толуола представляет собой радикальную цепную реакцию, катализируемую солями кобальта. Сначала происходит отщепление водородного радикала с одновременным восстановлением иона кобальта

 CH3 + Co3+
CH3 + Co3+ 
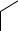

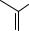 CH2+ Co2+ + H .
CH2+ Co2+ + H .
Последующие превращения описываются схемами:
CH2 |
O2 |
CH2OO |
2+ |
CHO |
3+ |
|
|
[Co ] |
[Co |
] |
|
|
CO O2 |
COOO |
C6H5CH3; [Co2+] |
COOH |
|
|
|
|
|||
|
|
|
-C6H5CHO |
|
|
Окисление толуола кислородом воздуха проводится в жидкой фазе в присутствии гомогенного катализатора при 423-443 К и давлении 1,2 МПа. Выход целевых продуктов составляет 93-95% при степени конверсии толуола ~30%. В реакционной жидкости кроме непрореагировавшего толуола и бензойной кислоты содержится также ~ 2,5% побочных продуктов: уксусная кислота, бензальдегид, ацетофенон, бензиловый спирт, дифенилметан, фталевая кислота, дифенилэтан, бензилбензоат.
Гидрирование бензойной кислоты до циклогексанкарбоновой кислоты:
COOH |
COOH |
|
+ 3H2 |
осуществляют в жидкой фазе при 443 К и давлении ~ 1 МПа с использованием гетерогенного катализатора палладий на угле.

424
Для достижения за один проход практически полной конверсии бензойной кислоты процесс проводят в каскаде из нескольких последовательных реакторов. Сырой продукт, содержащий свыше 99,5% циклогексанкарбоновой кислоты, поступает без дополнительной очистки на стадию нитрозирования.
Нитрозирование циклогексанкарбоновой кислоты осуществляют при последовательном воздействии на циклогексанкарбоновую кислоту олеума и нитрозилсерной кислоты с образованием сульфата лактимной формы капролактама:
COOH |
|
COOSO3H |
|
SO3 |
NOHSO4 |
-H2SO4; -CO2
→ OSO3Н
OSO3Н
N
При разбавлении реакционной массы водой на заключительной стадии выделяется капролактам:
OSO3Н |
|
|
|
O |
N |
|
H2O |
|
|
|
|
NH |
||
-H2SO4 |
|
|||
|
|
|||
|
|
|
||
Нитрозилсерную кислоту получают сжиганием аммиака в присутствии воздуха над платиновой сеткой при 873 К с последующей абсорбцией образующихся газов олеумом при 323 К. При этом протекают следующие реакции:
2NH3 + 2,5O2 |
2NO + 3H2O, |
2NO + 0,5O2 |
N2O3, |
N2O3 + H2SO4 SO3 |
2NOHSO4. |
Образование капролактама протекает через следующие стадии:
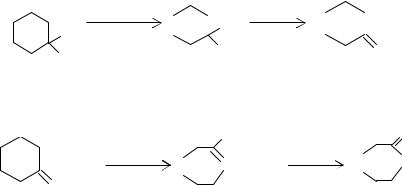
- протонирование циклогексанкарбоновой кислоты и активирование под влиянием серного ангидрида
COOH |
H2SO4 |
+ |
OH |
|
|
|
+ |
||
|
|
|
|
|
|
||||
|
|
|
|
|
|||||
H |
-HSO4 |
- |
|
C |
OH |
|
|
|
CO + H2SO4, |
|
|
H |
|
|
|
H |
|||
425
-нитрозирование и декарбоксилирование
|
NOHSO4 |
+ |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
-H+ |
|
CO |
-CO2 |
|
|
|
|
|
CO |
|
|
|
|
N + |
|||
|
|
|
||||||
H |
|
|
NO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- перегруппировка и гидролиз
HSO4- |
|
OSO3H |
H2O |
|
O |
|
N |
|
NH |
||
|
|
||||
N + |
|
-H2SO4 |
|
||
|
|
|
|
Сначала циклогексанкарбоновую кислоту смешивают с олеумом. Обычно применяют олеум с концентрацией свободного серного ангидрида 30-33%. Сернокислый раствор циклогексанкарбоновой кислоты взаимодействует с нитрозилсерной кислотой при 353 К в последовательно расположенных ступенях многосекционного реактора. В каждую ступень подают свежую нитрозу. Мольное соотношение между основными реагентами, обеспечивающее 50%-ное превращение циклогексанкарбоновой кислоты, при максимальной степени их использования следующее:
C6H11COOH : NOHSO4 = 2 : 1; SO3 : NOHSO4 = 0,8 : 1;
(NOHSO4 + SO3 + H2SO4) : NOHSO4 = 3 : 1.
Реакционную массу выводят из реактора нитрозирования, охлаждают, разбавляют водой и обрабатывают циклогексаном в противоточном экстракторе для извлечения непрореагировавшей циклогексанкарбоновой кислоты. Для получения 1 т капролактама-сырца и соответственно 4 т сульфата аммония на стадии нитрозирования расходуется 1,17 т циклогексанкарбоновой кислоты, 1,67 т раствора нитрозы (75% NOHSO4), 1,5 т олеума (36% SO3) и 1,05 т аммиа-
ка (для нейтрализации).
При выделении капролактама сначала проводят нейтрализацию сернокислого раствора безводным аммиаком. Органический слой, содержащий ~ 60% капролактама, воду и побочные органические продукты, отделяют от маточного раствора и обрабатывают едким натром для полной нейтрализации серной кислоты.
Основное количество примесей отделяется при обработке лактамного масла толуолом. Раствор капролактама в толуоле обрабатывают гипохлоритом натрия, что позволяет перевести амиды кислот в амины:
RCONH2 + NaOCl 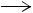 RNH2 + NaCl + CO2.
RNH2 + NaCl + CO2.
Раствор капролактама в толуоле поступает на водную экстракцию, в результате которой получают ~ 40%-ный раствор капролактама в воде. Раствор упаривают и направляют на дистилляцию.

427
Фирма "Торей" совместно с электротехнической фирмой "Тошиба" создали лампы мощностью 40 кВт, выполненные из кварцевого стекла и заполненные парами ртути и таллия. При бесперебойном горении в течение 7000 ч они сохраняют коэффициент полезного действия на уровне 80-83% и обеспечивают средний выход циклогексаноноксима 300-320 г на 1 кВт · ч затраченной электроэнергии.
Реакция нитрозирования проводится при 283-288 К и атмосферном давлении. Выход циклогексаноноксима составляет ~ 85%.
В состав технологической схемы входят три основных процесса: получение хлорида нитрозила, синтез и очистка капролактама, регенерация циклогексана, хлорида водорода и серной кислоты.
11.1.2. Получение валеролактама
Валеролактам является мономером для получения полиамида 5. Этот полимер не имеет каких-либо особых преимуществ по сравнению с другими полиамидами.
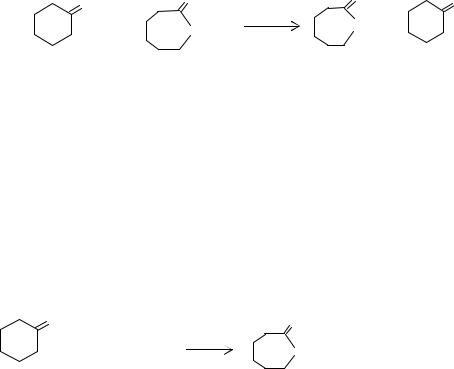
Валеролактам получают из циклопентадиена по схеме, аналогичной синтезу капролактама из бензола:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HN—(CH2)n—CO |
|||
С |
|
|
С |
||||||||
|
|
|
|
|
|
|
|
Валеролактам |
|||
O |
|
NOH |
|||||||||
11.1.3. Получение 7-аминогептановой кислоты
7-Аминогептановая (7-аминоэнантовая) кислота является мономером для получения полиамида-7.
nH2N—(CH2)6—COOH523 К [—NH—(CH2)6-CO—]n + nH2O.
1,5 МПа
Полиамид-7 превосходит полиамид-6 на 15-20% по светостойкости и в два раза по устойчивости к многократным деформациям. По остальным свойствам оба полимера различаются мало.
Из полиамида-7 вырабатывают волокно "энант". Впервые оно было получено в 1953 г. в Советском Союзе А.А. Стрепихеевым с сотр. На возможность получения такого волокна А.А. Стрепихеев указал еще в 1945 г., но его производство стало реальным только после того, как А.Н. Несмеянов, Р.Х. Фрейдлина с сотр. разработали способ получения аминоэнантовой кислоты. Производство аминоэнантовой кислоты включает несколько стадий. Сначала проводят теломеризацию этилена с тетрахлоридом углерода:
nC2H4 + CCl4  Cl(C2H4)nCCl3.
Cl(C2H4)nCCl3.

428
Реакцию осуществляют при 10–20 МПа и ~373 К в растворе тетрахлорида углерода в присутствии пероксида бензоила. Инициированная этими соединениями радикальная полимеризация этилена обрывается тетрахлоридом углерода. Механизм реакции может быть представлен следующей схемой:
R |
+ CCl4 |
CCl3 + RCl, |
•·CCl3 + C2H4 |
CH2—CH2-CCl3 , |
|
|
+ 2C2H4 |
|
Cl3C—CH2—CH2 |
Cl3C—(CH2)4—CH2—CH2 |
|
Cl3C—(CH2)4—CH2—CH2 +CCl4  Cl3C—(CH2)6—Cl + CCl3
Cl3C—(CH2)6—Cl + CCl3
Целевым продуктом реакции является 1,1,1,7- тетрахлоргептан, выход которого определяется соотношением между этиленом и тетрахлоридом углерода. В действительности получается сложная смесь тетрахлоралканов.
После разделения тетрахлоралканы в присутствии концентрированной серной кислоты при 363 К гидролизуются с образованием хлорсодержащей кислоты:
Cl |
H2SO4 |
|
O |
|
Cl—(CH2)n—C—Cl + 2H2O |
Cl—(CH2)n — C |
+ |
||
363-373 К |
||||
Cl |
|
|
OH |
|
+ 3HCl. |
|
|
|
Один из атомов хлора может быть замещен на аминогруппу при нагревании хлорсодержащей кислоты с водным раствором аммиака, при этом образуется, например, аминоэнантовая кислота:
|
|
|
|
|
O |
|
|
O |
||||
Cl(CH2—CH2)3—C + 2NH3 |
H2N—(CH2—CH2)3—C + NH4Cl. |
|||||||||||
|
|
|
|
OH |
|
|
OH |
|||||
7-Аминоэнантовая кислота может быть получена также по схеме |
||||||||||||
|
|
|
|
|
O CH3 |
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
O |
|
|
|
C=O |
HCl |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
ZnCl2 |
|
|
|
|
|
|
|
|
|
|
|
RX |
O |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
→ Cl-(CH2)5—COOH → |
|
|
||||||||
|
RX |
|
Cl-(CH2)5COOR NaCN |
NС—(CH2)5—COOR H2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
→ H2N(CH2)6COOR.

429
11.1.4. Получение каприлолактама
Каприлолактам является мономером для получения полиамида-8. Этот полимер не представляет особого интереса, так как не имеет никаких преимуществ по сравнению с другими полиамидами.
Каприлолактам может быть получен из циклооктатетраена – тетрамера ацетилена - по схеме
Н2 |
|
|
|
О2 |
|
|
|
O |
О2 |
HOOC—(CH2)6COOH |
|||
|
|
|
|
||||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пробковая кислота |
|
|
|
|
|
- H2O |
NH2OH |
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
NOH |
SO3 |
CH2—CH2—CH2—C |
||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Циклооктанооксим |
|
CH2—CH2—CH2—CH2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Каприлолактам |
11.1.5. Получение 9-аминононановой кислоты
9-Аминононаловая ( аминопеларголовая) кислота является мономером для получения полиамида 9:
nH2N—(CH2)8—COOH [—HN—(CH2)8CO—]n + nН2О.
[—HN—(CH2)8CO—]n + nН2О.
Этот полимер по основным свойствам аналогичен полиамиду-6 и полиами- ду-7, но менее гигроскопичен.
9-Аминопеларгоновая кислота образуется наряду с аминоэнантовой и аминоундекановой кислотами в процессе теломеризации этилена. Промышленный процесс синтеза 9-аминопеларгоновой кислоты и получения из нее волокна "пеларгон" разработан в Институте элементоорганических соединений АН СССР (г.Москва) в 1950-х годах (Р.Х.Фрейдлина и сотр.).
11.1.6. Получение 11-аминоундекановой кислоты
11-Аминоундекановая кислота является мономером для получения поли- амида-11.
nH2N—(CH2)10—COOH  [—HN—(CH2)10CO—]n + nН2О.
[—HN—(CH2)10CO—]n + nН2О.
Полиамид-11 несколько уступает обычным полиамидам в прочности, но обладает более высокой эластичностью и гидрофобностью, что делает его пригодным для применения в качестве изоляционного материала, фильтрующих промышленных тканей волокна и трикотажа.
430
Сырьем для получения 11-аминоундекановой кислоты служит касторовое масло, которое представляет собой смесь глицеридов кислот состава: 3-6% насыщенных кислот С16-С18, 3-9% олеиновой, 3-5% линолевой, 3% стеариновой, не менее 80% рицинолевой. Касторовое масло производят в основном в Бразилии и Индии, выделением из семян клещевины прессованием или экстрагируя его органическими растворителями.
Процесс получения этой кислоты можно представить следующим образом: глицерид рицинолевой кислоты (12-гидрокси-9-октадеценовой) кислоты - главной составляющей касторового масла – при обработке метанолом превращают в ее метиловый эфир, который расщепляется перегретым паром на гептаналь и метилундеканоат. К последнему после гидролиза против правила Марковникова присоединяется НВr и после аминирования получается 11аминоундекановая кислота.
Схема переработки касторового масла представлена ниже ( схема 11.1).
Схема 11.1
Касторовое масло
Метанол |
|
Глицерин |
Переэтерификация |
 Метилрицинолеат
Метилрицинолеат
Пиролиз
Метилундеканоат
Гидролиз
 Ундеценовая кислота гидроформилирование
Ундеценовая кислота гидроформилирование
11-Бромундекановая кислота NH3 Аминирование NH4Br
11-Аминоундекановая кислота
На первой стадии касторовое масло переэтерифицируют в присутствии избытка метанола, а также метилата натрия в качестве катализатора при 353 К и соотношении метанол : эфир, равном 3:1. Полученный метилрицинолеат





 NOH
NOH 
 Cl
Cl
 Cl
Cl