
monomers-Платэ-книга
.pdf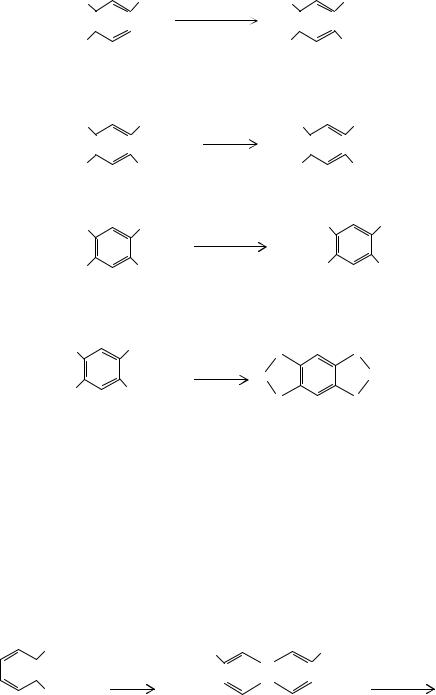
481
Окисление псевдокумола. Пиромеллитовый диангидрид получают в лабораторных условиях путем окисления псевдокумола по видоизмененному методу Миллса и Клара.
Сначала взаимодействием псевдокумола и ацетилхлорида получают ацетилпсевдокумол с выходом 90% от теоретического.
H3C |
|
CH3 CH3COCl |
H3C |
|
CH3 |
|
|
|
|
|
|
||
|
|
AlCl3 |
|
|
|
|
H3C |
H3C |
COCH3 |
||||
|
||||||
Далее ацетилпсевдокумол окисляют гипобромитом натрия с образованием дуриловой кислоты:
H3C |
CH3 |
NaOBr |
H3C |
CH3 |
||
H3C |
|
COCH3 |
|
H3C |
|
COOH |
|
|
|
||||
Затем дуриловую кислоту окисляют щелочным раствором перманганата калия при 623-633 К до пиромеллитовой кислоты:
H3C |
CH3 |
HOOC |
COOH |
|
|
KMnO4 |
|
H3C |
COOH |
HOOC |
COOH |
И наконец, нагреванием в вакууме (остаточное давление 10 Па) при 498-513 К пиромеллитовую кислоту превращают в диангидрид:
HOOC |
COOH |
OC |
CO |
|
HOOC |
COOH |
O |
O |
|
OC |
CO |
|||
|
|
12.2.ДИАНГИДРИДЫ ДИФЕНИЛТЕТРАКАРБОНОВЫХ КИСЛОТ
12.2.1.Получение диангидрида дифенил-2,2',3,3'-тетракарбоновой кислоты
Димеризация 3-иод-1,2-диметилфталата в присутствии меди и последующее омыление образующегося тетраэфира приводят к образованию дифенил-2,2 ,3,3 - тетракарбоновой кислоты (1). При обработке этой кислоты ацетилхлоридом или ее нагревании получают диангидрид дифенил-2,2 ,3,3 -тетракарбоновой кислоты (2):
I |
H3CO2 |
|
C |
|
|
|
|
CO2CH3 |
||||
|
|
CO2CH3 |
|
|
|
|
||||||
|
|
H3CO2C |
|
|
|
|
|
|
|
|
CO2CH3 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
Cu |
|
|
|
|
|
|
|
|
|
OH- |
|
|
CO2CH3 |
|
|
|
|
+ |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
H |

482
HO2C |
CO2H |
O |
O |
O |
O |
HO2C |
CO2H |
|
|
||
CH3COCl O |
2' |
2 |
|
||
|
|
|
|||
|
|
3' |
1 1' 3 O |
||
|
1 |
|
2 |
|
|
Полученный диангидрид плавится при 540 К.
12.2.2. Получение диангидрида дифенил-2,3,5,6-тетракарбоновой кислоты
Димеризация фенилпропионовой кислоты в уксусном ангидриде и окисление образующегося ангидрида (3) перманганатом калия приводят к получению дифе- нил-2,3,5,6-тетракарбоновой кислоты (3а). Нагревая эту кислоту с уксусным ангидридом, ее превращают в диангидрид (4):
C C-CO2H (CH3CO)2О |
|
O |
|
|
|
|
O |
KMnO4 |
|||
|
|
|
|||
|
|
|
|
|
|
|
3 |
|
O |
|
|
HO2C |
CO2H |
|
O |
|
O |
t |
o |
5 |
4 |
||
|
|
3 |
|||
|
|
O |
6 |
2 O |
|
|
|
|
|||
HO2C |
CO2H |
|
|
|
1 |
|
O |
|
O 4 |
||
|
|
|
|
||
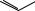 3a
3a
Диангидрид дифенил-2,3,5,6-тетракарбоновой кислоты плавится при 483 К.
485
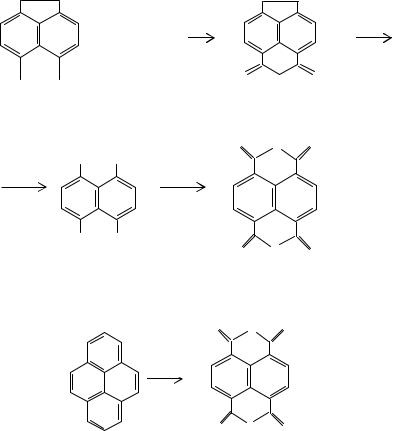
12.3. ДИАНГИДРИДЫ НАФТАЛИНТЕТРАКАРБОНОВЫХ КИСЛОТ
12.3.1. Получение диангидрида нафталин-1,4,5,8-тетракарбоновой
кислоты
Диангидрид (15) нафталин-1,4,5,8-тетракарбоновой кислоты, производимый
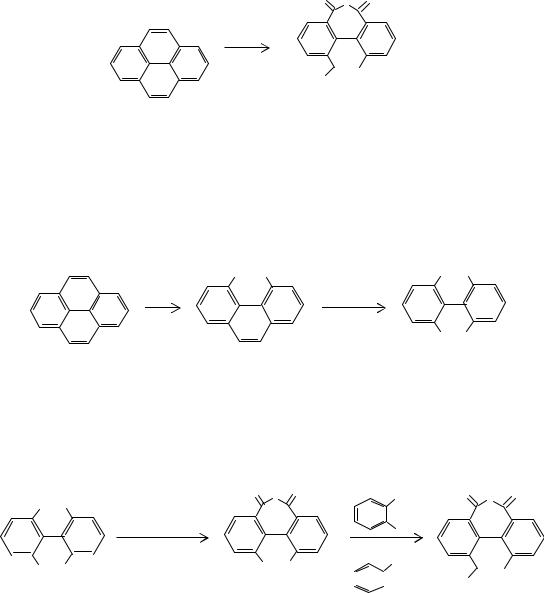
впромышленных масштабах, получают окислением 5,6-диалкилаценафтена или пирена. При конденсации аценафтена с малонодинитрилом и окислении образующегося дикетимида (13) смесью гипохлорита натрия с перманганатом калия, хромовой или азотной кислотой получают тетракарбоновую кислоту (14). Пирен может быть окислен до диангидрида нафталин-1,4,5,8-тетракарбоновой кислоты (15)
вприсутствии пентоксида ванадия смесью бихромата натрия и серной кислоты с последующей обработкой гипохлоритом натрия и гидроксидом бария или в две стадии с окислением пирена смесью олеума с азотной кислотой:
|
|
+ CH2(CN)2 |
|
|
|
[O] |
|
|
|
|
|
|
|
6 |
5 |
|
HN |
|
NH |
|
Alk |
Alk |
|
13 |
|||
|
|
|
|
|||
Аценафтен |
|
|
|
|
|
|
|
HO2C |
CO2H |
O |
|
O |
O |
|
|
8 |
|
1 |
||
|
|
|
|
|
||
|
|
|
7 |
|
|
2 |
|
|
|
6 |
5 |
4 |
3 |
|
HO2C |
CO2H |
O |
|
O |
O |
|
|
|
|
|||
|
14 |
|
|
15 |
|
|
|
|
|
O |
O |
O |
|
|
|
[O] |
|
|
|
|
|
|
|
O |
O |
O |
|
|
|
|
|
15 |
|
|
Получаемый диангидрид (15) белого цвета сублимируется без плавления при температуре выше 633 К и может быть очищен перекристаллизацией из уксусной кислоты.
486
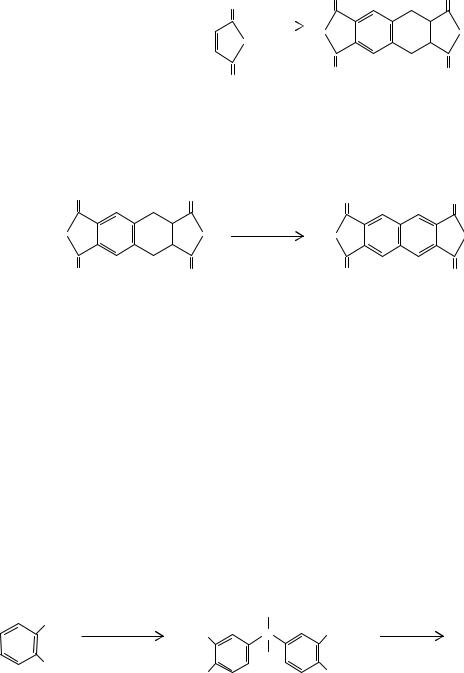
12.3.2. Получение диангидрида нафталин-2,3,6,7-тетракарбоновой кислоты
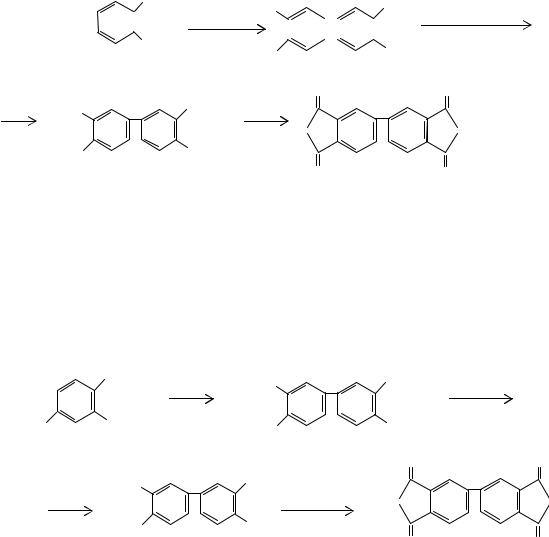
При взаимодействии малеинового ангидрида с алленом получается диангидрид 1,2,3,4,5,6,7,8-октагидронафталин-2,3,6,7-тетракрбоновой кислоты (16):
|
O |
|
O |
|
O |
|
|
7 |
|
2 |
|
CH2=C=CH2 + 2 |
|
|
|
||
|
O |
O |
|
O |
|
|
|
6 |
|
3 |
|
|
|
|
16 |
||
|
O |
|
O |
O |
|
|
|
|
|||
|
|
|
|
|
В результате бромирования этого диангидрида получается нестойкое промежуточное соединение, легко претерпевающее дегидробромирование с образованием диангидрида нафталин-2,3,6,7-тетракарбоновой кислоты (17):
O |
O |
|
O |
O |
|
O |
O |
Br2 |
O |
O |
|
-HBr |
|||||
|
|
|
|
||
O |
O |
|
O |
O |
|
|
16 |
|
|
17 |
Диангидрид плавится при температуре выше 673 К и может быть очищен перекристаллизацией из уксусного ангидрида.
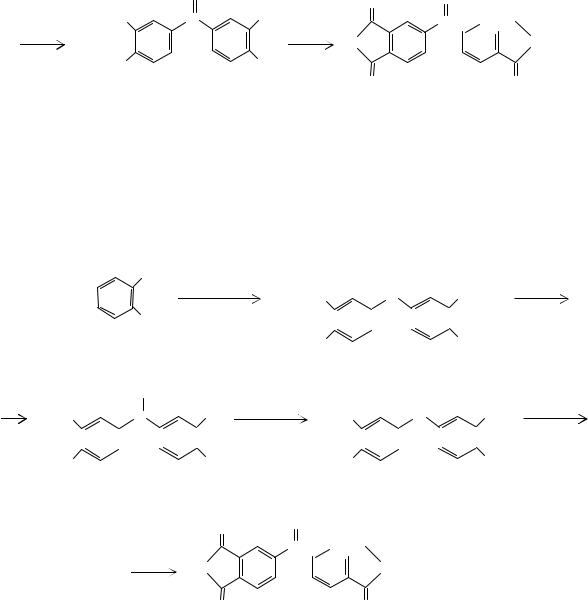
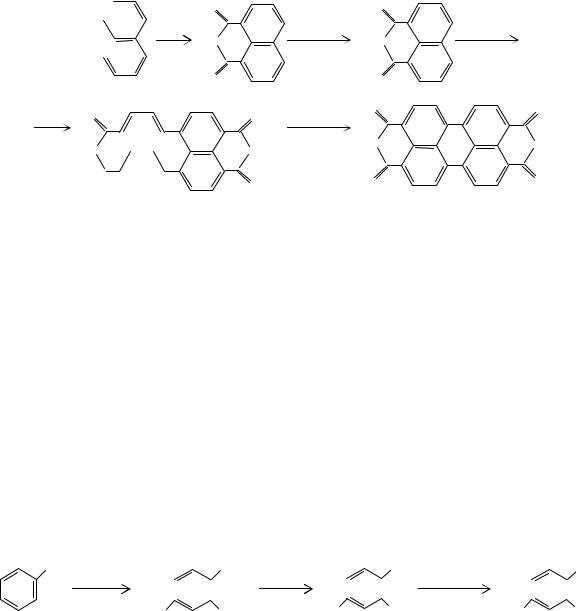
12.4. ДИАНГИДРИДЫ БЕНЗОФЕНОН- И ПЕРИЛЕНТЕТРАКАРБОНОВЫХ КИСЛОТ
12.4.1. Получение диангидрида бензофенон-3,3 ,4,4 -тетракарбоновой кислоты
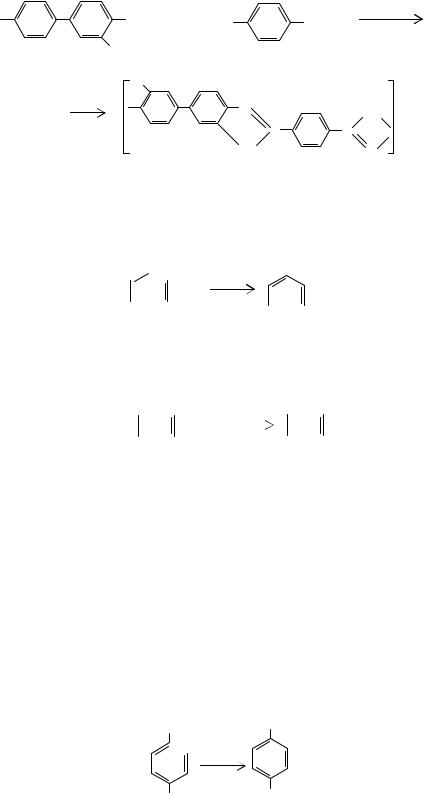
Диангидрид бензофенон-3,3 ,4,4 -тетракарбоновой кислоты в промышленности получают конденсацией о-ксилола с ацетальдегидом и последующим окислением образующегося 1,1-бис(3,4-диметилфенил)этана (18) до целевого продукта азотной кислотой:
CH3 CH3CHO |
|
CH3 |
HNO3 |
|
H3C |
C |
|||
|
CH3 |
|||
CH3 |
|
Н |
|
|
H3C |
18 |
CH3 |
||
|

490
Процесс получения n-фенилендиамина состоит из следующих стадий:
-восстановление п-нитроанилина до диамина;
-очистка технического n-фенилендиамина.
Вреактор загружают воду, чугунную стружку и соляную кислоту. Смесь перемешивают, нагревают и добавляют отдельными порциями n-нитроанилин. Восстановление проводится при температуре кипения смеси. В качестве восстановителя n-нитроанилина кроме железных стружек можно использовать растворы сульфи-
дов ( например, сульфида натрия Na2S).
Американской фирмой "Дюпон" разработан метод получения n- фенилендиамина карбоксилированием анилина. Процесс проводят в несколько стадий:
NH2 |
NHCHO |
|
NHCHO |
|
|
|
|
||
CO |
HNO |
+H SO |
4 |
H2 |
|
3 |
2 |
|
|
|
|
|
|
Pd/C |
Анилин |
Форманилид |
|
|
|
|
|
|
NO2 |
|
|
|
п-Нитроформанилид |
|
|
NHCHO |
NH2 |
|
||
|
|
|
||
|
H2O |
|
|
|
NH2 |
|
NH2 |
|
|
|
|
|
|
|
N-Формил-п-фенилендиамин п-Фенилендиамин |
|
|||
Карбоксилирование осуществляют оксидом углерода при 523-673К и 50,0- 70,0 МПа в присутствии алкоголятов щелочных металлов. Полученный форманилид (выход 81%) обрабатывают нитрующей смесью (HNO3 + H2SO4) при температуре не выше 278 К.Образующийся с выходом 93% n-нитроформанилид с примесью n-нитроформанилида гидрируют водородом при 373-423 К и 3,5 МПа. В качестве катализатора применяют палладий на угле.
Конечный продукт содержит 53% n-фенилендиамина, 9% о-фенилендиамина, а изомерные фенилендиамины разделяют. Реакции гидрирования и гидролиза можно проводить одновременно, совмещая две стадии в одном аппарате.
В Японии используют аналогичный многостадийный процесс получения n- фенилендиамина, который можно представить следующим образом:
NO2 |
NH2 |
NHCOCH3 |
NHCOCH3 |
NHCOCH3 |
NH2 |
|
|
Ацетанилид |
NO2 |
|
|
|
|
|
NH2 |
NH2 |
|
|
|
п-Нитроацетанилид |
|
|
|

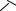

 O
O 
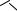
 O
O










 9
9

 NO
NO

 NH
NH


 NO
NO
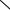
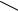 Кат.
Кат.