
monomers-Платэ-книга
.pdf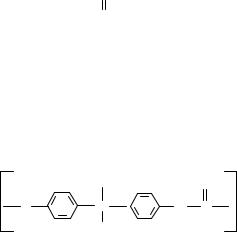
531
Глава 14
МОНОМЕРЫ ДЛЯ ПОЛИКАРБОНАТОВ
Поликарбонаты являются сложными полиэфирами угольной кислоты и дигидроксисоединений жирного или ароматического ряда общей формулы
O [—O—R—O—C—]n,
где R- ароматический, жирноароматический или алифатический остаток. Наибольшее промышленное значение имеют ароматические поликарбонаты на основе бисфенола А [2,2-бис(4-гидроксифенил)пропан] и смешанные поликарбонаты на основе бисфенола А и его замещенных – 3,3,5,5-тетрабром- или 3,3,5,5- тетраметилбисфенолов А:
|
CH3 |
O |
O |
C |
O C |
|
CH3 |
n |
Впервые поликарбонаты были получены А.Айнгорном в 1898 г. при взаимодействии фосгена с тремя изомерными дигидроксибензолами (пирокатехин, резорцин и гидрохинон) при низких температурах в присутствии пиридина. Позднее поликарбонаты получили также Бишоф и Хеденштрем, которые осуществили переэтерификацию дифенилкарбоната диоксибензолами при повышенных температурах. Однако полученные продукты были неплавкими и нерастворимыми, что не позволило использовать их для технических целей.
Поликарбонаты на основе бисфенола А, пригодные для промышленного применения, впервые были получены при фосгенировании в среде пиридина. Начиная с 1958 г., поликарбонат на основе бисфенола А начали производить в промышленном масштабе в ФРГ, а затем и в США. В Советском Союзе методом фосгенирования бисфенола А был получен поликарбонат "дифлон". В настоящее время поликарбонаты выпускают под торговыми марками "макролон", "лексан", "макрафол", "юпилон", "пенлайт", "синвет", "мерлон" и др.

532
Области применения поликарбонатов определяются комплексом ценных свойств этих термопластичных материалов: их используют там, где от материала требуются высокие прочностные показатели, термостойкость, малая текучесть, стабильность размеров изделий, пониженная горючесть, незначительное водопоглощение, физиологическая инертность и стойкость к действию различных химических реагентов.
Поликарбонаты на основе бисфенола А нашли широкое применение в электротехнике и электронике благодаря не только превосходным диэлектрическим и механическим свойствам, но и их неизменности этих свойств в интервале температур от 173 до 403 К. Вследствие высокой температуры размягчения из поликарбонатов можно изготавливать различные детали с металлическими запрессовками, проводящими электрический ток, тогда как такие распространенные диэлектрики, как полистирол или полиэтилен из-за низких рабочих температур для этих целей не используют.
Как конструкционный материал поликарбонаты применяют для изготовления различной арматуры, штепсельных вилок, корпусов клемм и элементов вычислительных машин. Армированные поликарбонаты характеризуются повышенной теплостойкостью, огнестойкостью, пониженной усадкой при формировании и небольшим линейным расширением. Поэтому их используют для изготовления различных прецизионных элементов аппаратуры, работающих при температурах до 373 К.
В1990-х годах начал стремительно развиваться рынок лазерных компактдисков. В 2000 г. свыше 80% всех компакт-дисков в мире изготавливались на основе поликарбонатов.
Вавтомобильной промышленности поликарбонаты применяют для изготовления деталей, подверженных сильным ударам или действию повышенных температур, в частности пуленепробиваемых стекол, фар, корпусов тахометров. Поликарбонаты используют также для изготовления триплекса - органического стекла повышенной прочности, ударопрочность которого в 250 раз превышает ударопрочность обычного безопасного стекла той же толщины. Из поликарбонатов изготавливают детали холодильников, пылесосов, кофемолок, абажуры для ламп и колпаки уличных фонарей.
Из большого числа синтезированных поликарбонатов наибольшее практическое применение получили термопластичные ароматические поликарбонаты на основе бисфенолов общей формулы
HO
 R
R
 OH ,
OH ,
где R =: —CH2— ; —CH2—CH2— ; —CH—CH3 ; —CH(CH2)2CH3 ;
533
CH3 |
|
|
|
|
; C |
|
—C— ; |
|
|
; C |
; |
||
CH3 |
|
CH3—C—CH2CH3 |
|
|
||
|
|
|
|
|
|
|
|
|
|
; |
C |
|
|
|
|
|
; |
|
O ; |
|
C |
|
|
|
O |
O |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
H |
|
|
CH3 |
C |
|
|
C |
|
|
C |
; |
|
|
|
|
O |
|
|||
|
|
|
|
|||
|
|
|
|
|
||
|
; |
|
; |
C |
|
|
|
|
|
|
O |
|
|
|
|
OCH2 |
CH2O |
|
|
|
—CH2CH2CH2 |
|
C |
CHCH2CH2— ; |
—O— ; —S—; |
||
|
O |
OCH2 |
CH2O |
O O |
|
|
|
|
|
|
|
||
—S— ; |
—S— |
; |
CH3—C |
C—CH3 |
||
O |
O |
|
|
|
N |
|
|
|
|
|
O=C—CH3 |
||
Ароматические циклы могут содержать в качестве заместителей алкильные, арильные группы и атомы галогенов. В промышленности используют главным образом поликарбонаты на основе бисфенола А. Это объясняется прежде всего тем, что исходный бисфенол А необходимой степени чистоты получается из дешевого и доступного сырья – фенола и ацетона. Возможность применения других ароматических поликарбонатов ограничивается высокой стоимостью исходных диоксисоединений, хотя по ряду свойств некоторые поликарбонаты превосходят полимеры, синтезированные на основе бисфенола А.
Основными промышленными методами получения ароматических поликарбонатов являются фосгенирование ароматических дигидроксисоединений и переэтерификация диалкилили диарилкарбонатов ароматическими диоксисоединениями. Реакция фосгенирования описывается схемой:
534
|
CH3 |
OH + nCOCl |
|
CH3 |
|
O |
+ nHCl . |
nHO |
C |
O |
C |
O |
C |
||
|
CH3 |
|
|
CH3 |
|
|
n |
|
Бисфенол А |
|
|
Поликарбонат |
|
|
|
Наряду с фосгеном при проведении поликонденсации на границе раздела фаз могут быть применены бисхлоругольные эфиры ароматических дигидроксисоединений, трихлорметиловый эфир хлоругольной кислоты (дифосген), бистрихлорметилкарбонат и др.
Реакция получения поликарбонатов переэтерификацией диарилкарбонатов бисфенолами протекает по следующей схеме:
|
CH3 |
|
O |
|
n HO |
C |
OH + n |
O C |
O |
|
CH3 |
|
Дифенилкарбонат |
|
|
Бисфенол А |
|
||
|
CH3 |
O |
|
|
O |
C |
O C |
+ n |
OH |
|
CH3 |
|
n |
. |
Поликарбонат
В промышленности используют оба метода синтеза поликарбонатов. Однако наибольшее распространение получил метод фосгенирования.

535
14.1. БИСФЕНОЛЫ
Бисфенолы типа бисфенола А применяют для получения фенолоформальдегидных полимеров, полиэпоксидов, полиэфиров и др. Например, эпоксидные полимеры получают по реакции
n HO |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
OH+ mCH2—CH—CH2Cl + NaOH |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
Бисфенол А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
CH2-CH-CH2-O- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OCH -CH-CH O- |
-CH CH-CH |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
C |
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
2 |
|
2 |
|||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
OH |
|
|
n |
O |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
+ NaCl + H2O
Величина n зависит от мольного соотношения эпихлоргидрина и бисфенола. При большом избытке эпихлоргидрина n приближается к нулю и в результате реакции образуется в основном диглицидиловый эфир бисфенола А. При уменьшении количества эпихлоргидрина n возрастает и более высокомолекулярные полимеры можно получить обработкой данного олигомера бисфенолом А. Таким образом, сами эпоксидные смолы являются не чем иным, как реакционноспособными преполимерами. Эпоксидные полимеры широко исприменяют в покрытиях, клеях, слоистых и армированных пластиках.
Бисфенол А используют для получения поликарбонатов, которые обычно синтезируют поликонденсацией бисфенола А с фосгеном или дифенилкарбонатом:
|
CH3 |
|
|
|
CH |
|
O |
n HO |
|
|
COCl2 |
|
3 |
|
|
C |
OH |
O |
C |
O |
C |
||
|
CH3 |
|
-2HCl |
|
CH3 |
|
|
|
|
|
|
|
n |
||
n HO |
CH3 |
OH + n |
|
O |
|
|
|
C |
|
O C O |
-2C6H5OH |
|
|||
|
CH3 |
|
|
|
|
||
|
|
|
|
|
|
|
|

536
В промышленности на основе бисфенолов выпускают также ароматические полиэфиры:
CH3
n NaO
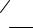

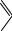
 C
C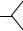
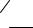

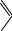
 ONa + n Cl
ONa + n Cl


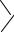
 SO2
SO2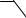
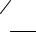

 Cl-2NaCl CH3
Cl-2NaCl CH3
CH3
O |
C |
O |
SO2 |
|
CH3 |
|
n |
|
|
|
или |
CH3 |
|
|
|
nNaO |
C |
ONa + n Br |
Br |
-2NaBr |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
O |
C |
O |
|
|
|
CH3 |
|
n |
Бисфенол А находит применение также в синтезе ненасыщенных полиэфиров. В промышленности выпускают полимер на основе продукта взаимодействия
бисфенола А с пропиленоксидом и фумаровой кислотой:
537
|
|
O |
O CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|||||||||
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
OCCH=CHCO- |
CH-CH2O |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
OCH2CH- |
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
n |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
14.1.1. Получение бисфенола А
Конденсация фенола с ацетоном
Впервые бисфенол А [2,2-бис-(4-гидроксифенил)пропан; ди(4- гидроксифенил)диметилметан; диан]был получен Дианиным в 1891 г. конденсацией фенола с ацетоном в кислой среде:
|
|
|
CH3 |
OH + H2O . |
2 |
OH + CH3COOCH3 |
HO |
C |
|
|
|
|
CH3 |
|
Бисфенол А
Взаимодействие фенола с ацетоном осуществляют в присутствии катализатора и промотора. После окончания реакции непрореагировавшие компоненты и катализатор удаляют. Выход продукта и его качество зависят от применяемого катализатора, промотора и условий проведения процесса.
Катализаторы реакции. Конденсация фенола с ацетоном может проводиться в присутствии кислого или основного катализатора. Наибольшее распространение получила кислотная конденсация, так как использование в качестве катализатора сильного основания приводит к загрязнению бисфенола А побочными смолообразными продуктами, вследствие чего процесс необходимо вести при более высокой температуре (433 К), чем при применении кислотного катализатора.
В качестве кислотных катализаторов обычно используют хлорид водорода, концентрированную соляную или серную кислоту. Наиболее сильным катализатором является безводный хлорид водорода.
Каталитическое действие серной кислоты увеличивается с повышением ее концентрации. Однако при применении серной кислоты концентрацией выше 70% протекают нежелательные побочные реакции сульфирования исходного фенола и образующегося бисфенола А. При использовании этих катализаторов и соответст
538
вующих промоторов в промышленных процессах ( 313-348 К и мольное соотношение фенола и ацетона от 2 : 1 до 15 : 1 получают бисфенол А с выходом 9096%.
В качестве катализаторов могут быть применены BF3, AlCl3, AlBr3, ZnCl2, SnCl4, SbCl5, TiCl4, SiCl4. В присутствии этих катализаторов бисфенол А получают с выходом 80-95%.
Эффективным катализатором получения бисфенола А является также фосген. Оптимальное соотношение фосген:фенол:ацетон равно 1 : 4 : 1. Увеличение количества катализатора приводит к значительному увеличению выхода побочных продуктов.
В качестве катализаторов можно использовать и катиониты КУ-1 и КУ-2. По каталитической активности катализаторы располагаются в следующий ряд:
Н2SО4 > КУ-2 > КУ-1.
Активность серной кислоты в три раза выше, чем КУ-1.
Промоторы реакции. Активность катализаторов, применяемых при получении бисфенола А, значительно возрастает в присутствии промоторов, которые сокращают продолжительность реакции и улучшают качество продукта. В основном в качестве промоторов используют соединения двухвалентной серы: сульфохлорид серы, тиосульфат натрия, сероводород, меркаптаны, тиофенолы, тиокислоты и др. Наиболее широко применяемый промотор – тиогликолевая кислота НSCH2COOH - мгновенно вступает в реакцию с ацетоном с образованием пропи-
ленбистиогликолевой кислоты (CH3)2 С(SCH2COOH)2, оказывающей промотирующее действие.
Несмотря на высокую эффективность, многие из описанных промоторов имеют ряд недостатков. Например, сероводород и меркаптаны ядовиты и обладают неприятным запахом, тиокислоты имеют высокие температуры кипения и с трудом выделяются из реакционной массы.
Параметры реакции. Одним из основных факторов, влияющих на качество бисфенола А, является температура реакции: выше 353 К образуется большое количество высокомолекулярных продуктов, загрязняющих бисфенол А. С понижением температуры скорость реакции уменьшается, но продукт получается более высокой полимеризационной чистоты. В зависимости от применяемого катализатора и соотношения реагентов оптимальными являются температуры 303-353 К.
Увеличение скорости реакции без ухудшения качества получаемого бисфенола А достигается проведением конденсации в условиях избытка фенола по сравнению со стехиометрическим. Для периодических процессов используют соотношение фенола к ацетону от 2:1 до (4-5):1. В непрерывных процессах для пре-
539
дотвращения загустевания реакционной массы мольный избыток фенола увеличивают до 10-15. С этой же целью в реакцию берут избыток серной кислоты (до 4-7 молей на 1 моль ацетона) или добавляют в реакционную массу инертные растворители, не смешивающиеся с водой (толуол, ксилолы и др.).
Механизм реакции. Один из наиболее вероятных механизмов образования бисфенола А можно представить следующим образом.
Вначале в результате взаимодействия карбкатиона ацетона (1) с фенолом в хиноидной форме образуется протонированный карбинол (2). В кислой среде он отщепляет воду и превращается в карбкатион п-изопропенилфенола (3), который в результате депротонирования может переходить в п-изопропенилфенол (4).
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
O=C |
|
|
H+ |
|
|
CH3 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
HO—C |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
-O—C+ |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
+ |
|||||||||||||||||
HO—C |
+ + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
C |
|
|
|
|
|
|
|
|
|
OH |
H |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
HC |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
C + |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
3 |
|
|
|
CH3 |
- H+ |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Карбкатион 3, взаимодействуя со следующей молекулой фенола, превращается в промежуточный продукт (5), в результате депротонирования которого

540
образуется конечный бисфенол А (6):
|
CH3 |
|
|
|
CH3 |
+ |
|
||
|
|
|
|
C |
|
|
|||
|
|
+ |
|
+ |
HO |
|
OH |
+ |
|
OH |
C |
+ |
OH |
|
|
H |
|
||
|
|
|
|
|
- H |
||||
|
CH3 |
|
|
|
CH3 |
|
|
||
|
|
CH3 |
|
5 |
|
|
|
||
|
|
|
|
|
|
|
|
||
|
HO |
|
C |
OH |
|
|
|
||
|
|
|
|
|
|
||||
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
В соответствии с представлениями о механизме кислотного катализа роль кислоты заключается в активации ацетона:
H3C |
H3C |
+ |
H3C |
|
|
+ |
|||||
C +=O - + H+ |
|
C=OH |
|
|
C—OH |
|
|
|
|||
H3C |
H3C |
|
H3C |
||
|
|
|
1 |
||
Карбкатион ацетона (1), более реакционноспособный по отношению к нуклеофильным агентам, чем сам ацетон, атакует молекулу фенола ( в хиноидной форме) в местах наибольшей электронной плотности, т.е. в орто- и пара- положениях. В дальнейшем реакция протекает в две стадии. На первой стадии образуется промежуточный продукт присоединения карбкатиона ацетона (1) к молекуле фенола, который на второй стадии в результате отщепления протона
превращается в карбинол (7): +
OH
H3C + |
+ |
|
|
OH |
|
|
|
|
|
|
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
C—OH |
|
|
|
|
|
|
|
|
|
|
|
H |
-Н+ |
|||||||
Н3 С |
|
|
|
|
|
H3C |
|
C |
||||||||||||
|
|
|
|
|
|
H3C |
|
C |
|
CH3 |
||||||||||
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|||||
1 |
OH |
|
|
|
|
|||||||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
7 |
|
|
|
||||
