monomers-Платэ-книга
.pdf
411
В связи с этим степень термического воздействия на продукты, содержащие циклогексанон, в условиях разделения должна быть минимальной.
Органические кислоты, присутствующие в оксидате, обычно нейтрализуют водным раствором едкого натра при температуре ~338 К. Нейтрализацию, как правило, совмещают с процессом омыления сложных эфиров и проводят последовательно в нескольких реакторах. Затем разделяют водный слой, содержащий соли и частично нейтрализованный органический слой продуктов окисления. Одновременно с реакцией нейтрализации разлагают гидропероксид циклогексила, при этом получается дополнительное количество циклогексанона и циклогексанола. Непрореагировавший циклогексан выделяется ректификацией. Содержание циклогексанона и циклогексанола в дистилляте ~0,15%. Циклогексан возвращают на стадию окисления, а оставшаяся смесь поступает на выделение циклогексанона и циклогексанола. Циклогексанол направляют далее на стадию дегидрирования.
Получение циклогексанола и циклогексанона из фенола. Получение цик-
логексанона из фенола включает две стадии: гидрирование фенола в циклогексанол на никелевых катализаторах и последующее дегидрирование циклогексанола в циклогексан.
Реакция гидрирования фенола в циклогексанол сопровождается выделением тепла:
OH |
H2 |
|
OH |
|
||
|
|
|
|
H298 |
= -210 кДж/моль |
|
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
||||
|
|
|
|
|
|
|
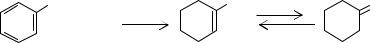
При температуре ниже 473 К равновесие реакции практически полностью сдвигается в сторону образования циклогексанола.
Циклогексанон является продуктом продуктом дегидрирования циклогексанола:
OH O
-н2
Разработаны различные варианты гидрирования фенола в жидкой фазе в присутствии суспендированного палладиевого катализатора (1-10% палладия на угле, оксиде алюминия). При 413 К и атмосферном давлении через 30 ч в продуктах реакции обнаруживается 79% циклогексанона, 1% циклогексанола и ~ 20% непрореагировавшего фенола.
Возможно также жидкофазное гидрирование фенола на катализаторе, содержащем 5% палладия на угле, промотированном едким натром. При 458 К достигнута 99,5%-ная степень конверсии фенола при селективности по циклогексанону 97,5%.
412
Скорость гидрирования циклогексанона на никеле на порядок выше скорости гидрирования фенола. В то же время на палладии соотношение скоростей реакции обратное. Этим и обусловливается различная селективность металлов: на никеле процесс протекает с образованием циклогексанола, а на палладии в основном образуется циклогексанон.
Различие в протекании реакции гидрирования фенола на никеле и палладии можно объяснить различным соотношением циклогексанона и его енольной формы, образующейся в качестве промежуточного соединения:
OH |
OH |
O |
|
+ 2H2 |
|
На палладии преимущественно образуется кетон, который легко десорбируется в газовую фазу. На никеле эта реакция идет через преимущественное образование енола, десорбция которого затруднена, вследствие чего он легко гидрируется в циклогексанол.
Для гидрирования фенола применяют преимущественно никелевые и палладиевые катализаторы.
Никелевые катализаторы представляют собой восстановленный металлический никель на носителях: оксидах алюминия, хрома и др. Природа носителя в данном случае не оказывает существенного влияния на активность катализатора.
Палладиевые катализаторы готовят нанесением поверхностного слоя палладия на различные носители: оксиды алюминия, кремния, уголь и т. д. Высокая дисперсность палладия в катализаторе достигается в результате пропитки-А12О3 раствором хлорида палладия с последующим восстановлением водородом.
Циклогексанол получают в колоннах при давлении в верхней части колонны 4-6 кПа, температуре в кубе 433-443 К.
Гидрирование фенола на никельхромовом катализаторе осуществляют в паровой фазе при 403-423 К, давлении 1,5-2,5 МПа и скорости подачи сырья 0,15-0,2 ч-1. Гидрирование фенола на никельхромовом катализаторе протекает с селективностью по циклогексанолу 98-99% при практически 100%-ной конверсии.
Одностадийное парофазное гидрирование фенола до циклогексанона осуществляют на палладиевом катализаторе при 393-413 К и небольшом избыточном давлении - до 0,3 МПа. Оптимальная нагрузка по жидкому фенолу составляет ~ 0,8-1,2 кг/л (кат.) час.
Получение капролактама из анилина. Метод получения капролактама из анилина был разработан и реализован в промышленности в Германии в 1940- х годах и до настоящего времени не потерял своего значения. Метод включает в себя следующие технологические стадии: гидрирование анилина до циклогексиламина, гидролиз моно- и дициклогексиламинов и разделение бензольного
экстракта.

415
гидролиза на выходе из контактного аппарата имеют следующий состав (в % (мас.)):
Циклогексанон …………15,0-15,5 |
Побочные продукты … |
1 |
|
Циклогексанол ………… |
3-5 |
Водород ……………… |
0,3 |
Циклогексиламин ………1 |
|
Аммиак ………………. |
4,3 |
Дициклогексиламин ……1 |
|
Вода ………………… |
65-70 |
Анилин …………………. |
1-4 |
|
|
Компоненты смеси образуют между собой азеотропные смеси и разделение их дистилляцией невозможно. Поэтому амины переводят в водорастворимые сульфаты аминов путем обработки смеси серной кислотой:
2C6H11NH2 + H2SO4 |
(C6H11NH2)2 H2SO4 |
Н = 62,5 кДж/моль. |
Циклогесанон и циклогексанол экстрагируют из смеси бензолом. Полученный при этом бензольный экстракт содержит ~75% бензола и ~25% циклогексанола и циклогексанона. При расслаивании продуктов нейтрализации выделяется слой, содержащий сульфат натрия, который направляется в отделение по очистке сточных вод. Водный слой после расслаивания нейтрализуют.
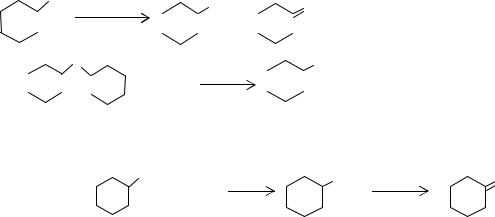
Дегидрирование циклогексанола.Циклогексанол является одним из основных продуктов в синтезе капролактама по фенольной и анилиновой схемам. Для получения циклогексанона циклогексанол подвергают дегидрирова-
нию:
OH → |
O |
← |
+ H2. |
Реакция является эндотермической, тепловой эффект реакции при 573 К составляет -67 кДж/моль. Повышение температуры и понижение давление сдвигает равновесие вправо. Константы равновесия реакции и степени превращения циклогексанола при 433-653 К и атмосферном давлении приведены в табл. 11.1.
Равновесная степень превращения циклогексанола при 513 К достигает 60%, а при температуре выше 623 К равновесие практически полностью сдвигается вправо.
В качестве катализаторов дегидрирования циклогексанола можно использовать никель, кобальт, железо, медь, цинк, палладий, рутений и др. Наибольшее распространение в промышленности получили катализаторы на основе цинка и меди. Железоцинковый катализатор представляет собой железные кольца, поверхность которых покрывают цинком термическим или гальваническим способом. Дегидрирование осуществляют при температуре 673-693 К и объемной скорости свежего циклогексанола 1,2 ч-1.
В промышленности применяется также оксидный цинковый катализатор,
получаемый, например, разложением основного карбоната цинка при 673 К с последующим таблетированием смеси оксида цинка с 2% графита.
416
Таблица 11.1
|
Константы равновесия реакции дегидрирования (К) |
||||||
|
|
и степени |
превращения циклогексанола ( ) |
||||
|
|
|
|
|
|
|
|
Т, К |
|
К |
|
, % |
Т, К |
К |
, % |
|
|
|
|
|
|
|
|
433 |
|
0,0331 |
|
17,89 |
553 |
1,7240 |
79,56 |
453 |
|
0,0739 |
|
27,16 |
573 |
2,8370 |
85,99 |
473 |
|
0,1544 |
|
36,58 |
593 |
4,5140 |
90,47 |
493 |
|
0,3037 |
|
48,19 |
613 |
6,9690 |
93,52 |
513 |
|
0,5667 |
|
60,14 |
633 |
10,4700 |
95,50 |
533 |
|
1,0090 |
|
71,09 |
653 |
15,3300 |
96,89 |
При 613-633 К и объемной скорости по жидкому циклогексанолу 1,0-1,5 ч-1 выход циклогексанона на прореагировавший циклогексанол при 80-85%-ной степени конверсии достигает 98%.
В присутствии катализаторов на основе меди дегидрирование циклогексанола можно проводить при температурах ниже 573 К. Катализаторы готовят нанесением меди на носители, например кизельгур, пемзу, оксид алюминия или другие носители. При 523-553 К и объемной скорости 0,8-1,0 ч-1 на этом катализаторе достигается практически равновесный выход.
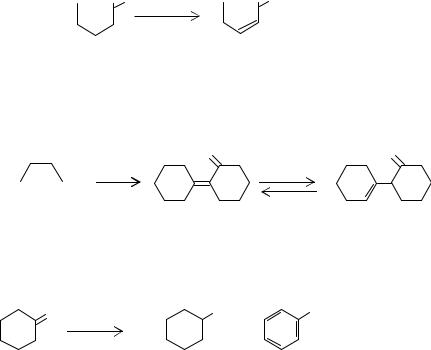
Обычно дегидрирование циклогексанола сопровождается образованием побочных продуктов. Например, в результате дегидрирования циклогексанона в цикле получается циклогексенон
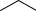
 O
O 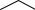
 O
O
+ H2 ,
содержание которого возрастает с повышением температуры реакции. Конденсация циклогексанона приводит к образованию 2-
циклогексилиденциклогексанона, который при температуре выше 423 К изомеризуется в 2-циклогексенилциклогексанон:
O O
2 
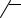
 O -H2
O -H2
Основной реакцией образования фенола является диспропорционирование водорода в циклогексаноне:
O H2 |
|
OH |
OH |
3 |
2 |
+ |
|
417
Следующая стадия – это превращение циклогексанона в циклический оксим по реакции с гидроксиламиносульфатом.
Получение гидроксиламиносульфата
Гидроксиламиносульфат NH2OH 0,5H2SO4 был впервые синтезирован в 1865 г. Лоссеном. В конце Х1Х века Ф.Рашиг, а впоследствии Диверс и Хаг исследовали реакцию взаимодействия нитритов с гидросульфитом и сернистым ангидридом и получили гидроксиламиносульфат. Это способ носит название "процесс Рашига".
Первой стадией процесса является получение дисульфоната гидроксиламина из нитрита натрия и гидросульфита натрия:
NaNO2 + 2NaHSO3  HON(SO3Na)2 + NaOH.
HON(SO3Na)2 + NaOH.
Синтез осуществляют при ~273 К и стехиометрическом соотношении между нитритом и гидросульфитом.
На второй стадии проводится гидролиз дисульфоната гидроксиламина с образованием гидроксиламинсульфата:
2HON(SO3Na)2 + H2O |
NH2OH 0,5H2SO4 + 2Na2SO4 + H2SO4. |
Получение циклогексаноноксима и его изомеризация в капролактам.
Циклогексаноноксим
 NOH
NOH
представляет собой белое кристаллическое вещество с т. пл. 361,6 К. При нагревании с минеральными кислотами в водном растворе циклогексаноноксим гидролизуется с образованием циклогексанона и гидроксиламина.
Стадия процесса оксимирования циклогексанона входит в фенольную, анилиновую и окислительную схемы производства капролактама. В каждой из них основными полупродуктами являются циклогексанон и гидроксиламиносульфат, взаимодействующие между собой.
Циклогексаноноксим получают по открытой В. Мейером в 1882 г. реакции между гидроксиламином и кетоном.
Оксимирование циклогексанона протекает по схеме
O |
NOH 0,5H2SO4 |
|
Н=118 кДж/моль |
||
+ NH2OH 0,5H2SO4 |
|
|
|
+ H2O |
|
|
|
||||
В кислой среде циклогексаноноксим находится в форме соединения с серной кислотой или же в протонированной форме. Эта химически активная

418
форма определяет обратимый характер процесса. Для сдвига равновесия в сторону образования оксима в реакционную смесь вводят раствор аммиака:
NOH 0,5H2SO4 + NH4OH |
|
|
|
NOH |
|
|
|
+ 0,5(NH4)2SO4 + Н2О. |
|
|
|
Взаимодействие циклогексанона с гидроксиламиносульфатом протекает по механизму электрофильного замещения. Электрофильный характер атома углерода карбонильной группы в молекуле циклогексанона усиливается протонированием кислородного атома кислотой. При этом соответствующий углеродный атом приобретает положительный электрический заряд. Атом азота молекулы гидроксиламиносульфата присоединяется к нему своей неподеленной электронной парой. В то же время кислородный атом карбонильной группы присоединяет к себе атом водорода гидроксиламинооосульфата с последующим отщеплением молекулы воды:
|
|
|
|
O H+ |
|
|
|
+ |
OH¯ |
NH2OH 0,5H2SO4 |
|
+ |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|||||
|
|
SO |
|
NOH 0,5H2SO |
|
||||||
NOH 0,5H |
2 |
|
4 |
||||||||
OH |
4 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
+ H2O. |
|
|
|
|
|
|
|
|
|
|
|
||
Сдвиг реакции оксимирования в сторону образования циклогексаноноксима существенно зависит от рН среды:
рН |
2 |
3 |
4 |
5 |
6,4 |
Степень оксимирования, % |
65,0 |
88,0 |
84,5 |
87,8 |
88,5 |
|
Реакцию проводят при 348-353 К при избытке гидроксиламиносульфата. В гидроксиламиносульфате, получаемом по способу Рашига, может присутствовать свободная сера. Поэтому в процессе оксимирования возможно образование полисульфида аммония, димера 2-меркаптоциклогексана, производного тиазолина и некоторых других серосодержащих соединений, которые по технологической цепочке могут попасть в капролактам.
При наличии в гидроксиламиносульфате изомоно- и изодисульфокислот может образовываться сульфонат циклогексаноноксима, который, в свою
419
очередь, вступает в реакцию с циклогексаноноксимом с образованием феназиновых соединений, в частности октагидрофеназина:
O |
SO3H |
NSO3H |
NOH |
+ NH |
OSO3 |
|
+ |
|
|
|
|
N |
|
N |
|
|
|
|
|
NOH |
|
N |
|
|
|
Октагидрофеназин |
|
Последний является наиболее нежелательным соединением: его присутствие даже в незначительных количествах резко ухудшает оптическую плотность
иокраску капролактама.
Воснове процесса превращения циклогексаноноксима в капролактам лежит открытая в 1886 г. Э. Бекманом реакция превращения оксимов в амиды кислот, известная как перегруппировка Бекмана. В случае циклических оксимов процесс протекает с образованием лактамов. Этот процесс является основным методом производства лактамов, например:
NOH |
O |
|
|
NH |
Н = 235 кДж/моль. |
||
|
Капролактам
Перегруппировка Бекмана протекает под действием различных изомеризующих агентов, например олеума. Для предотвращения взрыва реакцию проводят при интенсивном охлаждении.
Первой стадией процесса является образование протонированной формы циклогексаноноксима:
NOH |
+ |
|
|
|
NOH |
+ H2SO4 |
|
H + HSO4¯ |
|
||
Большое влияние на закономерности протекания изомеризации оказывает концентрация серного ангидрида в олеуме, т.е. фактор кислотности. Крайне нежелательной реакцией, характерной для оксима в присутствии кислот и щелочей, является их гидролиз. По мере повышения кислотности среды скорость гидролиза вначале возрастает, а затем уменьшается. Снижение константы скорости реакции гидролиза объясняется переходом протонированной формы цик
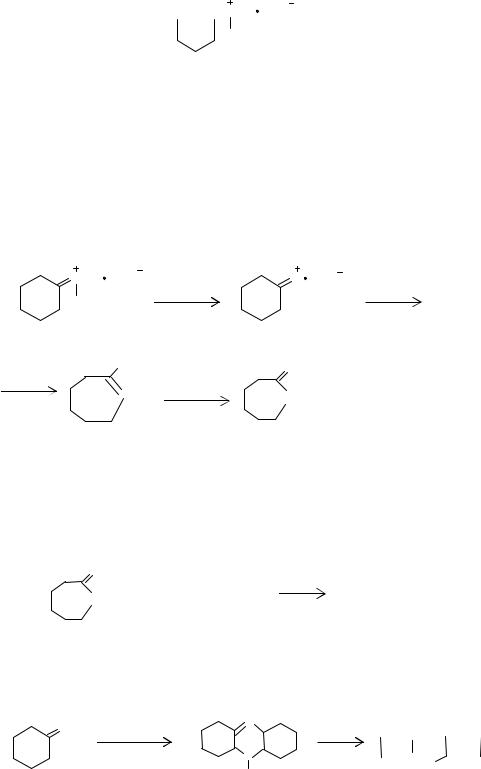

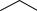
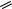 NOH HSO
NOH HSO
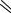 N
N
 N
N