
monomers-Платэ-книга
.pdf71
В водном конденсате содержится 12-14 г/л фенолов следующего состава (в % (мас.):
Фенол…………………… |
7,7 |
Резоцин…………………………. |
30,8 |
2-Метилфенол……….…. |
0,8 |
2-Метилрезорцин………………. |
12,5 |
3-Метилфенол……….…. |
1,2 |
4-Метилрезорцин………………. |
21,8 |
Ксиленолы……………… |
0,8 |
5-Метилрезорцин………………. |
2,6 |
Пирокатехин…………… |
3,1 |
2,5-Диметилрезорцин………….. |
5,0 |
Метилпирокатехины…... |
0,9 |
Прочие двухатомные фенолы…. |
10,9 |
Для получения фенолов, ароматических углеводородов и олефинов разработана схема химической переработки продуктов сжижения угля, которая включает: дистилляцию для выделения фракции с т. кип. до 513 К; выделение и переработку сырых фенолов; гидроочистку обесфеноленной широкой фракции с т. кип. до 698 К; дистилляцию гидроочищенного продукта на фракции с т. кип. до 333, 333-453, 453-573 и 573-673 К; гидрокрекинг средних фракций с целью увеличения выхода бензиновых фракций; каталитический риформинг фракций с т. кип. до 453 К; экстракцию ароматических углеводородов; пиролиз бензина-рафината.
При переработке бурого угля Бородинского месторождения КанскоАчинского угольного бассейна в пересчете на сухую массу угля можно получить следующие соединения (в % мас.)):
Фенолы С6-С8…………………... |
1,6 |
Ароматические углеводороды… |
26,3 |
в том числе: |
|
бензол……………. |
2,9 |
толуол……………. |
5,6 |
ксилолы………….. |
10,4 |
Олефиновые углеводороды…… |
7,2 |
в том числе: |
|
этилен……………. |
3,8 |
пропилен…………. |
1,7 |
Кроме того, можно выделить 14,9% углеводородных газов С1-С2; 13,4%
– сжиженных углеводородных газов С3-С4, а также 0,7% аммиака и 1,6% сероводорода.
2.2. ПЕРЕРАБОТКА ПРИРОДНЫХ И ПОПУТНЫХ ГАЗОВ И ГАЗОВОГО КОНДЕНСАТА
Впервые природные газы стали использовать в химической промышленности в 1930 г. Природные горючие газы включают собственно природные газы, попутные газы, выделяемые при добыче нефти, и газы газоконден-

72
сатных месторождений. Основным компонентом природных газов является метан, содержание которого в зависимости от месторождения может составлять от 70 до 99%. Помимо метана природные газы содержат этан, пропан, бутан, а также небольшие количества азота, диоксида углерода, сероводорода и инертных газов – гелия и аргона.
2.2.1. Переработка природных газов
Химическая переработка природных газов используется для получения широкого ассортимента продуктов: минеральных удобрений, мономеров для пластических масс, синтетических каучуков и волокон, исходных веществ для синтеза органических кислот, спиртов и т.д.
Ценные компоненты природных газов - этан, пропан, бутаны – являются важным сырьем для получения олефиновых мономеров. Этан применяют как сырье для производства этилена, пропан наряду с коммунально-бытовым назначением,- для получения пропилена. Использование для химических целей компонентов природного газа для химических целей позволяет высвободить существенное количество бензиновых фракций.
При пиролизе бутана можно получать этилен и пропилен. При дегидрировании бутана синтезируют бутадиен и другие ценные продукты.
Углеводороды С2-С4 выделяют из природных газов сразу при промысловой подготовке, так как при транспортировании под давлением образовавшийся конденсат может забивать трубопроводы. Из инертных примесей особый интерес представляет гелий. До настоящего времени природные газы являются единственным сырьевым источником промышленного производства гелия.
В табл. 2.1 приведены основные продукты, получаемые при переработке природного газа (метан) после удаления газов С2.
Основное направление переработки метана - производство синтез-газа, который является промышленным источником получения водорода, а также сырьем в производстве метанола, альдегидов (методом оксосинтеза), углеводородов топливного назначения (способом Фишера-Тропша) и в других процессах.
Таблица 2.1
Основные продукты, получаемые при химической переработке метана
Первичный тех- |
Реагенты |
Вредные |
Основной продукт |
Продукты последующей пе- |
нологический |
|
примеси |
|
реработки |
процесс |
|
|
|
|
Термический кре- |
- |
- |
Ацетилен |
Ацетальдегид, винилхлорид, |
кинг |
|
|
|
поливинилхлорид |

|
|
|
|
73 |
|
|
|
|
|
Частичное окис- |
O2 |
- |
|
Винилацетат, поливинил- |
ление (неполное) |
|
|
|
ацетат, поливиниловый |
|
|
|
|
спирт |
Электрокрекинг |
- |
- |
Ацетилен |
Винилацетилен, хлоропрен, |
|
|
|
|
полихлоропрен |
|
|
|
|
Акрилаты, акриловая кисло- |
|
|
|
|
та и ее производные, полиак- |
|
|
|
|
рилаты, сополимеры |
|
|
|
|
|
Окисление |
NH3(О2) |
S, С1 |
Цианистый водород |
Цианамид |
|
|
|
|
Акрилонитрил, полиакрило- |
|
|
|
|
нитрил (волокно). |
|
|
|
|
Метилметакрилат |
Галогеннрование |
С1, Вг, I, |
С2-угле- |
С1-, Вг-, I-, |
Растворители, экстракцион- |
|
F |
водороды |
F-производные |
ные и охлаждающие агенты, |
|
|
|
|
аэрозоли. Силиконы, метил- |
|
|
|
|
целлюлоза, полиамиды, дру- |
|
|
|
|
гие полимеры |
Каталитическое |
S |
С4-угле- |
Сероуглерод |
Ксантогенаты, вискозные |
превращение |
|
водороды |
|
пленки и волокна |
|
|
|
|
Растворители. |
|
|
|
|
Фунгициды, гербициды и др. |
Нитрование |
HNO3 |
- |
Нитросоединения |
Нитрометан, растворители |
Бактериальное |
Воздух, |
S |
Белки |
Кормовые продукты |
окисление |
вода, со- |
|
|
|
|
ли |
|
|
|
Термический кре- |
Тяжелые |
S |
Технический угле- |
Пигменты для красителей |
кинг |
масла, O2, |
|
род |
|
Частичное окис- |
Воздух |
|
- |
Добавки к эластомерам |
ление |
|
|
|
|
|
|
|
|
|
Катализ в при- |
Воздух |
S |
Синтез-газ |
Метанол. Аммиак. Продукты |
сутствии водяных |
|
|
|
оксосинтеза |
паров |
|
|
|
|
Частичное окис- |
Кисло- |
- |
" |
Высшие спирты, продукты |
ление |
род, во- |
|
|
замещения |
|
дяной пар |
|
|
|
2.2.2. Переработка газового конденсата
Наиболее распространенным процессом промысловой подготовки конденсатсодержащего природного газа является процесс низкотемпературной сепарации (температура 243 К, давление 7,6 МПа), который позволяет извлечь до 90-95% углеводородов С5+. Степень извлечения легких углеводоро-
74
дов невысока и в среднем составляет: 10-15% (мас.) этана и 30-40% (мас.) пропан-бутановой фракции.
Более глубокое извлечение легких углеводородных газов достигается за счет применения низкотемпературных технологий, включающих ректификацию при пониженных давлениях и температурах (193-213 К). В этом случае степень извлечения легких углеводородных газов и конденсата составляет: 30-50% (мас.) этана, 70-80% (мас.) пропан-бутановой фракции, 99-100%
(мас.) С5+.
Выделяемая на установках промысловой подготовки природного газа жидкая фаза – нестабильный конденсат с повышенным содержанием этана, пропана и бутанов – поступает на установки стабилизации конденсата, на которых выделяют метан-этановую фракцию (направляемую в магистральный газопровод), широкую фракцию легких углеводородов и стабильный конденсат (сырье для производства моторных топлив).
2.3. ХИМИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА ВОДОРОДА
Водород - один из основных химических продуктов нефтепереработки и нефтехимии. Главными его потребителями являются производство аммиака, метанола, процессы гидроочистки нефтяных фракций от сернистых соединений, гидрокрекинга, гидрирования бензола, гидродеалкилирования.Водород используют также в качестве топлива для ракет и в некоторых других процессах. Мировое производство водорода в 1990 г. составило ~ 43 млн т. Значение водорода в различных областях хозяйственной деятельности в настоящее время настолько велико, что прогресс в некоторых отраслях промышленности определяется в основном экономичностью его производства.
В основе промышленных методов получения водорода лежат реакции окисления углеводородов связанным или свободным кислородом. В промышленности используют следующие методы получения водорода: паровую каталитическую конверсию легких углеводородов с подводом тепла, автотермическую каталитическую конверсию легких углеводородов, высокотемпературную кислородную конверсию различных типов углеводородного сырья различных типов, кислородную или паро-кислородную газификацию твердого топлива, электролиз воды, извлечение водорода из газовых отходов процессов нефтепереработки.
2.3.1.Каталитическая конверсия углеводородов
сводяным паром
Каталитическая конверсия углеводородов в настоящее время является основным промышленным способом получения водорода.

75
Кроме природных и попутных нефтяных газов в качестве исходного сырья для его производства используют также коксовый газ и газы переработки нефти.
При повышенных температурах углеводороды реагируют с водяным паром, диоксидом углерода, кислородом в соответствии с уравнениями:
СnНm + Н2О  Н2 + СО + СО2 + СН4 + С CnНm + О2
Н2 + СО + СО2 + СН4 + С CnНm + О2  Н2 + CО + CО2 + CH4 + H2О + C
Н2 + CО + CО2 + CH4 + H2О + C
СnНm + СО2  Н2 + СО + CH4 + Н2О + С СпНm + Н2
Н2 + СО + CH4 + Н2О + С СпНm + Н2  СН4 + С.
СН4 + С.
Как правило, конверсия углеводородов протекает в области, в которой образование углерода термодинамически неблагоприятно. При температурах ниже 700 К и повышенных давлениях основными продуктами реакции являются СН4 и СО2. При высоких температурах (выше 1500 К) реакции протекают практически до образования Н2 и СО:
СnHm + nH2O |
nCO + (n +m/2)H2 . |
Каталитическую конверсию природного газа или сжиженных газов и бензиновых фракций с температурой кипения до 473 К водяным паром
СН4 + Н2О |
СО + 3Н2 |
Н = - 206 кДж/моль |
осуществляют под давлением до 4,0 МПа при температуре газа на выходе 1033-1173 К в зависимости от требуемого состава газовой смеси. Смесь углеводородов и паров воды подается в реакционные трубы, находящиеся в топке печи и поглощающие от нее тепло. Процесс проводят на катализаторах
Ni/Аl2О3.
Для получения газа требуемого состава, например для синтеза метанола, в сырье вводят диоксид углерода и осуществляют процесс пароуглекислотной конверсии. В этом случае протекает также реакция
СnНm + nСО2  2nСО + m/nН2.
2nСО + m/nН2.
Проведение процесса конверсии метана смесью водяного пара и диоксида углерода позволяет широко варьировать отношение Н2:СО в синтезгазе.
Как и в случае реакций паровой конверсии углеводородов, реакция пароуглекислотной конверсии метана обратима; остальные углеводороды конвертируются полностью:
CH4 + CO2 |
2CO + 2 H2 |
H = 247,3 кДж/моль |
|
C2H6 |
+ 2CO2 |
4CO + 3H2 |
H = 429,7 кДж/моль |
C7H16 + 7CO2 |
14CO + 8H2 |
H = 1395 кДж/моль |
|
C6H6 |
+ 6CO2 |
12CO + 3H2 |
H = 952 кДж/моль |
76
Для проведения процесса в автотермическом режиме осуществляют паро-кислородную и паро-кислородно-воздушную конверсию углеводородов. При этом протекают также следующие реакции:
CnHm + n |
O2 |
nCO + |
m H2 |
|
2 |
|
|
2 |
m H2O |
CnHm + (n + m )O2 |
nCO2 + |
|||
|
4 |
|
|
2 |
Реакции эти практически необратимы, преобладание одной из них зависит от количества окислителя и параметров процесса. Реакции высоко экзотермичны и могут служить источником энергии для осуществления эндотермических реакций.
Реакции конверсии углеводородов относятся к гомолитическим, т.е. сопровождающимся разделением электронов в электронных парах молекул. Катализаторами конверсии углеводородов являются d-металлы, главным образом VIII Периодической системы химических элементов Д.И. Менделеева. Металлы по своей активности в реакции паровой конверсии метана располагаются в следующий ряд:
Fe < Co < Ni < Ru < Rh < Pt < Pd
Благородные металлы обладают высокой активностью, но дόроги, и все применяемые в промышленности в настоящее время катализаторы в качестве активного компонента содержат никель. Никелевые катализаторы паровой конверсии готовят обычно двумя способами: нанесением активного компонента на предварительно подготовленный носитель( его многократно пропитывают растворами солей никеля и промоторов) или соосаждением гидроксидов никеля, промоторов и порошкообразного носителя. Для предотвращения рекристаллизации кристаллов никеля на поверхности носителя в состав катализатора вводят промоторы, в качестве которых используют трудновосстановимые оксиды металлов. Эти оксиды проявляют структурирующее действие по отношению к никелю. Эффективность действия промоторов возрастает в ряду:
BaO << SrO << CaO < Cr2O3 < BeO < MgO < Al2O3.
В свежеприготовленном катализаторе никель находится в форме оксидов, алюминатов и других соединений. Перед началом работы катализатор восстанавливают водородом или оксидом углерода в соответствии со схемой:
NiO + H2  Ni + H2O,
Ni + H2O,
NiO + CO  Ni + CO2.
Ni + CO2.
В процессе паровой конверсии метана в большинстве случаев фактором, определяющим активность процесса, является подвод тепла через стенку реакционных труб к слою катализатора. Поэтому собственно активность катализатора, как правило, не является лимитирующим фактором.
77
2.3.2.Каталитическая конверсия оксида углерода
Вгазах каталитической конверсии углеводородов в зависимости от параметров процесса и сырья содержится 6-25% оксида углерода. В производствах, в которых СО не требуется, в частности в производстве водорода, про-
водится его конверсия в СО2 водяным паром. При этом получается дополнительное количество водорода, эквивалентное содержанию в газе СО. Различают среднетемпературную (623-723 К) и низкотемпературную (453-523 К) конверсию.
Впервом случае остаточное содержание СО составляет несколько про-
центов, во втором – доли процента. После адсорбции СО2 оставшиеся в газе СО и СО2 удаляют гидрированием на катализаторе при 523-723 К, при этом достигается глубокая очистка от кислородсодержащих соединений.
Во втором случае - для низкотемпературной конверсии - применяют в основном железохромовые катализаторы, активным элементом которых яв-
ляется Fе3О4. Добавка оксида хрома замедляет рост кристаллов. Железохромовый катализатор малочувствителен к отравлению сернистыми соединениями, но поглощенная им сера при взаимодействии с водородом образует сероводород, который может вызвать отравление катализатора.
Низкотемпературные катализаторы конверсии СО являются более активными и позволяют проводить конверсию при 453-523 К. Высокая активность обусловлена наличием в них металлической меди (20-50%). Содержащиеся также в катализаторе оксиды цинка и алюминия, а иногда и хрома, стабилизируют свойства активной меди, препятствуя ее спеканию.
Конвертированный газ после низкотемпературной конверсии СО и
очистки от СО2 имеет остаточное содержание СО - 0,2-0,8% и СО2 - 0,01- 0,5% в зависимости от способа очистки. Полная очистка от примесей СО и
СО2 проводится гидрированием их на катализаторе до образования метана и воды:
СО + 3Н2  СН4 + Н2О ,
СН4 + Н2О ,
СО2 + 4Н2 СН4 + 2Н2О.
СН4 + 2Н2О.
Недостатком этих катализаторов является образование летучих карбонилов никеля - высокотоксичных соединений.
Промышленный никельхромовый катализатор, применяемый для очистки от СО и СО2, имеет следующие характеристики:
Содержание никеля, % (мас.)……………………….60-70
Содержание окиси хрома, % (мас.)………………...30-35 Содержание графита, % (мас.) .…………………….до 5
Пористость, %………………………………………….60-65 Насыпная масса, кг/м3………………………………….1080
Удельная поверхность, м2/г ……………………………170
Поверхность никеля, м2/г ……………………………….25
78
В промышленных условиях одновременно проводится гидрирование и оксида, и диоксида углерода. Гидрирование СО не зависит от концентрации СО2 в смеси. Напротив, присутствие СО в газе препятствует гидрированию СО2. Метанирование СО2 практически прекращается, если концентрация СО в газе превышает 0,0002-0,0003 м3/м3. Таким образом, если на стадии гидрирование подается смесь оксидов, то сначала гидрируется СО и после практически полного завершения реакции начинает гидрироваться СО2.
Для получения чистого водорода газовая смесь должна быть очищена от диоксида углерода. Для этого применяют абсорбционные и реже адсорбционные способы очистки:
-водную очистку под давлением;
-поглощение СО2 водными и другими растворами этаноламинов;
-физическую адсорбцию органическими растворителями при комнатной и низкой температуре;
-очистку горячими растворами карбонатов;
-адсорбцию с десорбцией путем сброса давления.
Основной недостаток водной очистки – большой расход электроэнергии вследствие невысокой растворимости СО2 в воде. Кроме того, после водяной отмывки требуется доочистка газа другими способами, например раствором щелочи.
В настоящее время широкое распространение получили процессы, основанные на хемосорбции едким кали или моноэтаноламином. Их принципиальный недостаток в том, что расход тепла на 1 м3 очищаемого газа значительно увеличивается с повышением концентрации СО2 в исходном газе. Поэтому на некоторых установках для адсорбции СО2 применяют органические растворители. В качестве растворителей используют пропиленкарбонат ("Флюор-процесс"), N-метилпирролидон ("пуризол"), диметиловый эфир ("селексол"), метанол ("ректизол").
Все эти способы с успехом могут применяться для очистки газов от СО2. Но в связи с технологическими особенностями установок паровой конверсии в трубчатых печах и из экономических соображений наиболее широкое распространение в последние 10-15 лет получили процессы очистки от СО2 растворами моноэтаноламина и едкого кали.
2.3.3. Общие сведения о технологии получения водорода
Наиболее распространенным и экономичным способом получения водорода является паровая каталитическая конверсия легких углеводородов (С1-С7) в трубчатых печах. Для получения водорода чистотой 95-98% используют процессы конверсии углеводородов, конверсии СО, отмывки СО2, метанирования остаточных оксидов углерода. Водород с чистотой 99% синтезируют методом криогенной очистки. Для получения водорода более высокой степени чистоты (99,99%), газ после конверсии подают на адсорбцион-
79
ную или мембранную очистку, где из него удаляются практически все примеси. Установки всех трех типов широко используют в промышленности.
Мембранная технология получения водорода высокой степени чистоты во многом основана на фундаментальных работах российской школы В.М. Грязнова.
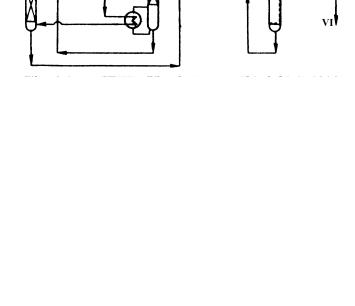
Получение 95-98%-го водорода. В зависимости от дальнейшего использования водород получают под различным давлением: от 1,0 до 4,2 МПа. На рис. 2.7 представлена принципиальная схема типовой водородной установки. Сырье (природный газ или легкие нефтяные фракции) подогревается до 623-673 К в конвективной печи 2 или теплообменнике и поступает в аппараты десульфирования 1. Конвертированный газ из печи 2 охлаждается в пе- чи-утилизаторе 3, где вырабатывается пар требуемых параметров.
После ступеней высокотемпературной и низкотемпературной конверсии СО газ поступает на адсорбцию СО2 и затем на метанирование остаточных оксидов. В результате получается водород 95-98,5%-й чистоты с содержанием в нем 1-5% метана и следов СО и СО2.
Рис. 2.7. Принципиальная технологическая схема получения 95- 98,5%-го водорода
1 - реактор десульфирования; 2 - трубчатая печь конверсии; 3 - котелутилизатор; 4, 5 - среднетемпературный и низкотемпературный конверторы метана; 6 - абсорбер СО2; 7 - регенератор; 8 – метанатор.
Потоки: I - углеводородное сырье; II -
технологический пар; III - вода; IV -
пар высокого давления; V – СО2; VI –
Н2; VII - топливный газ; VIII - воздух
Получение водорода высокой степени чистоты. В на-
стоящее время широкое распространение получили установки для производства водорода высокой степени чистоты на базе паровой конверсии углеводородов и адсорбционного разделения конвертированного газа.
Сырье подогревается, очищают от серы и направляют в печь конверсии, откуда при температуре ~1123 К конвертированный газ поступает в ко- тел-утилизатор, а затем дополнительно охлаждается в теплообменниках и поступает в конвертор СО.
В отличие от предыдущей схемы конверсия СО здесь одноступенчатая. Газовая смесь, содержащая Н2, СО2, СН4, Н2О и небольшое количество СО, охлаждается для удаления воды и направляется в адсорбционные аппараты, заполненные цеолитами. Все примеси адсорбируются в одну ступень при температуре окружающей среды. В результате получают водород со степе-
80
нью чистоты 99,99%. Давление получаемого водорода составляет 1,5-2,0 МПа.
Термоконтактные методы получения водорода. Метод заключается в термическом разложении углеводородного сырья до углерода и водорода при температуре ~ 1573 К на инертной насадке или при 1173-1223 К на катализаторах. Промышленный процесс состоит из двух стадий: на первой стадии протекает распад углеводородов, на второй - сжигание выделившегося кокса. Процесс проводится в периодическом режиме. Широкого распространения он не получил.
Электролиз воды. Это единственный промышленный способ получения водорода, не основанный на использовании углеводородов. Электролиз воды выгодно отличается от других методов получения водорода простотой и надежностью технологической схемы, но он обладает большой энергоемкостью: в современных методах электролиза воды под давлением расходуется 55-65 тыс. кВт-ч электроэнергии на 1 т водорода. Электролиз воды для крупномасштабных производств может быть конкурентоспособным только при наличии дешевой электроэнергии.
Выделение водорода как побочного продукта других реакций. Во многих процессах нефтепереработки и нефтехимии образуются отходящие газы со значительным содержанием водорода.
В процессе каталитического риформинга образуется водород в количестве 0,7-2,3% (мас.) в расчете на превращенное сырье. При производстве ацетилена на 1 т его получается 11 000-14 000 м3 газа, состоящего в основном из оксида углерода и водорода. При производстве этилена получают метанводородную фракцию с содержанием водорода 90-95%.
