
MolFiz_2012_v2
.pdfТеплоемкость идеального газа
Рассмотрим один моль идеального газа при постоянном объеме. В этом случае газ не будет совершать работу при сообщении ему теплоты (объем газа не меняется и для стороннего наблюдателя газ не совершает никакой работы). А вся сообщенная теплота будет затрачена на увеличение внутренней энергии. Поэтому, молярная теплоемкость
идеального газа при постоянном объеме
имеет вид
C |
dU |
|
|
|
|
i |
R. |
|
|
|
|
||||||
|
|
|||||||
V |
dT |
|
|
2 |
|
|||
|
|
1 |
|
|||||
|
|
|
|
|
||||
131
Внутренняя энергия идеального газа
Внутренняя энергия идеального газа, с учетом последнего соотношения, принимает вид
U CV T.
Полученное выражение будет справедливым при любых процессах в идеальном газе (не только в случае V=const).
Заметим также, что, вообще говоря, внутренняя энергия верна с точностью до произвольной аддитивной постоянной. Однако, это обстоятельство не учитывалось, поскольку эту константу всегда можно выбрать равной нулю, если соответствующим образом условится о точке отсчета внутренней энергии.
132

Теплоемкость идеального газа
Рассмотрим один моль идеального газа при постоянном давлении. В этом случае при сообщении газу теплоты, помимо увеличения своей внутренней энергии, газ будет совершать работу A против внешних сил.
Для вычисления работы представим себе газ, заключенный в цилиндрический сосуд с площадью сечения s, который закрыт невесомым поршнем, на который действует постоянная сила F.
133

Теплоемкость идеального газа
Тогда, элементарное приращение работы идеального газа, совершаемой против внешних сил, при смещении поршня на величину dh, будет равно
A Fdh Fs d hs PdV .
Следовательно, молярная теплоемкость идеального газа при постоянном объеме примет вид
|
|
|
dU A |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
C P |
dV |
|
|
C R, |
|
P |
|
|
|||||||||
|
|
dT |
|
|
V |
dT |
|
|
V |
||
|
|
|
|
1 |
|
|
|
1 |
|||
|
|
|
|
|
|
|
|||||
где было использовано уравнение МенделееваКлапейрона. Полученное соотношение между молярными теплоемкостями называется
соотношением Майера.
134
Теплоемкость идеального газа
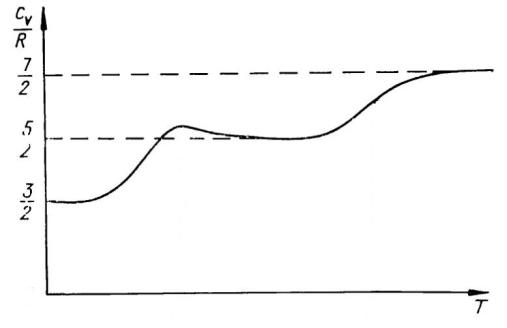
Экспериментальные исследования теплоемкости газа выявили отклонения от классической теории теплоемкости газов, которая была изложена выше с тем, что наблюдается в эксперименте. Отклонения связаны с зависимостью теплоемкости от температуры, которой в классической теории не существует.
Теплоемкость 2-х атомной молекулы 135
Теплоемкость идеального газа
Таким образом, газ ведет себя так, как если бы благодаря изменению температуры происходит включение (или
выключение (замораживание)) различных степеней свободы: при малой температуре включены лишь поступательные степени свободы, затем при повышении температуры включаются вращательные, а затем и колебательные степени свободы.
Переход от одного режима движения к другому происходит не скачком, а постепенно в некотором интервале температур. Это объясняется тем, что при определенной температуре возникает лишь возможность для молекул переходить в другой режим движения, и эта возможность реализуется не всеми молекулами сразу, а лишь их частью. По мере повышения температуры все большая доля молекул переходит в другой режим движения и поэтому кривая теплоемкости изменяется плавно в некотором интервале температур.
136

Элементы квантовой теории теплоемкости
Зависимость теплоемкости от температуры можно объяснить только в рамках квантовой теории. Поясним это на примере вычислений Эйнштейна для молярной теплоемкости кристалла при постоянном объеме (1900 г.)
.
В соответствии с классической теорией, если в одном моле кристалла (который рассматривается как одна молекула) возбуждены все степени свободы, то его кинетическая (внутренняя) энергия равна
E 2i kT 3NAkT 3RT ,
поскольку
i 3 3 2 3NA 6 6NA 6 6NA.
137

Элементы квантовой теории теплоемкости
Следовательно
CV 3R.
Полученное соотношение называется законом Дюлонга-Пти. Действительно, при высоких температурах (когда возбуждены все степени свободы) закон Дюлонга-Пти выполняется.
А вот при более низких температурах теплоемкость принимает другие значения, и стремится к нулю при T→0.
138

Элементы квантовой теории теплоемкости
Эйнштейн предположил, что каждый атом в кристалле ведет себя как независимый
гармонический осциллятор с энергией
|
|
1 |
|
|
|
|
h |
|
|
n |
n |
|
|
, |
n 0, 1, 2, ... |
|
|
, |
|
2 |
2 |
||||||||
|
|
|
|
|
|
|
где h – постоянная Планка; ω – циклическая частота колебаний осциллятора.
Тогда, в соответствии с распределением Гиббса,
средняя кинетическая энергия такого осциллятора
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
exp |
|
|
n |
|
|
|
|
|
|
|
|
|
|
|||
|
|
kT |
|
|
|
|
|
|
|
||||||||||
|
|
n 0 |
|
|
|
|
|
|
|
|
. |
||||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
exp |
|
|
|
n |
|
|
|
|
|
|
exp |
|
|
1 |
|||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
n 0 |
|
|
kT |
|
|
|
|
kT |
139 |
||||||||

Элементы квантовой теории теплоемкости
Для внутренней энергии молярного кристалла получим
U3NA 
 ,
,
адля теплоемкости найдем
|
|
|
|
|
|
|
|
|
Tc |
|
|
|
|
|
||||
|
|
dU |
Tc |
2 |
|
exp |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
T |
|
|
|
|
|||||||||
CV |
|
|
3R |
|
|
|
|
|
|
|
|
|
|
|
, Tc |
|
|
, |
|
|
|
T |
|
|
2 |
|
|||||||||||
|
|
dT |
|
T |
|
|
|
|
k |
|
||||||||
|
|
|
|
|
|
exp |
c |
|
1 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|||
где Tc – называется температурой Эйнштейна.
140
