
- •1.1. Поняття «фармацевтична технологія» та її основні завдання
- •1.2. Короткі історичні відомості про розвиток промислового виробництва ліків
- •1.3. Біофармація як новий теоретичний напрям
- •1.4. Принципи класифікації лікарських форм
- •2.1. Умови промислового випуску лікарських препаратів
- •2.2. Загальні принципи організації фармацевтичного виробництва
- •2.3. Терміни I визначення
- •2.4. Нормативно-технічна документація у промисловому виробництві ліків
- •2.5. Матеріальний баланс
- •2.6. Основні положення gmp
- •3.2. Теоретичні основи процесу розчинення
- •3.3. Типи розчинення
- •3.4. Теорія гідратації
- •3.5. Способи обтікання частинок рідиною
- •3.6. Характеристика розчинників
- •3.7. Водні розчини
- •3.8. Спиртові розчини
- •3.9. Гліцеринові розчини
- •3.10. Олійні (масляні) розчини
- •4.1. Класифікація I технологія виготовлення сиропів
- •4.1.1. Смакові сиропи
- •5.2. Особливості екстрагування рослинної сировини 3 клітинною структурою
- •5.3. Стадії процесу екстрагування I їх кількісні характеристики
- •5.4. Основні чинники впливу
- •5.6.2. Стандартизація
- •5.9. Екстракти-концентрати
- •6.1. Методи одержання ефірних масел
- •6.2. Визначення якості ефірних масел
- •7.2. Рослинні біологічно активні речовини, способи їх виділення
- •8.2. Розділення бар за допомогою мембран
- •8.4. Адсорбційно-хроматографічні методи
- •8.5. Гель-фільтрація
- •8.6. Гідрофобна хроматографія
- •8.9. Кристалізація
- •8.10. Екстракція в системах рідина—рідина
- •8.11. Одноступінчаста екстракція
- •9.1. Глибинне суспензійне культивування
- •9.2. Промислове виробництво бар 13 культури клітин рослин
- •10.1. Біогенні стимулятори, їхні властивості та умови продукування
- •10.2. Сучасні відомості про хімічну природу біогенних стимуляторів
- •10.3. Біогенні препарати рослинного походження
- •10.4. Біостимулятори тваринного походження
- •10.6. Стандартизація препаратів біогенних стимуляторів
- •10.7. Препарати 13 свіжих рослин
- •10.8. Способи одержання соків 13 свіжої рослинної сировини
- •10.9. Згущені соки
- •10.10. Сухі соки
- •10.11. Екстракційні препарати 13 свіжих рослин
- •11.1. Препарати підшлункової залози
- •11.3. Препарати гіпофіза
- •12.1. Виробництво ферментів 13 сировини тваринного походження
- •12.2. Виробництво ферментів 3 рослинної сировини
- •12.3. Виробництво фармацевтичних препаратів на основі мікробіологічного синтезу. Ферменти
- •13.1. Класифікація зборів
- •13.2. Приготування зборів
- •13.3. Окрема технологія зборів
- •13.4. Порошки (pulveres)
- •13.5. Технологія порошків
- •13.6. Окрема технологія I номенклатура порошків
- •14.2. Характеристика таблеток
- •14.3. Класифікація таблеток
- •14.4. Властивості порошкоподібних лікарських субстанцій
- •14.5. Основні групи допоміжних речовин у виробництві таблеток
- •14.6. Технологічний процес виробництва таблеток
- •14.7. Типи таблеткових машин
- •14.8. Чинники, що впливають на основні якості таблеток — механічну міцність, розпадання I середню масу
- •14.9. Вплив допоміжних речовин I виду грануляції на біодоступність лікарських речовин 13 таблеток
- •14.11. Формовані (тритураційні) таблетки
- •14.16. Гранули. Мікродраже. Спансули. Драже
- •15.1. Будова мікрокапсул
- •15.2. Характеристика оболонок мікрокапсул
- •15.4. Стандартизація мікрокапсул
- •15.5. Лікарські форми, одержані на основі мікрокапсул
- •16.1. Сучасна класифікація I загальна характеристика
- •16.2. Характеристика основних I допоміжних речовин
- •16.3. Виробництво желатинових капсул
- •16.4. М'які желатинові капсули
- •16.5. Тверді желатинові капсули
- •16.7. Контроль якості
- •16.8. Ректальні желатинові капсули
- •16.9. Чинники, що впливають на біологічну доступність лікарських речовин у желатинових капсулах
- •17.1. Промислове виробництво суспензій I емульсій
- •17.2. Оцінка ефективності перемішування
- •18.1. Загальні відомості
- •18.2. Сучасні вимоги до мазей
- •18.3. Вимоги до мазевих основ
- •18.4. Класифікація мазевих основ
- •18.5. Технологія виготовлення мазей на фармацевтичних підприємствах
- •18.8. Зберігання
- •19.1. Загальна характеристика. Класифікація. Вимоги
- •19.2. Створення умов для виробництва стерильної продукції
- •19.3. Промислове виробництво первинних упаковок для стерильної продукції
- •19.4. Підготовка посудин до наповнення I пакувальних матеріалів
- •19.4.1. Підготовка ампул до наповнення
- •19.5. Вимоги до вихідних речовин
- •19.7. Розчинники для стерильних
- •I асептично виготовлених лікарських
- •19.11. Виробництво за асептичних умов
- •19.13. Методи контролю якості парентеральних лікарських засобів
- •19.14. Маркування I пакування
- •20.1. Класифікація очних лікарських форм та вимоги до них
- •20.2. Очні краплі
- •20.3. Проблеми виробництва очних крапель в оптимальній упаковці
- •20.6. Очні вставки
- •20.7. Очні спреї
- •20.8. Контроль якості очних лікарських форм
- •20.9. Особливості технології виготовлення очних ліків
- •21.1. Визначення. Загальні властивості
- •21.3. Способи одержання супозиторіїв
- •21.5. Перспективи розвитку ректальних лікарських форм
- •22.1. Загальна характеристика I класифікація пластирів
- •22.2. Гірчичники
- •23.1. Історія створення. Переваги I вади
- •23.2. Характеристика I класифікація лікарських засобів, що знаходяться під тиском
- •23.3. Контейнери I клапанно- розпилювальні пристрої
- •23.4. Пропеленти, які застосовуються для створення лікарських засобів, що знаходяться під тиском
- •23.7. Виготовлення контейнерів. Способи наповнення їх пропелентом
- •23.8. Стандартизація та умови
- •23.9. Нові упаковки для лікарських засобів, що знаходяться під тиском
- •24.1. Особливості технології лікарських форм для дітей
- •24.3. Склад I технологія лікарських форм для дітей
- •25.2. Види споживчої тари для різних лікарських форм
- •26.1. Нові лікарські форми. Загальна характеристика та класифікація
- •26.2. Пероральні терапевтичні системи
- •26.3. Трансдермальні терапевтичні системи
- •26.4. Очні терапевтичні системи
- •26.5. Внутрішньопорожнинш терапевтичні системи
- •26.8. Системи 13 спрямованою доставкою лікарських речовин
- •26.9. Прогнозування розвитку лікарських форм
- •Глава 1.Загальні питання технології ліків заводського
- •Глава 6. Ефірні масла (є.В.Гладух) 127
- •Глава 7. Максимально очищені препарати (новогаленові) і препарати індивідуальних речовин (л. I. Богуславська) 139
- •Глава 8. Способи очищення біологічно активних речовин (бар) рослинного, тваринного походження, одержаних на основі біосинтезу (л.І.Богуславська) 173
- •Глава 9. Виробництво препаратів з культури тканин і рослинних клітин (л. I. Богуславська, д.В.Рибачук) 20°
- •Глава 10. Препарати біогенних стимуляторів. Препарати із свіжої рослинної сировини (л. M. Хохлова, b.I. Чуєшов) 215
- •Глава 11. Препарати гормонів (л.М.Хохлова, b.I. Чуєшов).... 238
- •Глава 12. Препарати ферментів (л.І.Богуславська,
- •Глава 14. Таблетки (є.В.Гладух,п.Д.Пашнєв) 305
- •Глава 20. Очні лікарські засоби (л. M. Хохлова, I. В. Сайко) .... 577
- •Глава21. Супозиторп(о.О.Ляпунова) 608
- •Глава22. Пластирі.Гірчичники (о.О.Ляпунова) 625
- •Глава 23. Лікарські засоби, що знаходяться під тиском
- •Глава 24. Лікарські форми для дітей
- •Глава 25. Тара й упаковка (і.В.Сайко, л.М.Хохлова) 670
- •Глава 26. Досягнення фармацевтичних технологій в галузі створення нових готових лікарських препаратів (b.I. Чуешов) 691
19.13. Методи контролю якості парентеральних лікарських засобів
Рідкі лікарські засоби для парентерального застосування зазвичай контролюють за такими показниками якості: опис, ідентифікація, прозорість, кольоровість, pH,супровідні домішки, об'єм, що витягається, стерильність, пірогени або бактеріальні ендотоксини, аномальна токсичність, механічні включення, кількісне визначення антимікробні консерванти.
Для рідких лікарських засобів для парентерального застосування у вигляді в'язких рідин додатково контролюють густину.
Для рідких лікарських засобів для парентерального застосування у вигляді суспензій додатково контролюють розмір частинок, однорідність вмісту (на випадок суспензій в одноразових контейнерах), стійкість суспензій.
573
Для проведення випробувань «Прозорість», «Кольоровість», «рН» при контролі порошків для ін'єкційних або внутрішньовенних інфузійних лікарських засобів використовують розчин лікарського засобу в тому розчиннику і в тій концентрації, які зазначені в інструкції для застосування, якщо немає інших зазначень в окремій статті.
Прозорість. Розчини мають бути прозорими ДФУ (вид. I,п. 2.2.1)у порівнянні з водою P або відповідним розчинником, якщо немає інших зазначень в окремій статті.
Кольоровість. Забарвлення лікарських засобів для парентерального застосування визначають шляхом порівняння з еталонами відповідно до вимог статті «Визначення ступеня забарвлення рідин» ДФУ (вид. I,п. 2.2.2)або до зазначень окремої статті.
Об'єм, що витягається. Визначення проводять відповідно до вимог статті «Об'єм, що витягається» ДФУ (вид. I, п. 2.9.17).
Однорідність вмісту. Порошки для ін'єкційних або внутрішньовенних інфузійних лікарських засобів, а також однодозові суспензії для ін'єкцій мають відповідати вимогам статті «Однорідність вмісту діючої речовини в одиниці дозованого лікарського засобу» ДФУ (вид. I,п. 2.9.6),якщо немає інших зазначень в окремій статті.
Стерильність. Випробування на стерильність проводять використовуючи метод мембранної фільтрації або метод прямого висівання (ДФУ, п. 2.6.1)
Пірогени. Випробуванню на наявність пірогенів мають підлягати всі лікарські засоби для парентерального застосування незалежно від дози, об'єму і шляхів введення, використовуваних у клініці. Випробування на наявність пірогенів проводять відповідно до вимог статті «Пірогени» ДФУ (вид. I, п. 2.6.8) або «Бактеріальні ендотоксини» ДФУ (вид. I, п. 2.6.14). Якщо зазначено випробування на бактеріальні ендотоксини, то випробовування на пірогени не проводять, якщо відсутні інші зазначення в окремій статті.
Аномальна токсичність. Випробування на аномальну токсичність проводять відповідно до вимог статті «Аномальна токсичність» ДФУ (вид. I,п. 2.6.9).
Механічні включення. Випробування проводять відповідно до вимог статті «Механічні включення» ДФУ (вид. I,п. 2.9.19— 2.9.21).
Для більш об'єктивної оцінки якості розчину за цим параметром були розроблені інші методи:
візуально-оптичний, побудований на використанні проекторів, збільшувальних лінз, поляризаційного світла і т.д.;
оптичний, з автоматичною реєстрацією фотоелементами поглинання або розсіювання прохідного світла;
мембрано-мікроскопічний;
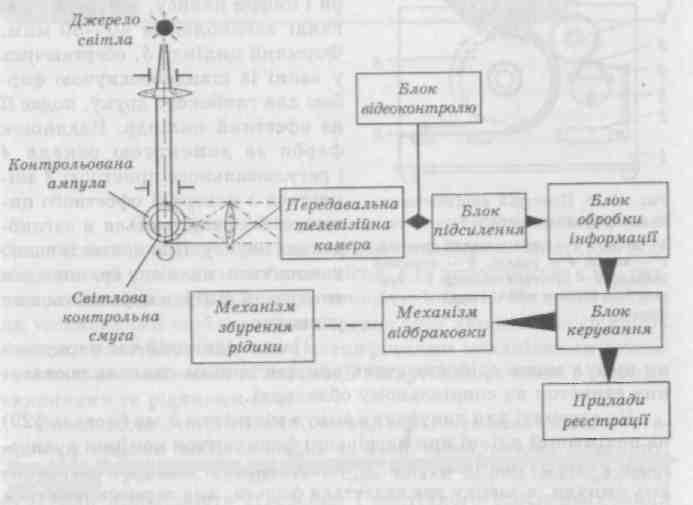
проточний (рис. 19.24).
Рис. 19.24. Будова установки для об'єктивного контролю чистоти розчину в ампулах (схема)
Стійкість суспензії та інші показники. Суспензії для парентерального застосування після струшування до одержання однорідної суспензії мають зберігати однорідність не менше 5 хв, якщо немає інших зазначень в окремій статті.
Суспензія має вільно проходити в шприц крізь голку № 0840,якщо немає інших зазначень в окремій статті.
Розмір частинок для суспензій котролюють за методиками, зазначеними в окремій статті.
Кількісне визначення. Вміст визначуваних речовин в рідких лікарських засобах для парентерального застосування виражають у грамах або міліграмах в 1мл препарату, якщо немає інших зазначень в окремій статті.
Вміст визначуваних речовин у порошках для ін'єкцій або внутрішньовенних інфузій в однодозових контейнерах виражають у грамах, міліграмах або одиницях дії (ОД) в одній дозі, якщо немає інших зазначень в окремій статті.
Після отримання задовільних результатів контролю контейнери з ПЛЗ маркують і упаковують.
574
575

