
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
1.6.10. Расчет реакционной способности различных связей
С–Н и состава продуктов галогенирования алканов
Приведенные в табл. 1.3 значения энергий связей С–Н являются постоянными для ряда алканов и не зависят от того, в каком конкретном соединении они находятся. Это значит, что реакционная способность атомов водорода в реакции свободнорадикального замещения оценивается одними и теми же величинами. В реакции хлорирования отношение реакционной способности первичной, вторичной, третичной связей С–Н составляет 1:3,8:5, для реакции бромирования это соотношение равно 1:82:1600.
Как были рассчитаны эти значения? При хлорировании пропана, инициированном ультрафиолетовым облучением (25 °С), получено 56 % 2-хлорпропана и 44 % 1-хлорпропана.
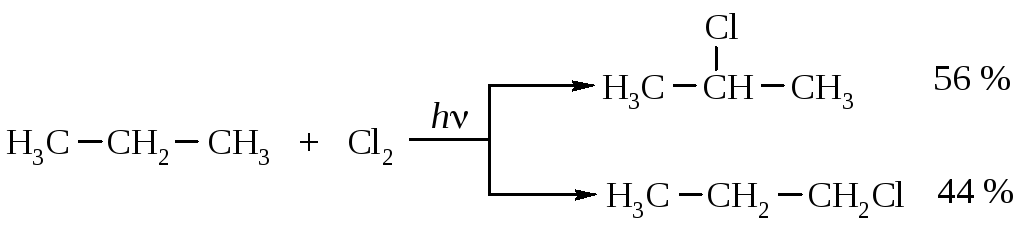
Активность первичной связи С–Н принимаем за единицу. Искомую активность вторичной связи С–Н находят следующим расчетом: общая активность шести первичных связей в молекуле пропана равна 6·1 = 6. Активность двух вторичных связей - 2·Х. Общая активность всех связей С–Н - (6+2Х) принимается за 100 %. Массовая доля 1-хлорпропана в продуктах реакции 44 %. Отсюда 6/(6+2X)·100 = 44, следовательно, X = 3,8. Эту же цифру можно получить другим методом: (44/6) : (56/2) = 7,33 : 28 = 1 : 3,8.
Активность третичной связи можно получить по данным хлорирования изобутана.
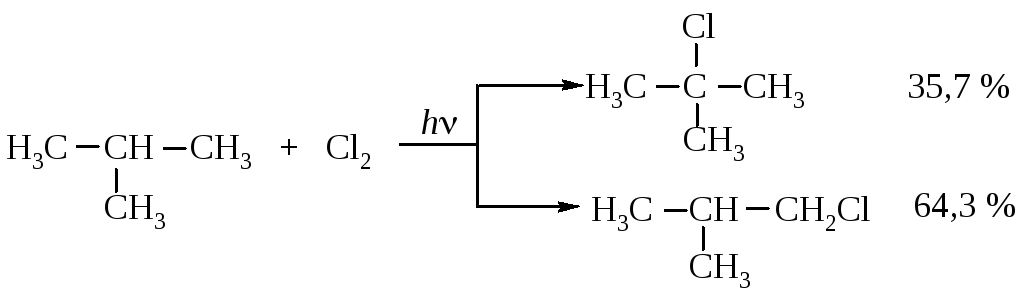
Отсюда соотношение активностей первичной и третичной С–Н-связей: (64.3/9):(35,7/1) = 7,06:35,7 = 1:5.
Пример расчета состава продуктов хлорирования н-бутана.
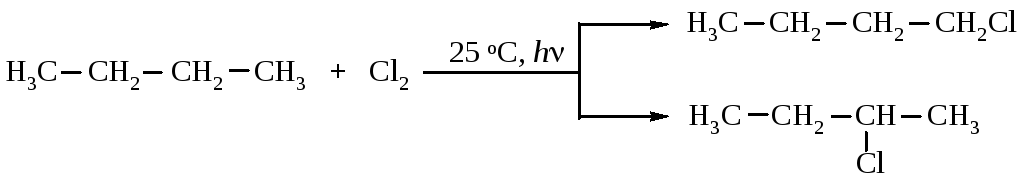
Общая активность шести первичных связей С–Н молекулы бутана равна 6·1 = 6, а четырех вторичных связей 4·3,8 = 15,2. Активность всех химических связей 6+15,2 = 21,2 - принимается за 100 %. Массовая доля 1-хлорбутана в продуктах реакции составляет (6:21,2) ·100 = 28,3 %, остальные (15,2:21,2) ·100 = 71,7 % приходятся на долю 2-хлорбутана.
1.6.11. Селективность в реакциях хлорирования
и бромирования
При исследовании галогенирования алканов были получены значения энергий активации медленной стадии реакции (табл. 1.4).
R–H + Х• R• + HX
При хлорировании различия в энергиях активации, а следовательно, и различия в скоростях образования первичного, вторичного и третичного радикалов малы (относительные скорости 1:3,8:5,0).
Таблица 1.4
Энергия активации реакции RH + Х• R•+HX
|
R• |
Еа, кДж/моль | |
|
X = Cl |
X = Br | |
|
CH3• |
16 |
75 |
|
Первичный |
4 |
54 |
|
Вторичный |
2 |
42 |
|
Третичный |
1 |
31 |
При бромировании различия в энергиях активации и в скоростях образования алкильных радикалов значительно больше (относительные скорости 1:82:1600). Реакция хлорирования протекает с низкой селективностью. Наоборот, реакции значительно менее реакционноспособного брома характеризуются высокой степенью избирательности.
Это общее правило:
-
чем меньше реакционная способность реагента, тем больше его избирательность (селективность).
Для понимания такой зависимости может быть полезен постулат Хэммонда.
-
Малые изменения энергии молекулы могут соответствовать только малым изменениям структуры. Вследствие этого переходное состояние должно быть структурно близко к той молекуле, энергия которой ближе к энергии переходного состояния.
Иными словами, при экзотермической реакции, какой является взаимодействие атомов хлора с алканом, переходное состояние близко к исходной молекуле. Его называют ранним переходным состоянием. При эндотермической реакции – взаимодействие атомов брома с алканом – переходное состояние близко по строению к конечному продукту – углеводородному радикалу (позднее переходное состояние).
При атаке молекулы R–H малореакционноспоcобным атомом брома переходное состояние достигается поздно, когда алкильная группа уже в значительной степени приобрела характер свободного радикала. Оно характеризуется степенью разрыва связи С–Н, близкой к 100 %, углерод имеет почти тригональную структуру. Факторы, стабилизирующие свободный радикал, в такой же степени стабилизируют переходное состояние (рис. 1.8).
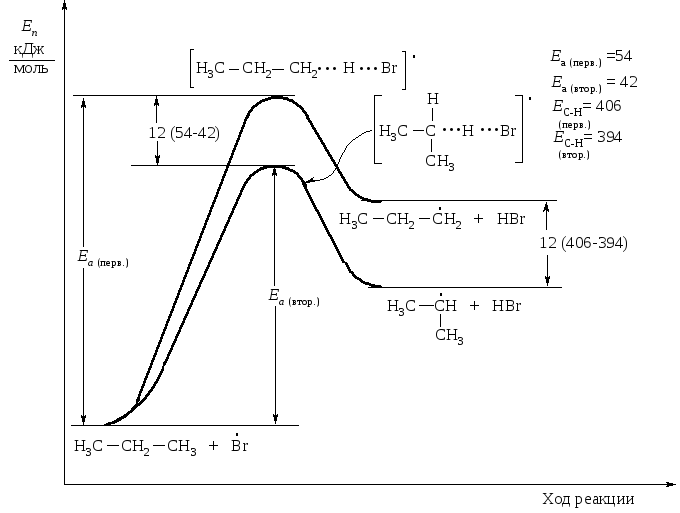
Рис. 1.8. Энергетическая диаграмма взаимодействия
