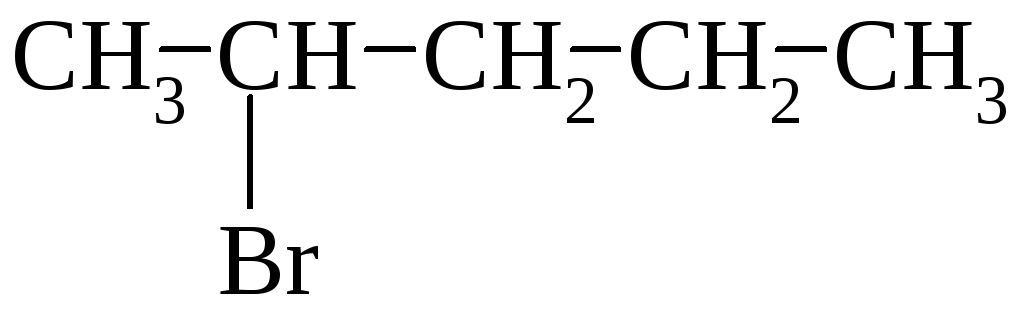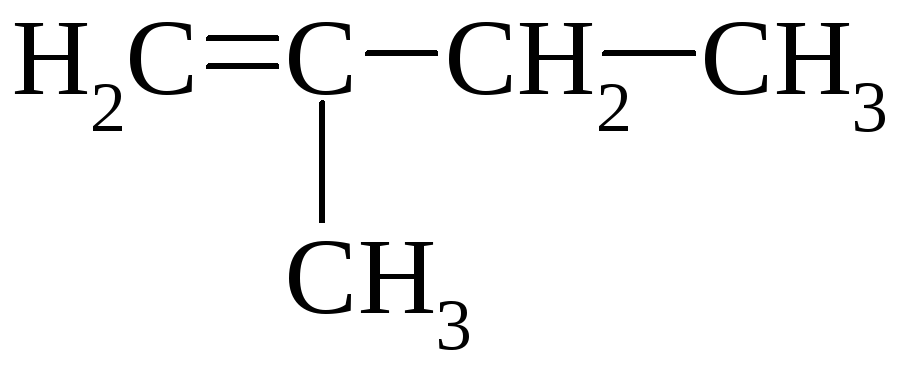- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
|
R - G |
Массовая доля, % | |
|
CH2CHCH2CH2CH3 |
CH3CHCHCH2CH3 | |
|
|
31 |
69 |
|
|
48 |
52 |
|
|
98 |
2 |
Количество продукта Гофмана в реакци Е2 возрастает с увеличением объема основания.
Таблица 11.4
Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
|
Основание R-OӨ |
Массовая доля, % | |
|
|
| |
|
C2H5 – OӨ |
70 |
30 |
|
(CH3 )3C – OӨ |
27,5 |
72,5 |
|
(C2H5 )3 – OӨ |
11,5 |
88,5 |
Объемные группы при С-атоме создают пространственные затруднения для атаки водорода основанием при наиболее алкилированном атоме углерода (что вело бы к продукту элиминирования в соответствии с правилом Зайцева), и реакции отщепления протекают по Гофману.
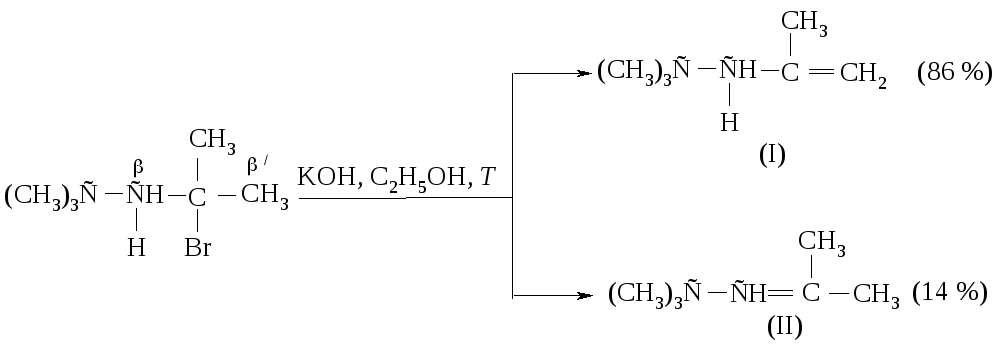
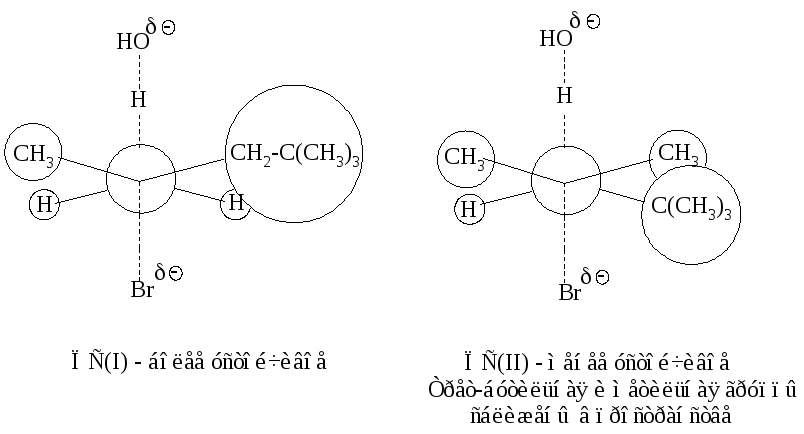
Реакционная способность галогеналканов в реакциях Е2 изменяется в ряду:
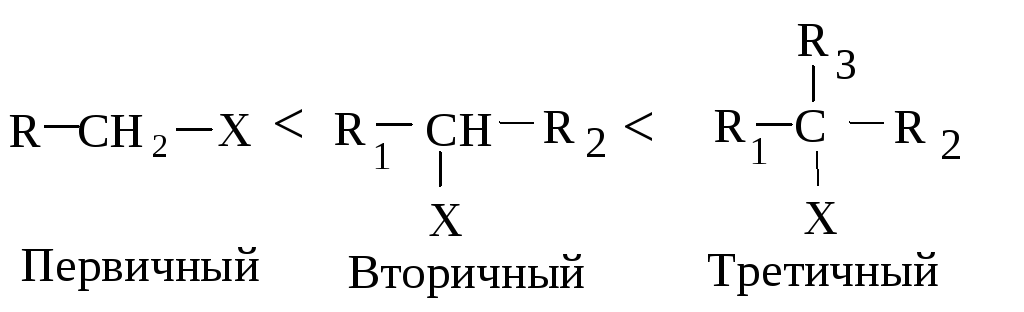
Такое увеличение реакционной способности галогеналканов при переходе от первичных к третичным обусловлено увеличением устойчивости образующихся алкенов.
5.2.2. Мономолекулярное отщепление е1
Третичные галогеналканы реагируют по мономолекулярному механизму.
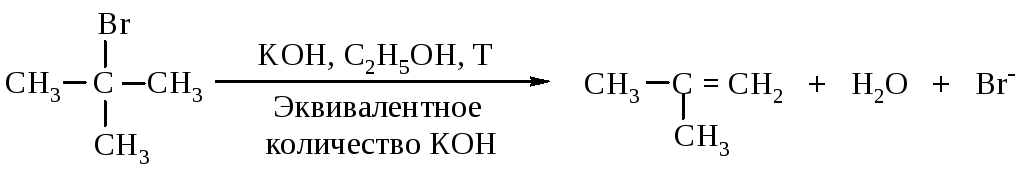
Механизм. Реакция протекает в две последовательные стадии. Первая стадия аналогична первой стадии мономолекулярного нуклеофильного замещения:
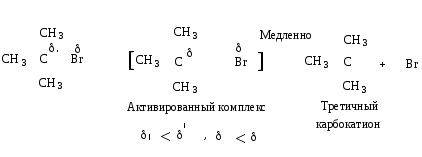
На второй стадии основание атакует водород при С - атоме.
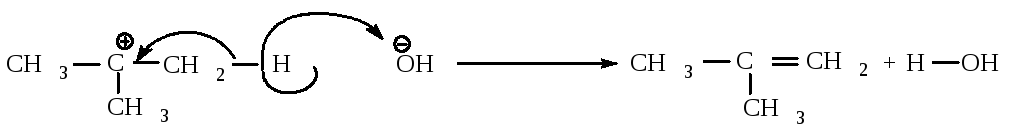
Уравнение cкорости реакции. Скорость реакции Е1 не зависит от концентрации основания.
v(E1) = kR-Br
Реакционная способность галогеналканов увеличивается при переходе от первичных к третичным. Это обусловлено увеличением устойчивости карбокатионов, образующихся в медленной стадии.
11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
В реакциях замещения донор электронной пары отдает свою пару электронов атому углерода С, связанному с галогеном - в этом случае он является нуклеофилом в реакциях замещения. Тот же донор электронов может отдавать свою электронную пару атому водорода, связанному с С - в этом случае он является основанием в реакциях элиминирования.
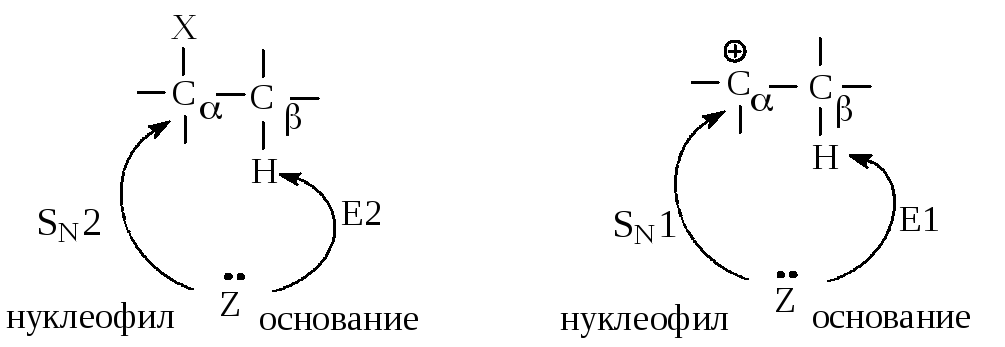
Реакции элиминирования и нуклеофильного замещения являются конкурирующими. При переходе от первичных к вторичным и далее третичным галогеналканам элиминирование происходит все в большей степени.
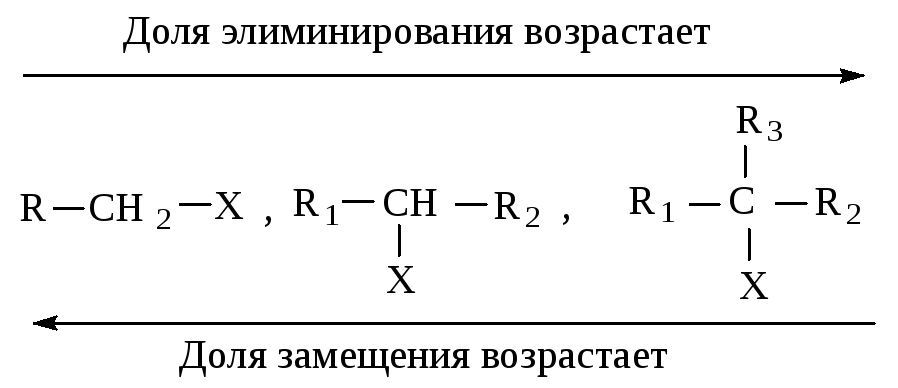
Хотя трудно точно предвидеть, каким образом будет протекать реакция в результате атаки частицы с неподеленной парой электронов атома углерода, несущего положительный заряд, существуют правила, которые могут подсказать главное направление превращений.
В случае сильноосновных и слабополяризуемых агентов, подобно ӨNH2, ӨOC2H5, существует тенденция к преимущественному протеканию реакции Е2, слабоосновные реагенты, подобные иодид- или ацетат-иону, благоприятствуют SN2-реакции. С повышением температуры выход продуктов элиминирования увеличивается за счет продуктов замещения.
Более полярный растворитель в большей степени способствует реакции бимолекулярного замещения по сравнению с реакцией Е2. Сравнение переходных состояний для реакций SN2 и Е2 показывает, что в переходном состоянии реакции Е2 заряд делокализован в большей степени, чем в переходном состоянии реакции SN2.
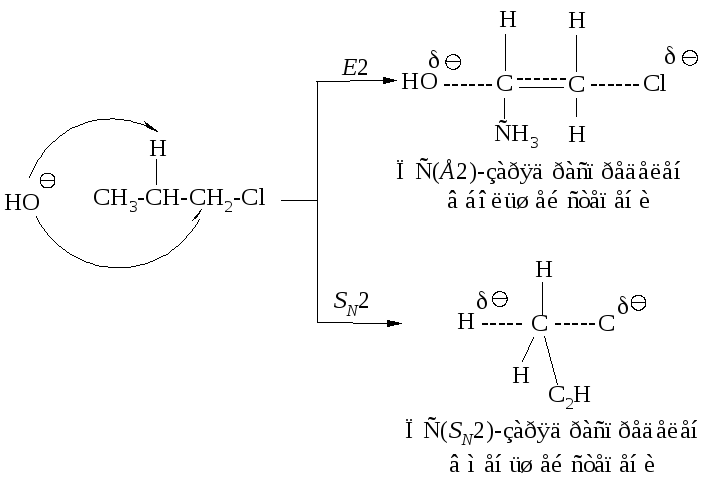
Вследствие этого более полярный растворитель, в одинаковой степени сольватируя исходные состояния реакций Е2 и SN2 (они одинаковы), в большей степени сольватирует переходное состояние SN2-реакции, чем переходное состояние Е2-реакци. Это приводит к возрастанию скорости образования продукта замещения. Поэтому в Е2-реакциях используют спиртовой раствор щелочи, а в SN2 - более полярный растворитель - водный раствор щелочи.
Карбокатионы (в реакциях SN1 и Е1) дают больше продуктов замещения, чем элиминирования. Замещение при Сα способствует Е2-реакции в большей степени, чем SN2, и облегчает Е1, но это направление не становится главным по сравнению с SN1. Замещение при Сβ способствует реакции элиминирования, т.к. благоприятствует образованию наиболее устойчивых алкенов.