
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
2.4. Обозначение конфигураций
Как обозначить конфигурацию соединения, чтобы по названию можно было изобразить пространственное расположение групп у хирального атома углерода? Для этого используют R,S-систему, предложенную К. Ингольдом, Р. Каном, З. Прелогом. R,S-система основана на определении старшинства заместителей вокруг хирального центра. Старшинство групп определяется следующим образом:
1). Атом с большим атомным номером является старшим относительно атома с меньшим атомным номером.
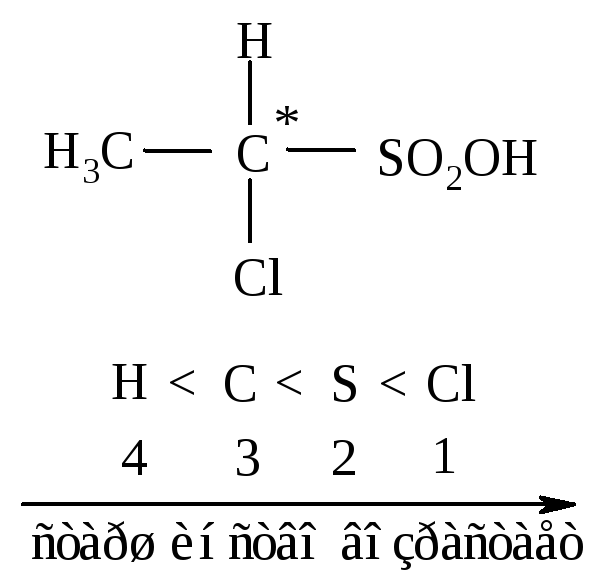
2). Если непосредственно соединенные с углеродом С* атомы одинаковы, то необходимо рассмотреть старшинство последующих атомов.
Например, как определить старшую из групп: -C2Н5 и СН(СН3)2 в соединении

В этильной группе за атомом, соединённым с хиральным центром, следуют Н, Н и С, а в изопропильной группе - Н, С и С. Сравнивая эти группы между собой, устанавливаем, что изопропильная группа старше, чем этильная.
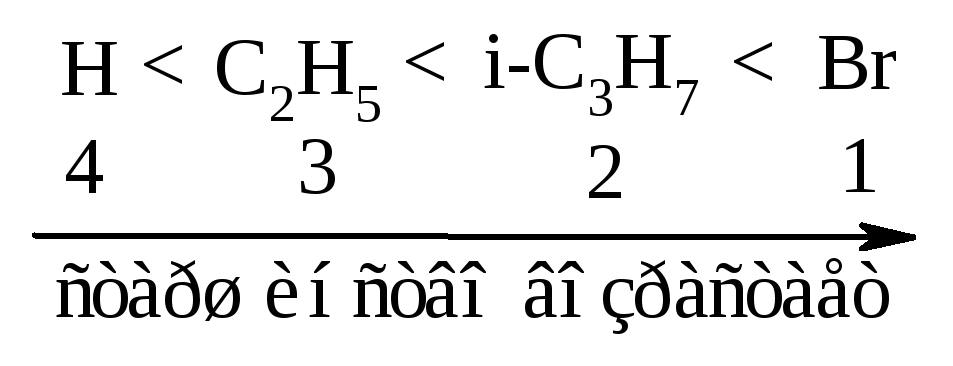
3). Если хиральный углерод С* соединён с атомом, имеющим кратную связь, то связи этого атома следует представить как простые связи.

4). Для того, чтобы установить конфигурацию молекулы, её располагают так, чтобы связь хирального центра с младшей группой под номером 4 была направлена от наблюдателя, и определяют расположение оставшихся групп (рис. 2.6).
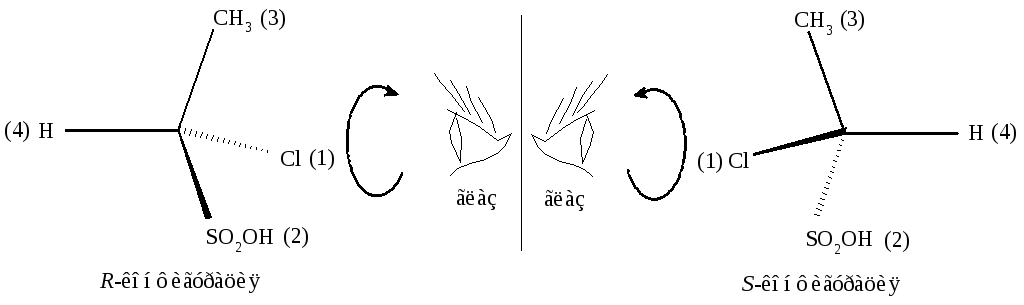
Рис. 2.6. Определение R,S-конфигураций
Если старшинство групп убывает (123) по часовой стрелке, то конфигурация хирального центра определяется как R (от латинского слова “rectus” - правый). Если старшинство заместителей убывает против часовой стрелки, то конфигурация хирального центра - S (от латинского “sinister” - левый).
Знак оптического вращения (+) или (-) определяется экспериментально и не связан с обозначением конфигурации (R) или (S). Например, правовращающий 2-бутанол имеет (S)-конфигурацию.
Для того, чтобы определить конфигурацию соединения, изображённого проекционной формулой Фишера поступают следующим образом.

1). Выполняют чётное число перестановок заместителей у хирального центра (нечётное число перестановок приведёт к энантиомеру) так, чтобы младший заместитель под номером 4 оказался вверху или внизу.
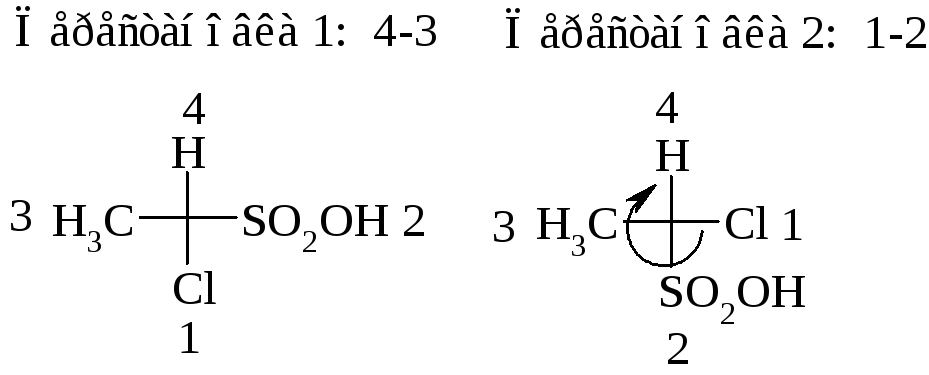
2). Определяют расположение оставшихся групп, обходя их в порядке убывания старшинства. Если старшинство заместителей убывает по часовой стрелке, то исходную конфигурацию определяют как R-конфигурацию, если против часовой стрелки, то конфигурацию определяют как S-конфигурацию.
Если преобразовать проекционную формулу непросто, можно установить порядок уменьшения старшинства, отбросив младший заместитель, стоящий сбоку, но выбрать для обозначения конфигурации «обратный» символ. Например, в исходном соединении
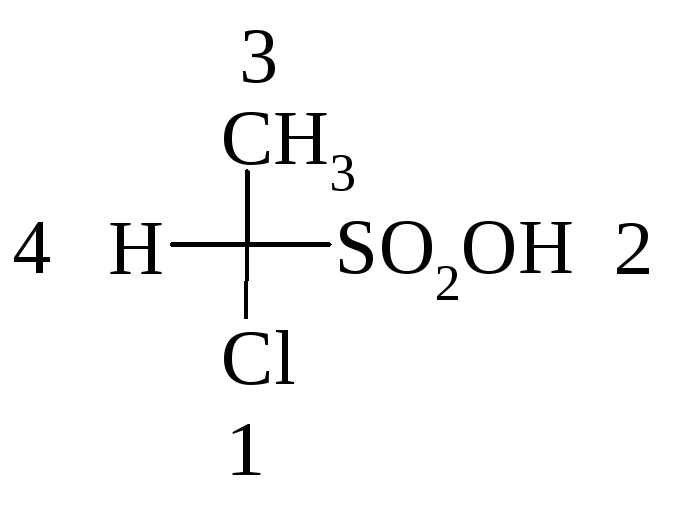
отбросив младший заместитель (H), устанавливаем порядок уменьшения старшинства: 1→2→3. Получаем обозначение (S), меняем его на (R) и получаем правильное название: (R)-2-хлорэтансульфоновая кислота.
2.5. Соединения с несколькими хиральными центрами.
Диастереомеры. Рацемат. Мезо-формы
Количество стереоизомеров соединения, содержащего n хиральных атомов углерода, определяют по формуле 2n. Например, соединение с двумя хиральными центрами существует в виде четырёх стереоизомеров. Так, 2,3-дибромпентан существует в виде следующих стереоизомеров:
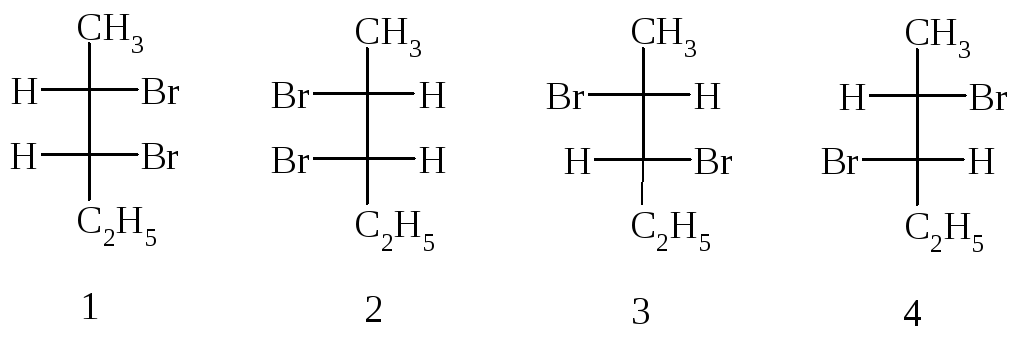
Стереоизомеры 1 и 2, а также стереоизомеры 3 и 4 представляют собой две пары энантиомеров. Пары стереоизомеров 1 и 3, 1 и 4, 2 и 3, 2 и 4 не являются энантиомерами, их называют диастереомерами.
-
Стереоизомеры, которые не являются энантиомерами, называются диастереомерами.
Диастереомеры обладают различными физическими свойствами, в том числе различным удельным вращением.
-
Эквимолекулярная смесь двух энантиомеров одного и того же соединения называется рацематом.
Рацемат оптически неактивен, потому что оптическая деятельность одного энантиомера погашается оптической деятельностью другого.
Нельзя утверждать, что соединение, в молекуле которого присутствуют два или более хиральных центров, обязательно должно быть оптически активным. Рассмотрим молекулу с двумя хиральными центрами 2,3-дибромбутан.
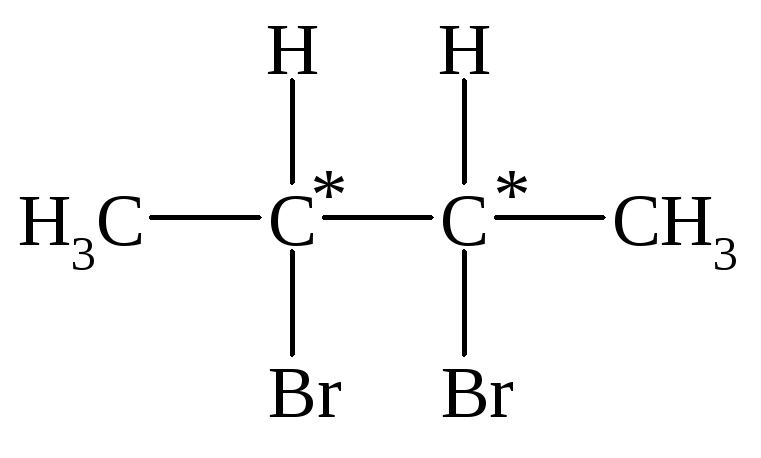
Диастереомеры этого соединения представлены на рис. 2.7.
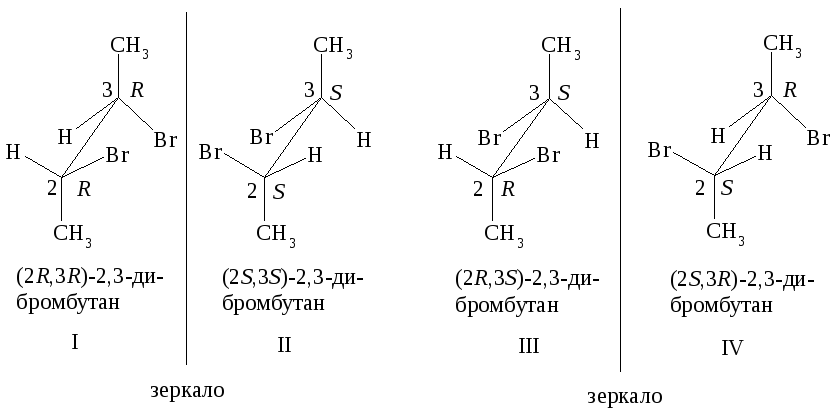
Рис. 2.7. Диастереомеры 2,3-дибромбутана
Стереоизомеры I и II - энантиомеры, а структуры III и IV идентичны, если предположить, что поворот атома C3 относительно C2 совершается свободно. Действительно, структура III в результате такого поворота может перейти в заслоненную конформацию IIIА, а структура IV – в IVА, которые представляют собой одно и то же соединение.
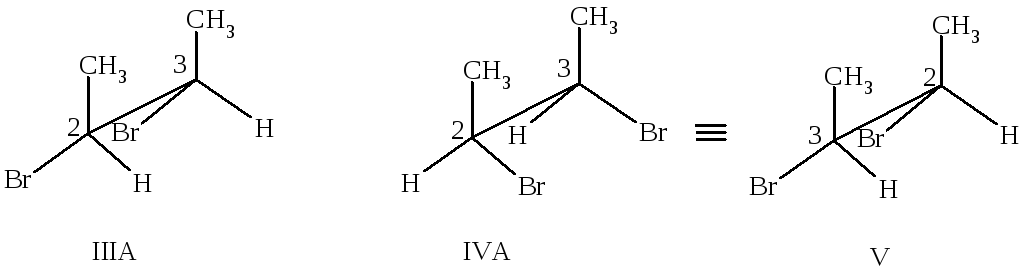
В этом легко убедиться, если структуру IVА развернуть атомом C3 к наблюдателю (структура V). В заслоненной конформации IIIА (или, что то же самое, IVА) имеется плоскость симметрии, перпендикулярная связи С2–С3. Плоскость симметрии делит молекулу на две половины, каждая из которых представляет собой зеркальное изображение другой. Такие молекулы не проявляют оптической активности, поскольку вклады, вносимые в оптическое вращение каждой из половин, равны по величине, но противоположны по знаку.
Таким образом, если все возможные оптически активные конформации находятся в достаточно быстром равновесии с конформацией, имеющей плоскость симметрии, то это соединение нельзя разделить на индивидуальные оптически активные формы.
-
Оптически неактивный стереоизомер соединения, которое может существовать в других оптически активных формах, называют мезо-формой.
Итак, 2,3-дибромбутан существует в виде трех стереомеров: двух энантиомеров (I, II) и мезо-формы (III).
Диастереомеры соединений, в которых содержатся два связанных между собой разных хиральных атома углерода, различают, придавая им в названиях приставки эритро- и трео-. Так, 2-бром-3-фенилбутан может существовать в виде двух диастереомеров.
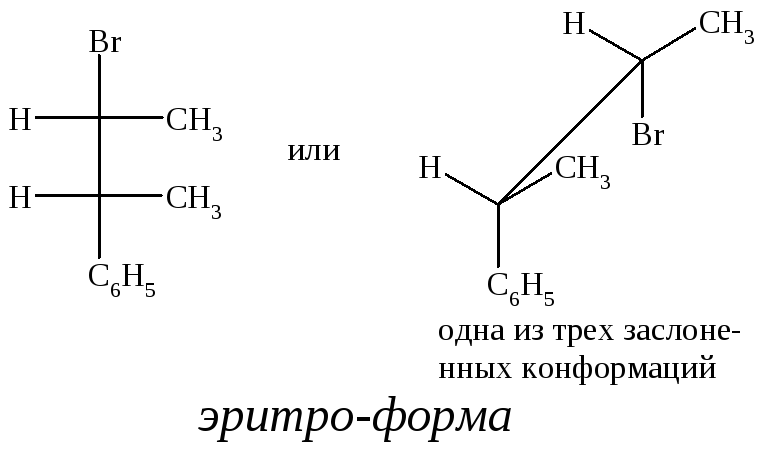
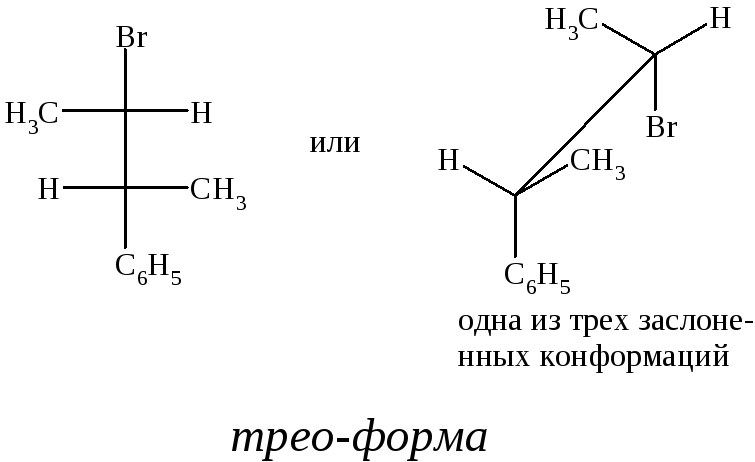
Эритро-диастереомер – это стереомер, в котором две пары одинаковых (или сходных) заместителей при соседних атомах углерода распо-
ложены так, что в одной из трех возможных заслоненных конформаций одинаковые заместители находятся один за другим. Если в эритро-форме Br заменить на C6H5 (или C6H5 – на Br), то получим мезо-форму.
