
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
11.1.3. Сравнение реакций sn 1 и sn 2
Каждый из этих механизмов в чистом виде встречается редко. Реакционная способность в SN2-реакции уменьшается при переходе от СН3-Х к первичным RCH2-X, для вторичных - она гораздо меньше и появляется значительный вклад SN1-реакций. При переходе от вторичных к третичным галогеналканам реакционная способность в SN1-реакции резко возрастает.

Изменяя условия протекания реакций, можно направить процесс преимущественно по тому или иному механизму.
Таблица 11.2
Влияние условий реакции на относительное значение двух механизмов
|
Механизм |
Растворитель |
Сила нуклеофила |
Концентрация нуклеофила |
|
SN1 |
Протонный |
Более слабый |
Мéньшая |
|
SN2 |
Апротонный |
Более сильный |
Бóльшая |
Например, неопентилбромид реагирует с этоксид-ионом по SN2-механизму, а с этиловым спиртом – по SN1-механизму. Сильный нуклеофил (сильное основание), этоксид-ион, выталкивает ион галогена из молекулы, тогда как слабый нуклеофил (этиловый спирт) атакует реакционный центр, после того как галогенид-анион отойдет от реакционного центра и сформируется карбокатион.
11.1.4. Амбидентные ионы
Некоторые нуклеофильные реагенты обладают несколькими реакционными центрами. Примеры таких ионов представлены ниже:
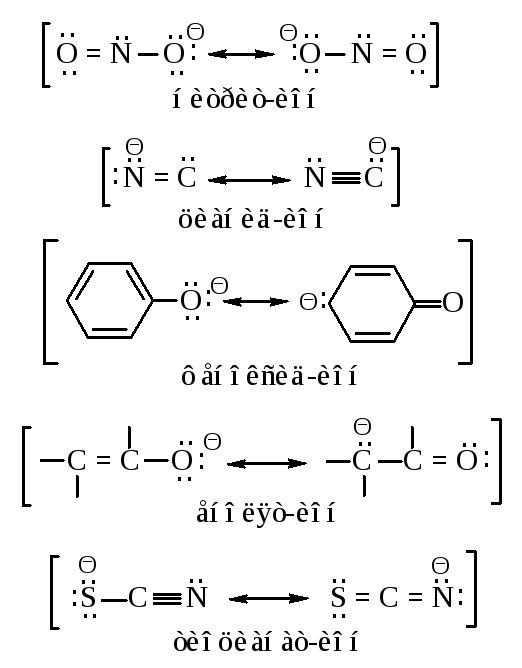
Их называют амбидентными ионами. В амбидентных ионах на атомах с большей электроотрицательностью сосредоточена большая электронная плотность (на атоме кислорода большая электронная плотность - по сравнению с атомами углерода или азота, на атоме азота – по сравнению с атомом углерода). Атомы с меньшей электроотрицательностью обладают большей нуклеофильной силой, т.е. способностью предоставлять свою пару электронов для образования новой ковалентной связи. В соответствии с правилом Корнблюма амбидентные ионы в реакциях SN2-типа атакуются по месту наибольшей нуклеофильности, а в реакциях SN1 – по месту наибольшей электронной плотности.
Замещение с участием таких нуклеофильных реагентов приводит к смеси продуктов. Например, енолят-ионы дают продукты О-алкилирования - виниловые эфиры и С-алкилирования - карбонильные соединения.

Относительная нуклеофильность обоих центров, а следовательно, и соотношение продуктов реакции определяются не только распределением электронной плотности в амбидентном ионе, но и внешними факторами: растворителем, структурой субстрата R-Х.
Влияние растворителя. При взаимодействии бромистого аллила с феноксид-ионом возможно С- и О-алкилирование. В диметиловом эфире этиленгликоля (ДМЭЭ) CH3–O–CH2–CH2–O–CH3 (апротонный растворитель) образуется аллилфениловый эфир с выходом 100 %, в феноле (протонный растворитель) в основном образуется С-аллил-фенол (77 %) а выход эфира только 23 %.


Различная нуклеофильная способность С- и О-атомов обусловлена различной сольватацией в обоих растворителях. В протонном растворителе атом кислорода (атом с большей электронной плотностью) сильнее сольватирован из-за образования водородных связей, чем атом углерода. В результате его нуклеофильная реакционная способность снижена, реакция протекает по менее сольватированному атому углерода.
В апротонном растворителе, в котором отрицательно заряженный ион практически не сольватирован, более активным нуклефильным центром является кислородный атом; протекает преимущественно О-замещение.
Природа алкильного радикала. На соотношение продуктов реакции большое влияние оказывает природа алкильного радикала R в субстрате. При взаимодействии нитрита серебра с алкилбромидом в диэтиловом эфире выход нитроалканов падает при переходе от первичного к третичному алкилгалогениду, и соответственно увеличивается выход эфира азотистой кислоты. Это является следствием изменения механизма реакции.
Первичные галогеналканы реагируют по SN2-механизму. Реакцонный центр, несущий частичный положительный заряд, атакуется атомом, обладающим большей нуклеофильностью (низкой электронной плотностью, высокой поляризуемостью). При взаимодействии первичных галогеналканов образуются преимущественно нитроалканы.

В реакциях вторичных иод- и бромалканов с нитритом серебра в эфире (реакция происходит преимущественно по SN1- механизму) выход нитросоединения составляет лишь 15 %. Третичные галогениды не дают нитроалканов, в реакции образуются эфиры азотистой кислоты (продукты SN1-реакции) и олефины (продукты Е1-реакции). Образующийся карбокатион взаимодействует с атомом, обладающим наибольшей электронной плотностью (низкой поляризуемостью), так как этот атом в состоянии сильнее электростатически притянуть образующийся карбокатион.

При взаимодействии алкилгалогенидов с цианидами щелочных металлов (синтез нитрилов по Кольбе) так же, как в реакции с нитритами, обычно образуется смесь двух продуктов: нитрилов и изонитрилов.

Реакции первичных алкилгалогенидов с цианидами щелочных металлов в апротонных растворителях протекают по механизму SN2, главным продуктом реакции являются нитрилы. Подобным образом можно провести реакцию с вторичными галогеналканами, но с более низкими выходами нитрилов. Третичные галогеналканы не реагируют в этом направлении.
