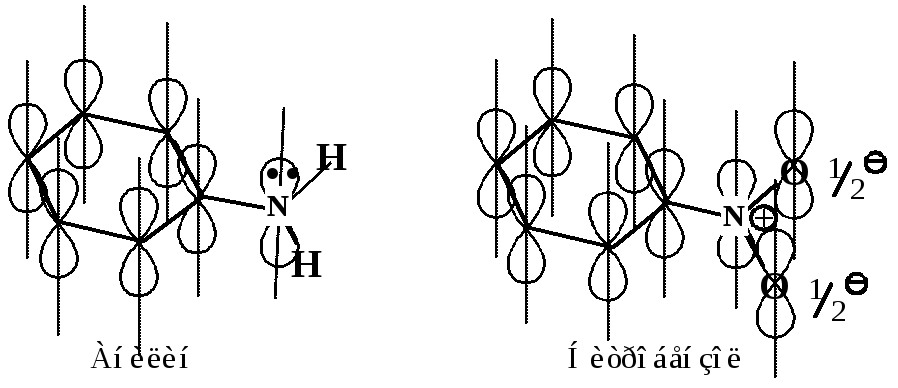- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
8. Электрофильное замещение в производных
БЕНЗОЛА
Любая группа, связанная с кольцом (заместитель, ориентант), влияет на дальнейшее течение электрофильного замещения. Это влияние выражается, во-первых, в изменении реакционной способности кольца по сравнению с бензолом; во-вторых, в направлении атаки электрофильной частицы в определенные положения кольца относительно имеющейся группы.
Все эффекты заместителей рассматриваются относительно эффекта атома водорода, на месте которого в молекуле появился заместитель.
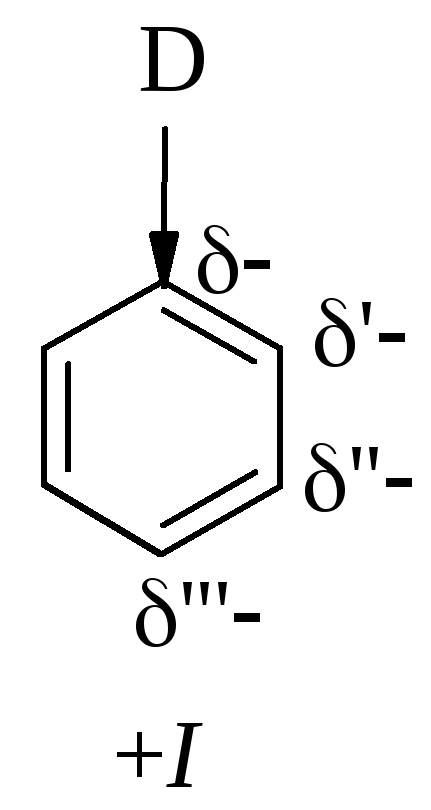
Индуктивный эффект – это перераспределение электронной плотности -связи между двумя атомами, обусловленное различием в их способности притягивать и удерживать электроны. Индуктивный эффект передается от атома к атому по системе -связей и быстро затухает. Если под действием заместителя на соседнем атоме возникает частичный положительный заряд, то этот заместитель проявляет отрицательный индуктивный эффект (-I-эффект) и называется электроноакцепторным.
Этот заместитель уменьшает электронную плотность на соседнем атоме углерода по сравнению с атомом водорода на этом же месте. Влияние заместителя на атомы углерода ароматического кольца будет уменьшаться по мере удаления от заместителя ( > ׳ > ׳׳ > ׳׳׳).
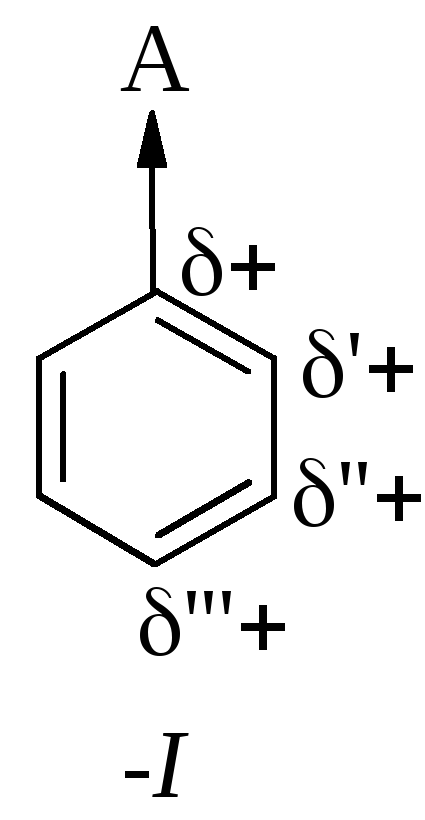
Величина электроноакцепторного индуктивного эффекта возрастает по мере увеличения номера группы периодической системы (для элементов второго периода периодической системы -NH2 < -OH < -F) и уменьшения номера периода (для группы галогенов -I < -Br < -Cl < -F).
Если под действием заместителя на соседнем атоме возникает частичный отрицательный заряд, то этот заместитель проявляет положительный индуктивный эффект (+I-эффект) и называется электронодонорным. Этот заместитель увеличивает электронную плотность на соседнем атоме углерода по сравнению с атомом водорода на этом же месте (Θ > ׳Θ > > ׳׳Θ > ׳׳׳Θ).
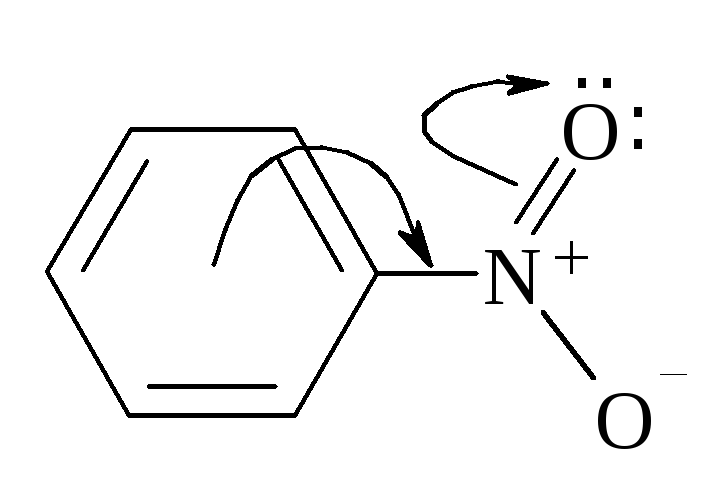
Мезомерный эффект (эффект сопряжения) возникает в сопряжённых системах – т.е. в системах, в которых имеет место чередование простых связей и подвижных пар электронов. Подвижные пары электронов - это электроны кратных связей (-электроны) или свободные пары электронов (р-электроны). Эти электроны не локализованы между двумя атомами или на одном атоме (р-электроны), а распределены по всей сопряженной системе, т.е. орбитали, на которых находятся электроны, перекрываются между собой и образуют новую орбиталь, охватывающую все атомы сопряженной системы. Мезомерным эффектом называется перераспределение - и р-электронов в сопряженной системе под влиянием заместителя за счёт перекрывания орбиталей, на которых находятся делокализующиеся электроны. Необходимым условием делокализации является определенное положение орбиталей, участвующих в сопряжении: их оси должны быть параллельны (рис. 8.1).
|
|
Оси р-орбиталей, участвующих в сопряжении, параллельны, системы сопряженные, делокализация возможна. |
Рис. 8.1. Молекулы анилина, нитробензола
.
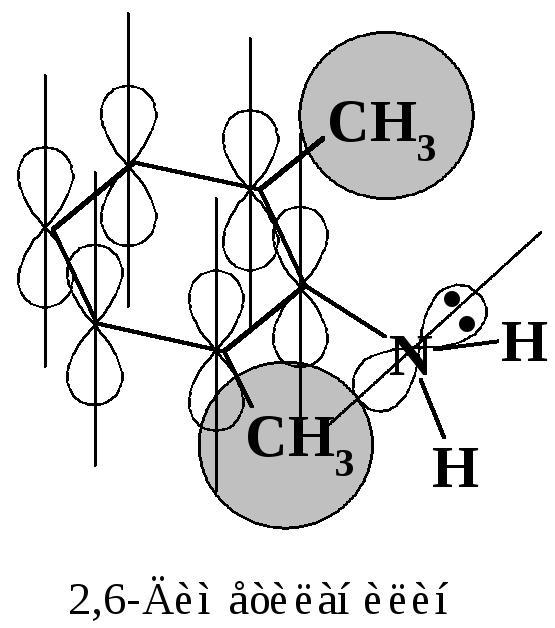
Делокализация невозможна, когда оси p-орбиталей, участвующих в сопряжении, не параллельны (рис. 8.2).
|
|
Оси р-орбиталей, участвующих в сопряжении, не параллельны, делокализация невозможна.
|
Рис. 8.2. Молекула 2,6-диметиланилина
Поскольку n-электроны обладают значительно большей подвижностью, чем -электроны, то изменение электронной плотности в результате проявления мезомерного эффекта распространяется на всю сопряженную систему и оказывает более существенное влияние на реакционную способность, чем индуктивный эффект.
Электронодонорный мезомерный эффект (+М-эффект) описывает повышение электронной плотности в ароматическом кольце. В сопряжение с -электронами ароматического кольца могут вступать только неподеленные электронные пары, находящиеся на высших уровнях атома, связанного с бензольным ядром. Размеры атомов углерода, азота, кислорода, находящихся в одном периоде близки, поэтому p--сопряжение наиболее эффективно, т.е. +М-эффект > –I-эффекта.
Чем больше размер атома, несущего неподеленную пару электронов, отличается от размера атома углерода, тем менее эффективно эти электроны взаимодействуют с -электронами ароматического кольца. В результате +М-эффект уменьшается таким образом: а) -F > -Cl > -Br > -I (ковалентные радиусы С - 0,077; фтор - 0,064; хлор - 0,099; бром - 0,119; иод -0,136 нм); б) -OCH3 > -SCH3. Для этих заместителей +М-эффект < –I-эффекта (рис. 8.3).
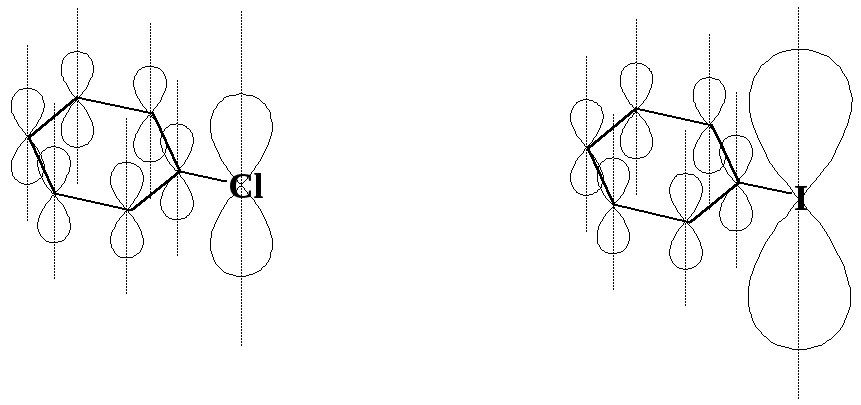
Рис. 8.3. Молекулы хлорбензола, иодбензола:
р--сопряжение малоэффективно.
В одном периоде периодической системы неподеленные пары электронов находятся примерно в равных по размеру областях пространства, поэтому величины электронодонорного мезомерного эффекта определяются электроотрицательностью атомов, несущих неподеленные пары электронов. Чем меньше электроотрицательность элемента, тем легче он предоставляет пару электронов в систему сопряжения.
Действие электроноакцепторного эффекта сопряжения (-М) проявляется в понижении электронной плотности в ароматическом кольце, особенно в о- и п-положениях. Заместители, проявляющие электроноакцепторный мезомерный эффект, обычно имеют кратные связи между атомами с различной электроотрицательностью, при этом более электроотрицательный атом удалён от кольца, а положительно заряженный атом присоединён к ароматическому кольцу.