
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
1.5. Физические свойства
Физические свойства алканов определяются их строением. Ковалентные связи в алканах неполярные (С-С) или малополярные (С-Н). Эти связи симметричны, полярность их взаимно компенсируется, поэтому молекула алкана неполярна. Силы межмолекулярного притяжения сравнительно слабы. Это является причиной небольших значений плотности, температуры кипения и плавления.
В молекуле углеводорода суммарный дипольный момент равен нулю. Однако распределение электронной плотности в каждый момент времени меняется и возникает небольшой диполь. Этот кратковременно существующий диполь будет влиять на распределение электронной плотности соседней молекулы, таким образом, мгновенный диполь одной молекулы индуцирует противоположно ориентированный диполь в соседней молекуле. В результате между молекулами возникают силы притяжения, которые называются дисперсионными. Дисперсионные силы действуют на очень небольшом расстоянии, между поверхностями молекул. Можно ожидать, что чем больше молекула и чем больше её поверхность, тем больше межмолекулярные силы.
Температуры кипения, плавления и плотность увеличиваются с увеличением молекулярной массы (рис. 1.2). Алканы С1 ...С4 - газы, С5 ...С16 - жидкости, далее - твёрдые кристаллические вещества. За исключением низших алканов, температура кипения повышается на 20 - 30 ºС с ростом углеродной цепи на один атом углерода. Такая закономерность изменения температуры кипения характерна для гомологических рядов других классов соединений.
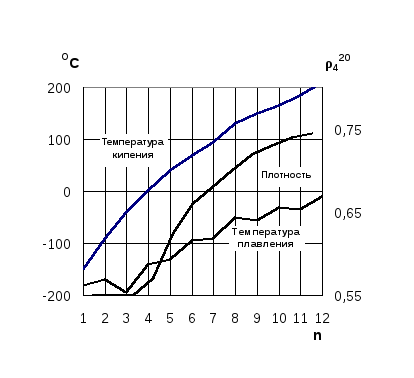
Рис. 1.2. Зависимость температур кипения, плавления и плотностей алканов с неразветвленной цепью от числа атомов углерода (n)
Изомер с разветвлённой цепью имеет более низкую температуру кипения, чем изомер нормального строения.
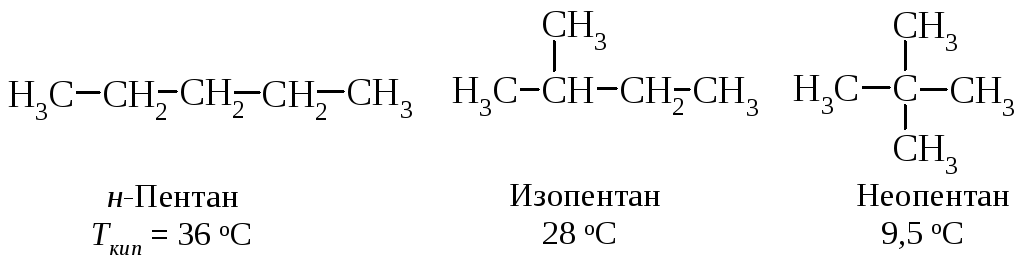
Понижение температуры кипения у изомеров с появлением разветвлений и увеличением их числа объясняется тем, что с увеличением разветвлений форма молекулы стремится к сферической, то есть уменьшается её поверхность, а следовательно, и межмолекулярные силы притяжения. Такая зависимость между формой молекулы и температурой кипения наблюдается и для других классов соединений.
Процесс плавления требует преодоления межмолекулярных сил в твердом теле. Межмолекулярные силы в кристалле зависят не только от размера молекул, но также и от того, как они упакованы в кристаллической решетке. Углеводород с линейной цепью н-пентан плавится при температуре минус 130 оС, а его изомер неопентан, молекулы которого имеют сферическую форму и более плотно упакованы в кристаллической решетке, плавится при более высокой температуре минус 17 оС.
Алканы, неполярные соединения, растворимы в неполярных растворителях (бензол, тетрахлорметан), но нерастворимы в полярных растворителях.
Алканы - диэлектрики с низким значением диэлектрической постоянной ( 2) и меньшим значением показателя преломления по сравнению с показателем преломления углеводородов с кратными связями. Показатель преломления показывает способность молекул вещества поляризоваться под действием внешнего электрического поля (переменного электромагнитного поля светового луча, электрического поля ионного реагента, растворителя). Это свойство вещества называется поляризуемостью. Малые значения показателей преломления алканов свидетельствуют о низкой поляризуемости этих соединений.
В инфракрасных спектрах алканов наблюдаются полосы поглощения валентных колебаний С–Н в области 2800 - 3000 см-1 .
