
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
1.2. Строение метана
Электронная конфигурация основного состояния атома углерода ls22s2 2p2:
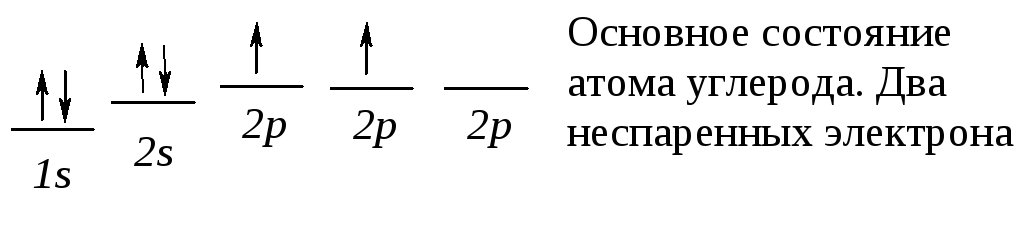
Можно было бы ожидать, что такой атом углерода будет образовывать с двумя атомами водорода соединение СН2. Но в метане углерод связан с четырьмя атомами водорода. Для того чтобы представить образование молекулы СН4, необходимо обратиться к его возбужденному электронному состоянию.

Теперь можно ожидать, что атом углерода образует четыре связи с атомами водорода, но эти связи неравноценны: три связи образованы с использованием р-орбиталей, одна - с использованием s-орбитали. Это противоречит известному факту: все связи в метане эквивалентны.
Далее проводят гибридизацию орбиталей. Математически рассчитаны различные комбинации одной s- и трех р-орбиталей. Гибридные орбитали с наибольшей степенью направленности ("лучшие" орбитали) в результате большего перекрывания дают связи (1) прочнее, чем негибридизованные s- или р-орбитали. Четыре "лучшие" гибридные орбитали (2) эквивалентны. Они направлены к вершинам правильного тетраэдра, угол между двумя орбиталями 109,5о. Такая геометрия обеспечивает (3) минимальное отталкивание между ними.

|
|
2sp3-орбиталь, большая доля образует -связи |
Завершим картину построения молекулы метана: каждая из четырех sp3-орбиталей атома углерода перекрывается с 1s-орбиталью атома водорода. Образуются четыре -связи.
|
| ||||
|
sp3‑гибридное состояние атома углерода |
|
молекула метана имеет четыре -связи |
|
изображение метана с помощью клиновидной проекции |
Для максимального перекрывания sp3-орбиталей углерода и 1s-орбиталей водорода четыре водородных атома должны лежать на осях sр3-орбиталей. Следовательно, угол между двумя любыми связями С–Н равен 109,5о.
Экспериментальные данные подтверждают расчет: метан имеет тетраэдрическую структуру. Все связи углерод-водород имеют одинаковую длину 10,9·10-2 нм, угол между двумя любыми связями тетраэдрический и равен 109,5о. Для разрыва одной из связей в метане требуется 427·103 Дж/моль.
1.3. Строение этана
Построение следующего гомолога ряда алканов - этана H3C–CH3 произведем аналогичным образом. Как и в случае с метаном, С–Н связи возникают благодаря перекрыванию sp3-орбиталей атома углерода с 1s-орбиталями атомов водорода, связь углерод-углерод образуется в результате перекрывания двух sp3-орбиталей атомов углерода.

В молекуле этана содержится шесть -связей углерод-водород и одна -связь углерод-углерод. -Связи имеют цилиндрическую симметрию. Ось симметрии электронного облака -связи - линия, соединяющая атомы. Электронное облако углерод-углеродной -связи, обладающее цилиндрической симметрией, можно изобразить следующим образом:

1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
В молекуле этана поворот одной метильной группы относительно другой происходит почти свободно.
|
|
Различные расположения групп и атомов в пространстве, возникающие в результате поворота одного атома относительно другого вдоль линии связи, соединяющей эти атомы, называются конформациями. | ||
|---|---|---|---|
|
|
|
| |
|
|
|
| |
|
Заслоненная конформация этана (I) |
Заторможенная конформация этана (II) |
| |
Однако вращение одной метильной группы относительно другой не совсем свободно. Потенциальная энергия молекулы минимальна для заторможенной конформации II, при вращении метильной группы она возрастает и достигает максимума для заслонённой конформации I. Избыток энергии заслонённой конформации по сравнению с заторможенной называют энергией торсионного напряжения. Для молекулы этана эта энергия равна 13·103 Дж/моль (рис. 1.1).
Считают, что избыток энергии появляется вследствие отталкивания электронных облаков углерод-водородных связей в тот момент, когда они проходят мимо друг друга. Поскольку при комнатной температуре энергия некоторых столкновений молекул может достигать 86·103 Дж/моль, то барьер в 13·103 Дж/моль легко преодолевается. Вращение в этане рассматривают как свободное.

Рис. 1.1. Энергетический профиль вращения групп CH3 в молекуле этана вокруг связи углерод-углерод
Конформации, соответствующие энергетическим минимумам, называют конформационными изомерами или конформерами. В более сложных молекулах число конформеров может быть достаточно большим.






