
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
Хлорирования метана

Рис. 1.4. Энергетическая диаграмма стадий роста цепи в реакции
Бромирования метана
Существует общее правило:
-
в свободнорадикальных реакциях углеводородов энергия активации уменьшается с увеличением экзотермичности.
Какая же из двух реакций роста цепи, следующих одна за другой, - (2) или (3) - протекает медленнее? Очевидно, реакция (2) с высокой энергией активации протекает труднее. В реакции (3) метильный радикал легко реагирует с молекулой брома или хлора. В дальнейшем мы будем руководствоваться следующим правилом:
-
в свободнорадикальном процессе реакция образования свободного алкильного радикала является самой медленной, скоростьопределяющей стадией процесса.
1.6.5. Причина различной реакционной способности галогенов
В реакциях, протекающих по одинаковому механизму, таких как хлорирование и бромирование метана, частота столкновений и фактор вероятности (число столкновений молекул, имеющих необходимую ориентацию) почти одинаковы и не могут вызвать заметного различия в скорости реакции. Неодинаковая реакционная способность галогенов по отношению к метану обусловлена различием энергий активаций медленных скоростьопределяющих реакций (2).

Рис. 1.5. Изменение потенциальной энергии в ходе медленной
стадии CH4+Hal
Сравните энергии активации и тепловые эффекты медленных реакций в процессах хлорирования и бромирования. В реакциях (2) при бромировании и хлорировании метана происходит разрыв одной и той же связи Н3С–Н, а образуются разные связи галоген–водород (H–Br или Н–СI). Следовательно, различие в значениях тепловых эффектов Н обусловлено различием в энергиях связей галоген-водород (рис. 1.5). Реакционная способность галогена по отношению к метану зависит от энергии связи галоген-водород.
При фторировании углеводородов выделяется так много тепла, что эта реакция с трудом поддается контролю, образуются продукты разрыва связей С–Н, С–С.
Таблица 1.2
Зависимость реакционной способности галогенов от энергии связи h–Hal
|
Энергия связи H–Hal, кДж/моль |
H–F 560 |
|
H–Cl 431 |
|
H–Br 364 |
|
H–I 297 |
|
Реакционная способность |
F2 |
> |
Cl2 |
> |
Br2 |
> |
(I2) не реагирует |
1.6.6. Галогенирование высших алканов. Механизм
Галогенирование алканов протекает по такому же механизму, как и галогенирование метана.
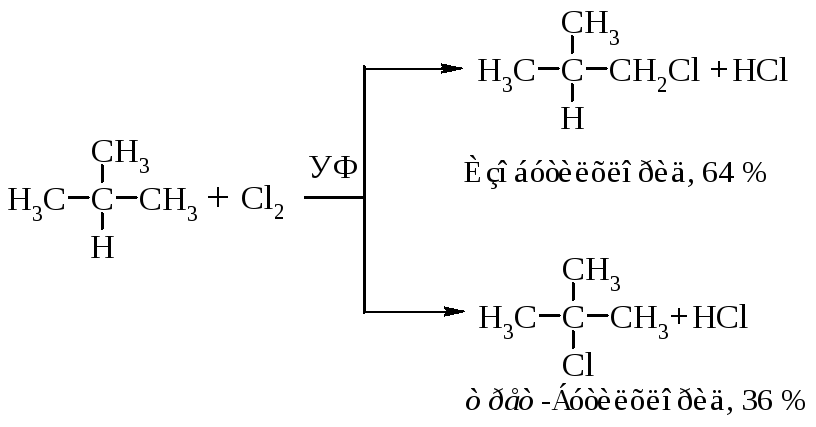
Рассмотрим механизм хлорирования изобутана.

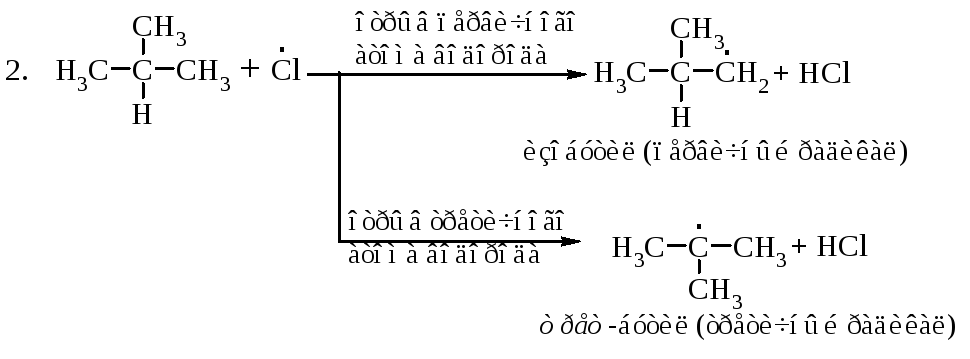
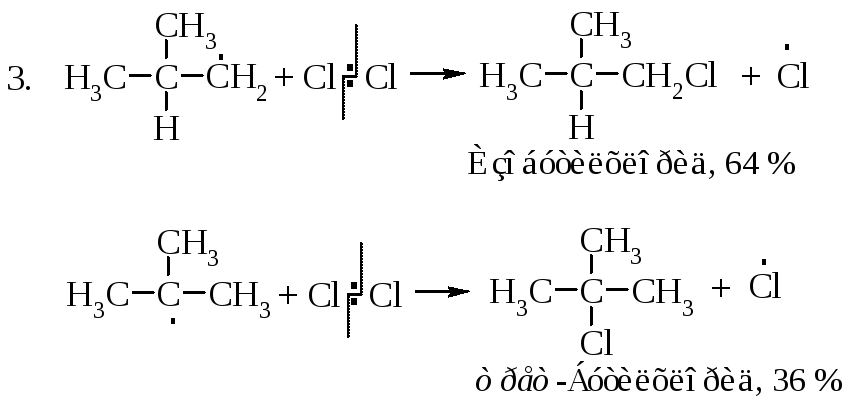
Затем (2), (3), (2), (3)... до обрыва цепи. Стадии обрыва цепи напишите самостоятельно.
Бромирование изобутана приводит к соответствующим бромидам, но в другом соотношении.

Объясните, почему для реакции бромирования необходима более высокая температура.
1.6.7. Медленная стадия. Энергетическая диаграмма
Медленной реакцией, определяющей скорость галогенирования алканов, является реакция образования алкильных радикалов (реакция 2). Какие факторы определяют скорости образования первичного и третичного радикалов?
Частота столкновений атома галогена с молекулой изобутана одна и та же для обоих превращений. Фактор вероятности будет различным. Для отрыва первичного атома водорода молекула изобутана должна быть ориентирована так, чтобы атом галогена сталкивался с первичным атомом водорода, а для отрыва третичного - удар галогена должен быть направлен на третичный атом водорода. В молекуле изобутана девять первичных и только один третичный. Если бы все атомы водорода обладали одинаковой реакционной способностью по отношению к атому галогена, то первичные атомы реагировали бы в девять раз чаще, чем третичные. Фактор вероятности благоприятствует образованию изобутилхлорида и третбутилхлорида в соотношении 9:1. Экспериментальные данные дают соотношение 1,8:1 или 9:5. Это означает, что результативных столкновений атомов хлора с третичным атомом водорода в пять раз больше, чем с первичным. Следовательно, энергия активации для отщепления третичного атома меньше, чем для отщепления первичного.
Образование третичного радикала более экзотермично, протекает с меньшей энергией активации. Это связано с меньшей затратой энергии на разрыв третичной связи C–H по сравнению с первичной связью C–H.

Рис. 1.6. Энергетическая диаграмма медленной стадии хлорирования изобутана
Сравнение количества изомеров, образующихся при хлорировании н-бутана - 1-хлорбутана (28 %) и 2-хлорбутана (72 %) - приводит нас аналогичным образом к выводу о том, что энергия активации реакции отщепления вторичного атома водорода меньше, чем энергия активации отщепления первичного. Реакция образования вторичного радикала более экзотермична, чем реакция образования первичного радикала:
![]()
Следовательно, относительная легкость отщепления атомов водорода такова: третичный > вторичный > первичный > Н–СН3.
-
Ряд легкости образования радикалов: третичный > вторичный > первичный > Н3С
Необходимо подчеркнуть, что легкость отщепления, т.е. реакционная способность атома водорода, зависит не от того, в каком алкане он находится, а от того, является ли он первичным, вторичным, третичным.
В таблице 1.3 приведены энергии разрыва связей С–Н в алканах. Они являются постоянными для ряда алканов и не зависят от того, в каком конкретном соединении находятся эти связи.
Таблица 1.3
Энергии разрыва связей С–Н в алканах
-
Тип связи
Энергия связи,
кДж/моль

427
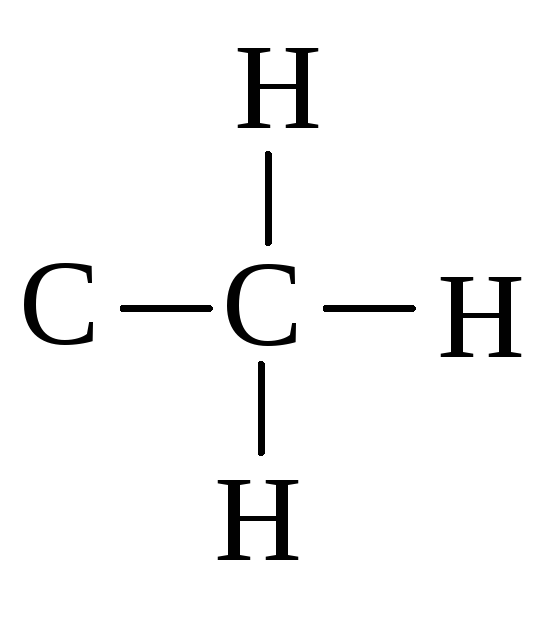 первичная
первичная406
 вторичная
вторичная394
 третичная
третичная381
Данные табл. 1.3 показывают, что для образования радикала Н3С требуется больше энергии, чем для образования первичного радикала Н3С-СН2. Следовательно, радикал метил Н3С содержит больше энергии по сравнению с метаном, чем радикал этил СН3–СН2 по сравнению с этаном. Это означает, что радикал Н3С менее устойчив, чем первичный радикал СН3-СН2. Сравнивая энергии разрыва –С–Н связей, приведенные в табл. 1.3, выводим следующий ряд устойчивости радикалов.
-
Ряд устойчивости радикалов:
третичный > вторичный > первичный > СН3.
Порядок уменьшения устойчивости радикалов соответствует порядку уменьшения легкости их образования.
-
Чем устойчивее радикал, тем легче он образуется.
Устойчивость радикалов определяет реакционную способность алканов, а также ориентацию, т.е. направление преимущественной атаки галогена и состав продуктов реакции.
Таким образом, реакции хлорирования и бромирования протекают региоселективно.
-
Региоселективными называются такие реакции, в ходе которых различные положения в молекуле подвергаются химическим превращениям с различными скоростями.
