- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
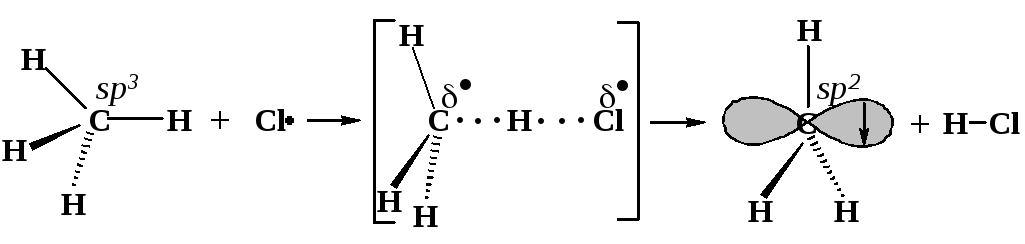
1.6.2. Строение метильного радикала
Метильный радикал построен следующим образом. Свободный атом углерода имеет четыре валентных электрона. Если три из четырех электронов образуют электронные пары трёх -связей с тремя атомами водорода, то образуется семиэлектронная оболочка атома углерода метильного радикала:
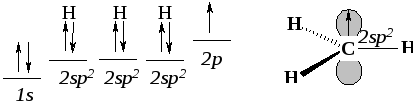
Один из электронов атома углерода оказывается неспаренным. В свободном радикале он занимает р-орбиталь. Трехвалентный углерод метильного радикала находится в sр2-гибридном состоянии. Три -связи располагаются в одной плоскости, перпендикулярной оси р()-орбитали, и образуют углы 120о .
1.6.3. Расчет изменения энергии в ходе реакции
Взаимодействие метана с другими галогенами протекает по такому же механизму. Легкость взаимодействия (реакционная способность) убывает в следующем ряду: F2 > CI2 > Вr2 > I2. Иодирование алканов практически неосуществимо.
Что значит сравнить реакционную способность реагентов по отношению к одному и тому же органическому соединению? Если мы говорим, что хлор более реакционноспособен, чем бром по отношению к метану, то это означает следующее: скорость взаимодействия хлора с метаном больше, чем скорость взаимодействия брома с метаном в одинаковых условиях (концентрация реагентов, температура).
От чего зависит скорость, а следовательно, реакционная способность? Для того чтобы ответить на этот вопрос, рассмотрим подробнее, как протекают реакции (2) и (3), в ходе которых образуется продукт – хлорметан.
В свободнорадикальных процессах, протекающих без участия заряженных частиц, фактором, определяющим легкость протекания реакции, является различие в энергии разрываемых и образующихся связей. В стадии продолжения цепи (реакция 2) расходуется 427·103 Дж/моль на разрыв связи С–Н в метане, и выделяется 431·103 Дж/моль при образовании молекулы H–CI
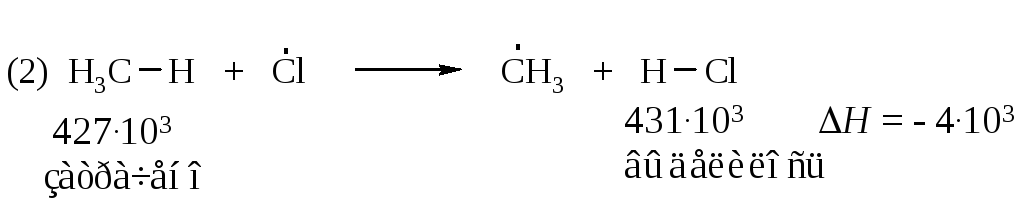
Следовательно, реакция (2) слабо экзотермична. Она протекает с тепловым эффектом минус 4·103 Дж/моль.
В третьей стадии на разрыв связи CI–CI требуется затратить 243·103 Дж/моль. Выделяющаяся при образовании связи C–CI энергия составляет 339·103 Дж/моль. Тепловой эффект реакции равен минус 96·103 Дж/моль
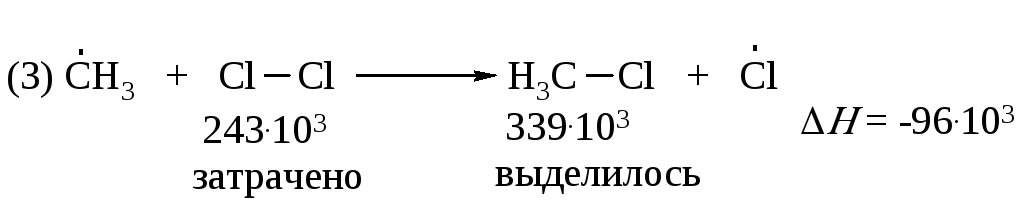
Таким образом, реакция (3) более экзотермична, чем реакция (2).
Проведем подобный расчет для реакций продолжения цепи (2) и (3) бромирования метана:
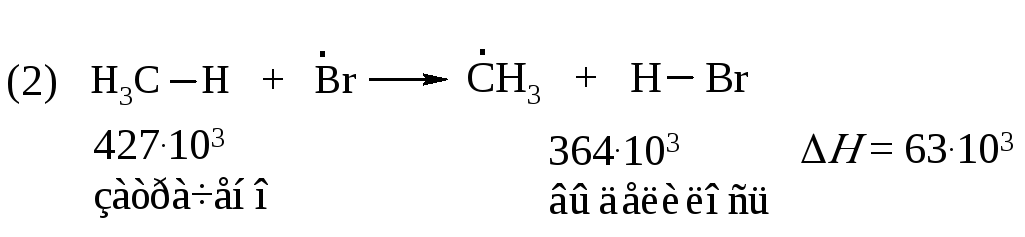
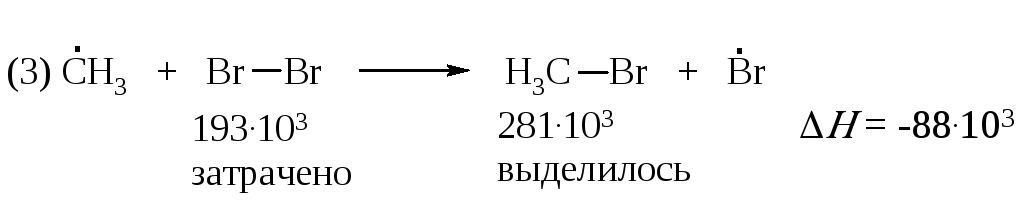
Реакция (2) является эндотермической, а реакция (3) - экзотермической, т.е. протекает с выделением тепла. Экзотермическая реакция протекает достаточно быстро, в то время как эндотермическая - очень медленно.
1.6.4. Энергетическая диаграмма реакции. Связь энергии
активации с экзотермичностью. Медленная стадия
Что необходимо для того, чтобы произошла реакция? Рассмотрим это на примере взаимодействия атома хлора с метаном. Во-первых, молекула метана и атом хлора должны столкнуться. Во-вторых, столкнувшиеся частицы должны обладать необходимой для реакции энергией. Если кинетическая энергия этих частиц мала, при соударении они просто отталкиваются друг от друга. Минимальное количество энергии, необходимое для того, чтобы осуществилось превращение, называется энергией активации. В-третьих, в момент столкновения молекула метана и атом хлора должны быть ориентированы определенным образом (фактор вероятности).
Рассмотрим ход этой реакции. Частицы CI и СН4 движутся и обладают некоторой кинетической энергией. Они сталкиваются, и кинетическая энергия превращается в потенциальную. Если в потенциальную энергию превращается достаточное для реакции количество кинетической энергии, начинается перестройка электронных оболочек частиц - достигается переходное состояние: связь углерод-водород растянута, но еще не разорвана, а связь водород-хлор начала образовываться, но еще не образовалась. В результате реакции образуются частицы СН3 и НСl. Их потенциальная энергия быстро превращается в кинетическую, они разлетаются в разные стороны. Тепло отдается окружающему пространству.
|
| ||
|
тетраэдрический атом углерода |
углерод становится почти плоским |
плоский метильный радикал |
|
ИСХОДНЫЕ СОЕДИНЕНИЯ |
ПЕРЕХОДНОЕ СОСТОЯНИЕ неспаренный электрон одновременно принадлежит атомам хлора и углерода |
КОНЕЧНЫЕ ПРОДУКТЫ |
На рисунках 1.3 и 1.4 показано изменение потенциальной энергии в стадиях роста цепи реакций хлорирования и бромирования метана. Реакции (2) соответствует левая ветвь энергетической диаграммы, реакции (3) - правая ветвь. Свободная энергия переходного состояния соответствует вершине энергетического барьера.
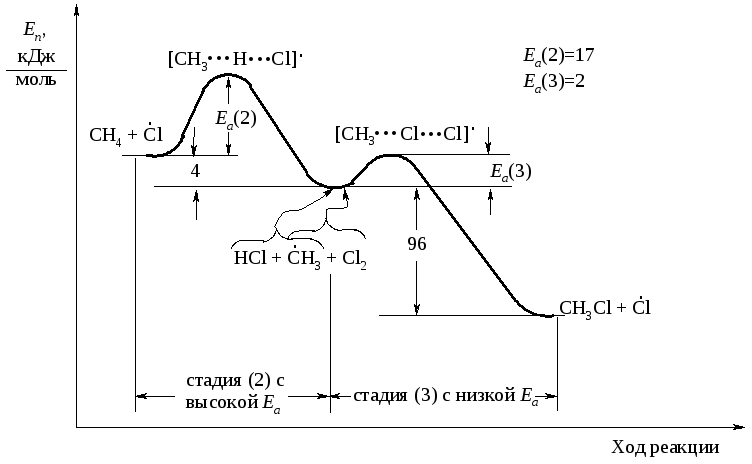
Рис. 1.3. Энергетическая диаграмма стадий роста цепи в реакции