- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
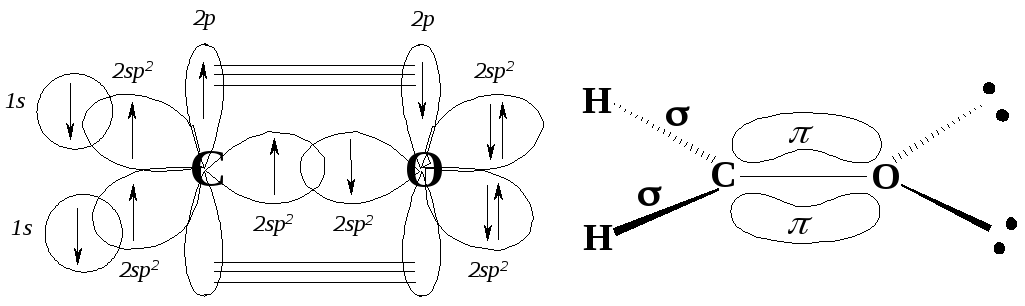
4.2. Строение этена
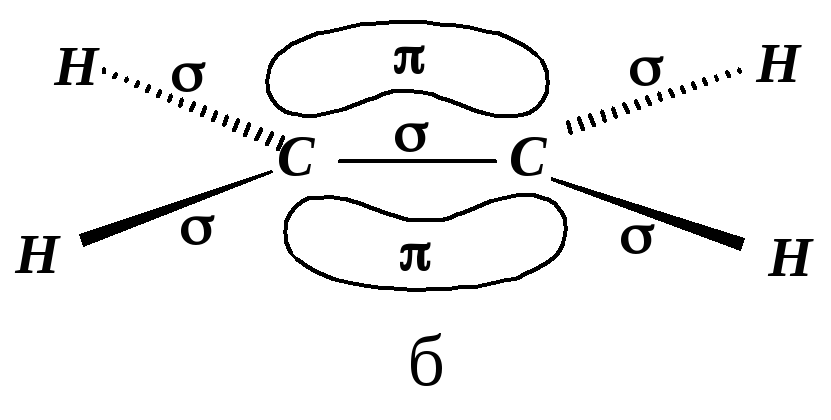
Простейший представитель алкенов – этен (этилен) СН2=СН2. Атомы углерода в молекуле этена находятся в sp2-гибридном состоянии. Изобразим подробную орбитальную конфигурацию этилена на рис. 4.1.
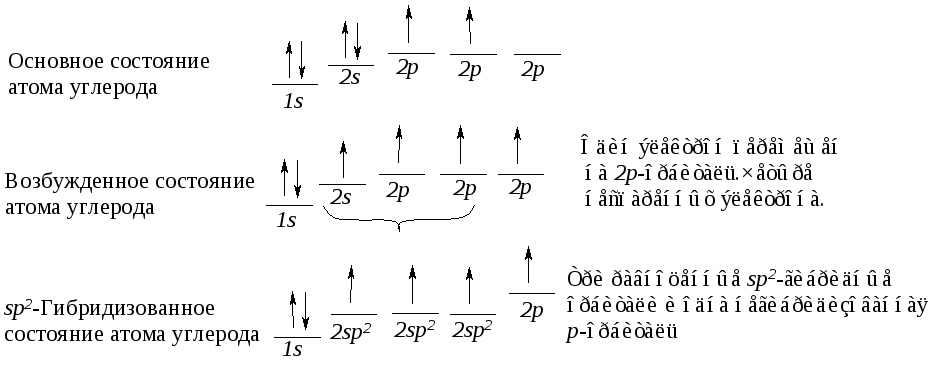
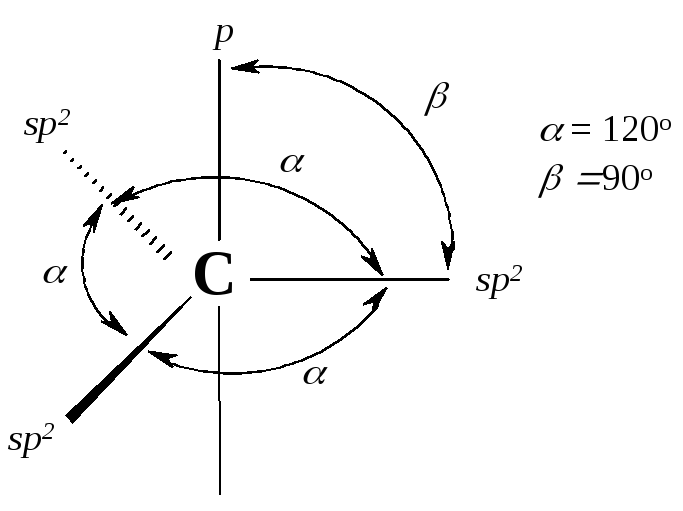
Рис. 4.1. Направления и формы орбиталей sp2-гибридизованного атома углерода:
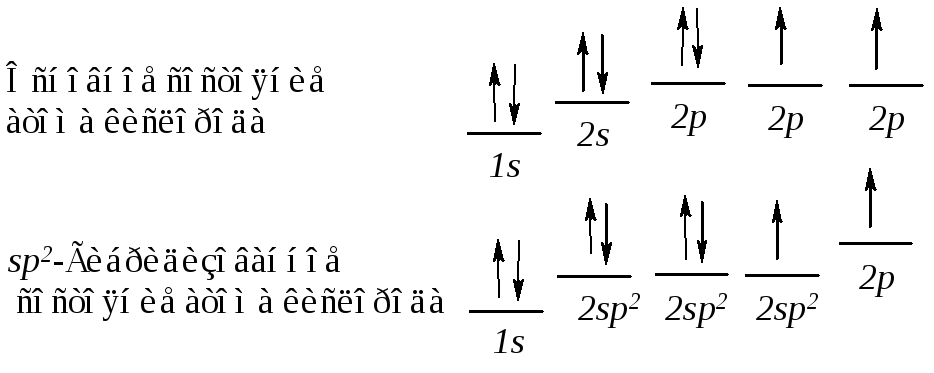
Гибридизованные орбитали (1) эквивалентны, (2) - имеют большую направленность в пространстве, (3) - максимально удалены друг от друга, атом углерода в состоянии sp2-гибридизации называется тригональным атомом углерода.
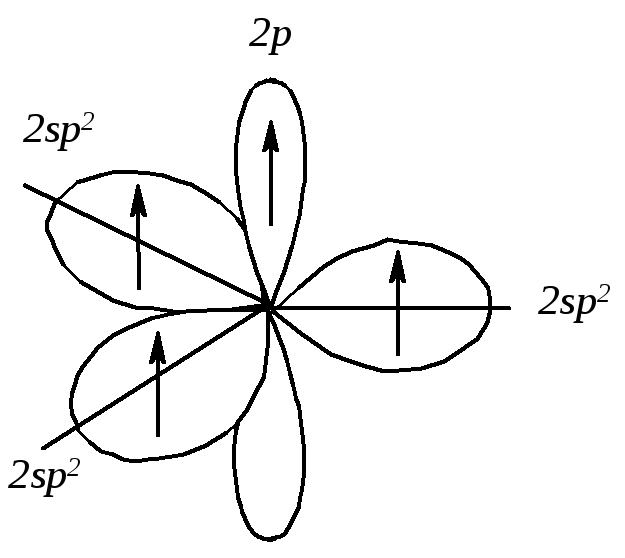
В результате гибридизации одной 2s-орбитали и двух 2р-орбиталей (из трех) образуются три эквивалентные гибридизованные sp2-орбитали и остается одна негибридизованная 2р-орбиталь. Гибридизованные орбитали имеют гораздо большую направленность, чем 2s- или 2р-орбиталь. Вследствие большего перекрывания с орбиталями других атомов эти гибридные орбитали образуют более прочные связи. sp2-Гибридизованные орбитали расположены в одной плоскости и направлены к углам правильного треугольника, угол между осями sp2-гибридизованных орбиталей составляет 120º. При таком тригональном расположении гибридные орбитали максимально удалены друг от друга.
|
|
|
Рис. 4.2. Схема формирования sp2-гибридизованных орбиталей атома углерода
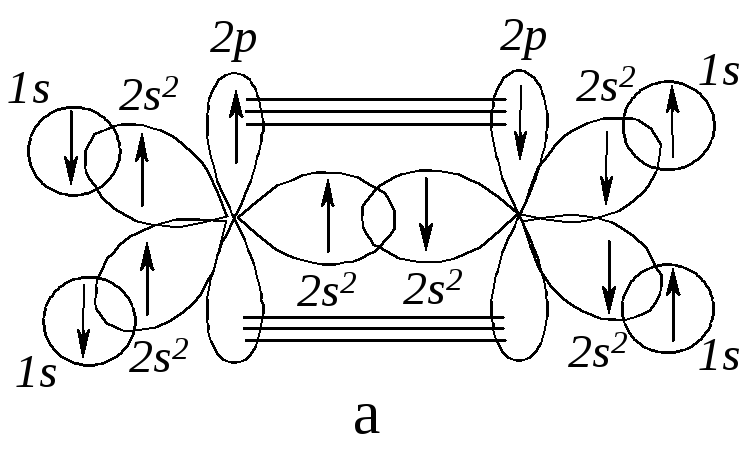
Если мы соединим два sp2-гибридных атома углерода, то получим две углерод-углеродные связи: одну -связь, образованную перекрыванием двух sp2-орбиталей, и одну -связь, образованную перекрыванием двух 2р-орбиталей. Построение молекулы этена заканчиваем добавлением атомов водорода, валентные электроны которых (1s) взаимодействуют с оставшимися sp2-гибридными орбиталями углеродных атомов.
Рис. 4.3. Молекула этена:
а - боковое перекрывание 2р-орбиталей (-перекрывание);
б - -связь состоит из двух электронных облаков, одно из которых лежит над, а другое – под плоскостью молекулы
Таким образом, двойная углерод-углеродная связь построена из более прочной -связи (347 кДж/моль) и менее прочной -связи (260 кДж/моль). -Связь делает невозможным вращение одного атома углерода относительно другого вдоль связи углерод-углерод. С этим связано явление геометрической изомерии.
Двойная углерод-углеродная связь в этене короче, чем простая связь в этане.
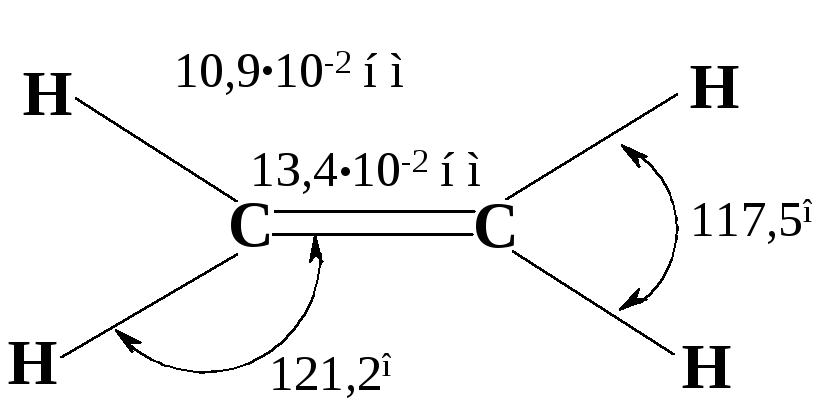
Рис. 4.4. Геометрические параметры молекулы этена
Спектральные исследования показали, что расстояние С–Н в этилене равно 10,9·10-2 нм, что несколько меньше, чем расстояние С–Н в этане (11,02·10-2 нм). Для объяснения такого различия необходимо принять во внимание, что гибридизация атомов углерода в этих соединениях неодинакова. Связь углерод-водород в этене образована в результате перекрывания 1s-орбитали водорода с sp2- , а не sp3-гибридной орбиталью углерода, как в этане. По сравнению с sp3- орбиталью sp2-орбиталь имеет меньшую долю p-орбитали и большую долю s-орбитали. p-Орбиталь находится на большем расстоянии от ядра, чем s-орбиталь. По мере возрастания s-характера гибридной орбитали её эффективный размер уменьшается и одновременно уменьшается длина связи с другим атомом. Поэтому связь водорода с sp2-гибридизованным атомом углерода (sp2-1s) должна быть короче, чем с sp3-гибридизованным (sp3-1s).
Более короткие связи будут более прочными; энергия диссоциации связи С—Н в этилене (435 кДж/моль) больше, чем в этане (405 кДж/моль). Рассмотрение гибридизации и размеров орбиталей позволяет предположить, что sp2- sp3 -связь должна быть короче, чем sp3 - sp3-связь. Сравните:
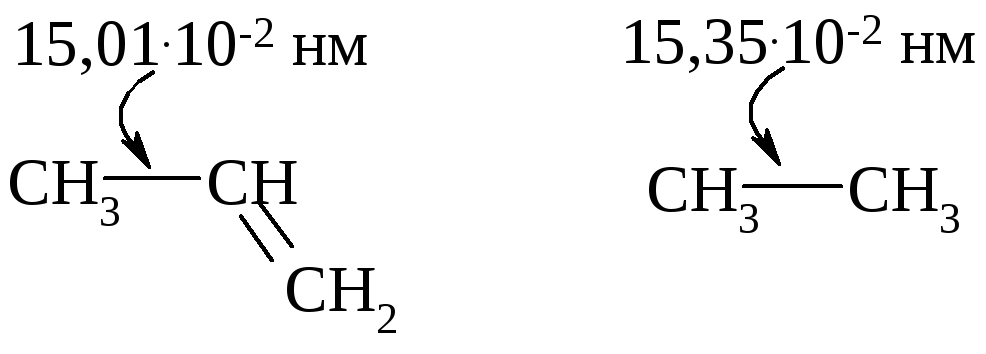
Рассмотрение гибридизации и размеров орбиталей помогает объяснить некоторые свойства молекул, например, относительную кислотность углеводородов. Чем больше доля s-состояния в гибридной орбитали атома углерода, тем более электроотрицательным он будет. Электроотрицательность атомов углерода уменьшается в следующем порядке:
Сsp > Сsp2 > Сsp3
Общая электронная пара связи С–Н частично смещена к углероду даже в алкане с sp3-гибридными орбиталями углерода, дипольный момент связи равен 0,3 D. В алкене электронная пара связи =С–Н должна быть ещё больше сдвинута к ядру атома углерода вследствие sp2-гибридного состояния его орбиталей. Поэтому =С–Н связь в этилене более полярна, чем в алканах, с большим положительным зарядом на атоме водорода; дипольный момент связи =С–Н равен 0,6 D.
sp2-Гибридизованный атом углерода может образовывать двойную связь с любым элементом, способным существовать с частично заполненными p- и sp2-орбиталями. Например, кислород предоставляет необходимые для такой связи орбитали путём следующей гибридизации:
Простейшим промером такого состояния кислорода является формальдегид Н2С=О: