
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •1.7.3. Гидрирование галогеналканов
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •4.5. Способы получения алкенов
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •11.3. Методы синтеза галогеналканов
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды.
1.6.15. Термическое разложение алканов, крекинг
При температуре 500 – 700 оС алканы распадаются с образованием углеводоров с меньшей молекулярной массой, содержащих насы-
щенные и ненасыщенные соединения. При этом разрываются C–C-связи, а не C–H-связи, т.к. энергия разрыва последних значительно выше. Гомолиз ковалентной связи (реакция 1) приводит к образованию двух свободных радикалов, которые дальше могут реагировать по-разному. Например, радикал может оторвать атом водорода от молекулы алкана с образованием алкана меньшего размера и нового радикала (реакция 2). Вновь образовавшийся радикал может расщепиться на меньший радикал и алкен (реакция 3).
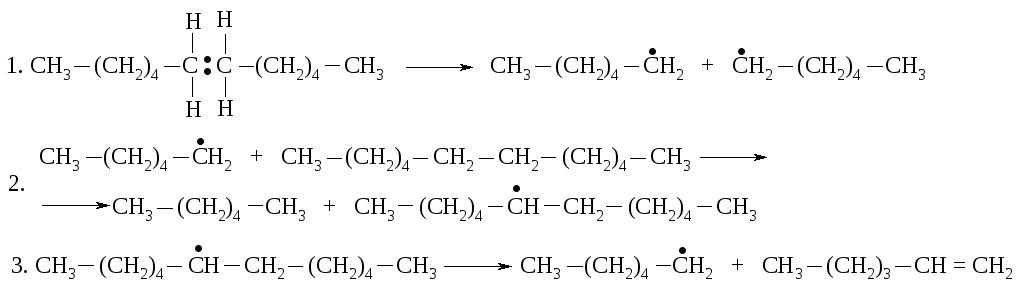
В результате подобных реакций большие молекулы превращаются в смесь алканов и алкенов меньшей молекулярной массы.
1.6.16. Ионные реакции алканов
Наиболее характерными реакциями алканов являются реакции радикального замещения, однако в определенных условиях могут осуществляться реакции с электрофильными реагентами: протоном H+, карбокатионами CH3+ и др., ионом нитрония NO2+.
Алканы реагируют с протоном суперкислот, из которых чаще всего используют фторсульфоновую кислоту FSO2OH в смеси с кислотой Льюиса SbF5 в среде жидкого SO2 или SO2ClF.
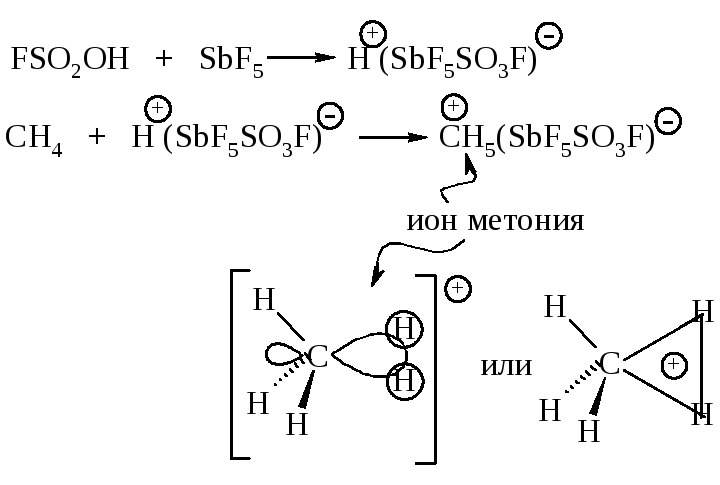
Электрофильное алкилирование осуществляется при взаимодействии алканов с соединениями, содержащими карбокатионы.
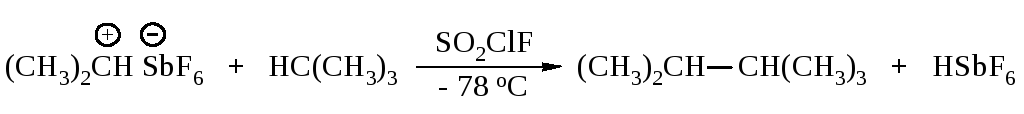
1.7. Методы синтеза алканов
Алканы можно получать в практически неограниченном количестве из природного газа и нефти. Однако выделение индивидуальных углеводородов с увеличением в них числа атомов углерода является трудной задачей, так как при этом резко возрастает число изомерных соединений и одновременно уменьшаются различия в их физических свойствах. Поэтому для получения индивидуальных углеводородов используются синтетические методы.
1.7.1. Гидрирование алкенов и алкинов
Ненасыщенные углеводороды (алкены, алкины, углеводороды с несколькими кратными связями) могут быть превращены в алканы путём каталитического гидрирования. В качестве катализатора используются мелкодисперсные платина, палладий или никель. Такие катализаторы активируют как водород, так и алкен.

1.7.2. Реакция Вюрца
При взаимодействии первичных галогеналканов с металлическим натрием образуются алканы с удвоенным числом атомов углерода. Эта реакция пригодна, прежде всего, для получения высших алканов симметричного строения.
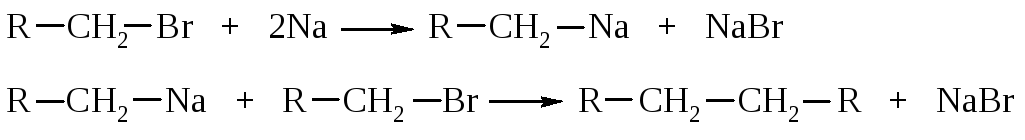
Реакционная способность галогеналканов уменьшается в ряду: R–I > R–Br > R–Cl.
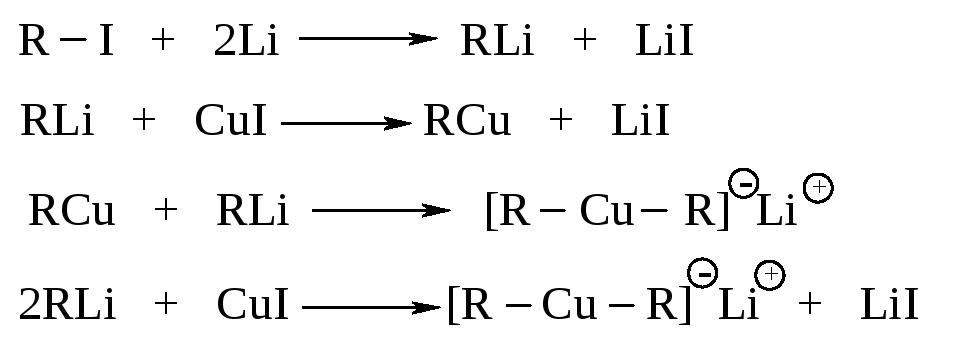
Алканы строения R–R' можно получить, используя несколько изменённую реакцию Вюрца: взаимодействие диалкилкупрата лития LiR2Cu с алкилгалогенидом R'I. Наибольшие выходы получаются, когда алкильная группа диалкилкупрата первичная или вторичная, а алкильная группа алкилгалогенида - первичная.
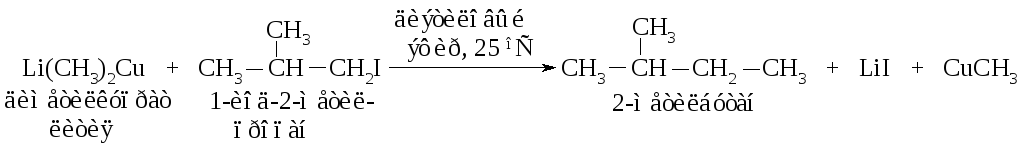
Диалкилкупраты получают двухстадийным способом, реакции ведутся в среде абсолютного диэтилового эфира.
1.7.3. Гидрирование галогеналканов
При каталитическом гидрировании галогеналканов в присутствии палладия образуются алканы.
![]()
Для восстановления галогеналканов можно использовать также цинк в соляной кислоте и натрий в спирте. Иодалканы могут быть восстановлены нагреванием в запаянной ампуле с иодоводородом.
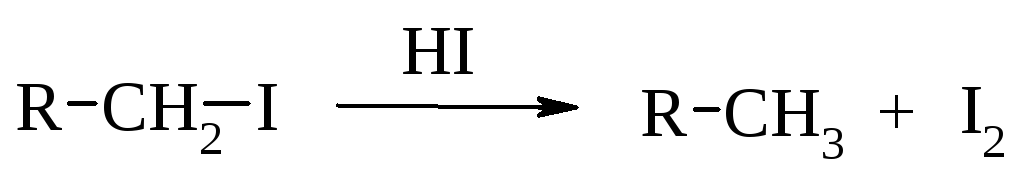
1.7.4. Декарбоксилирование карбоновых кислот
При нагревании солей карбоновых кислот и щелочных или щелочноземельных металлов с гидроксидами натрия или бария происходит отщепление СО2 и образуется алкан.
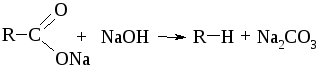
Однозначно эта реакция протекает только для ацетата натрия, в случае других солей образуются побочные продукты.
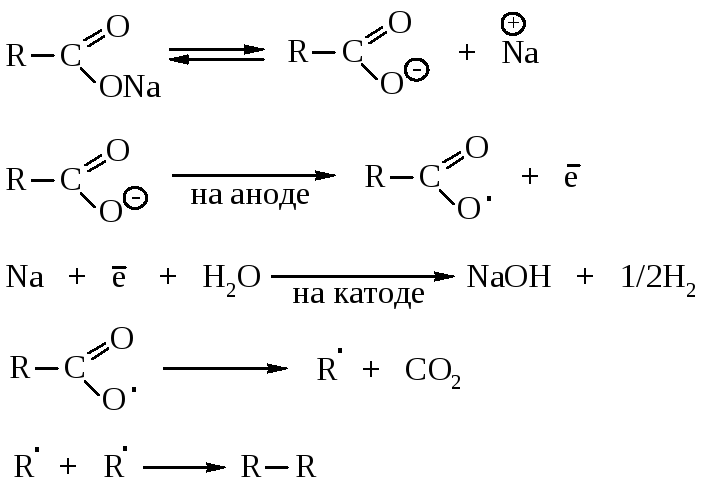
1.7.5. Синтез Кольбе
При электролизе натриевых и калиевых солей карбоновых кислот образуются углеводороды симметричного строения.
![]()
На первой стадии происходит анодное окисление анионов кислот до радикалов RСОО, которые отщепляют СО2, а затем димеризуются. На катоде образуется водород и гидроксид щелочного металла.
1.7.6. Метод Фишера-Тропша
Каталитическое гидрирование окиси углерода протекает в присутствии катализатора, содержащего кобальт или железо, с образованием смеси алканов с небольшой молекулярной массой.
![]()
2. СТЕРЕОИЗОМЕРИЯ. ЭНАНТИОМЕРИЯ
2.1. Энантиомеры. Хиральность. Условия хиральности
![]()
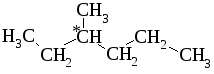
Наряду со структурными изомерами в ряду алканов существуют пространственные изомеры. Это можно представить на примере 3-метилгексана.
Атом углерода, обозначенный С*, соединён с четырьмя разными группами. В этом углеводороде при одном и том же порядке связывания атомов алкильные группы могут быть по-разному расположены в пространстве около атома углерода С*. Существует несколько способов изображения пространственных изомеров на плоскости (рис. 2.1, 2.2).
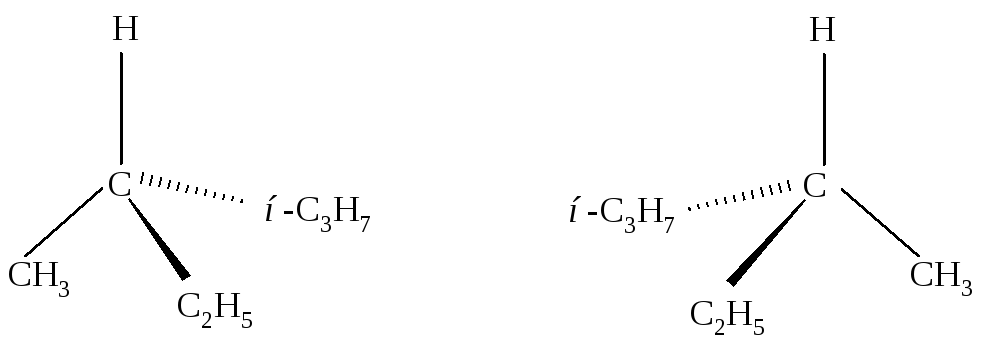
Рис. 2.1. Объемное изображение с помощью «клиньев»
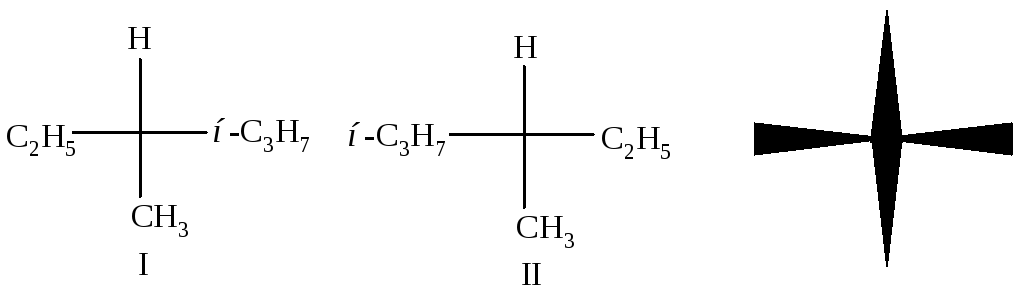
Рис. 2.2. Проекционные формулы Фишера
На рисунке 2.2 в центре находится атом углерода С*, горизонтальной линией обозначена связь между углеродом С* и группами, выступающими перед плоскостью рисунка, а вертикальной - между атомом С* и группами, расположенными за плоскостью рисунка. Проекции Фишера можно поворачивать только в плоскости рисунка и только на 180о, но не на 90о или 270о. Этими формулами изображены два различных соединения. Они отличаются друг от друга так же, как предмет и его зеркальное изображение или как левая и правая рука. Левая и правая руки - два очень похожих друг на друга предмета, но совместить их невозможно (не надеть левую перчатку на правую руку), значит - это два разных объекта.
-
Два соединения: предмет и его зеркальное изображение (I и II), несовместимые друг с другом, называются энантиомерами (от греческого “энантио” - противоположный).
-
Свойство соединения существовать в виде энантиомеров называется хиральностью (от греческого “хирос” - рука), а само соединение - хиральным.
Молекула обладает хиральностью, если она не имеет плоскости симметрии. Существует ряд элементов структуры, которые могут сделать молекулу не идентичной своему зеркальному изображению. Наиболее важным из них является хиральный атом углерода.
-
Хиральный атом или хиральный центр - это атом углерода, связанный с четырьмя различными группами и обозначае-мый С*.
Молекула 2-метилгексана не имеет плоскости симметрии и поэтому может существовать в виде энантиомеров (см. рис. 2.1).
Молекула, в которой при атоме углерода находятся две или более одинаковых групп, имеет плоскость симметрии и, следовательно, не обладает хиральностью, поскольку молекула и ее зеркальное изображение идентичны. Такие молекулы называются ахиральными.
Например, изопентан не может существовать в виде энантиомеров и не обладает хиральностью (рис. 2.3).

Рис. 2.3. Молекула изопентана ахиральна
Другой элемент структуры, который делает молекулу способной существовать в виде энантиомеров, - хиральные аллены. Молекула незамещенного аллена (пропадиена) ахиральна.
![]()
В молекуле аллена две плоскости, в которых лежат две концевые метиленовые группы CH2, взаимно перпендикулярны.
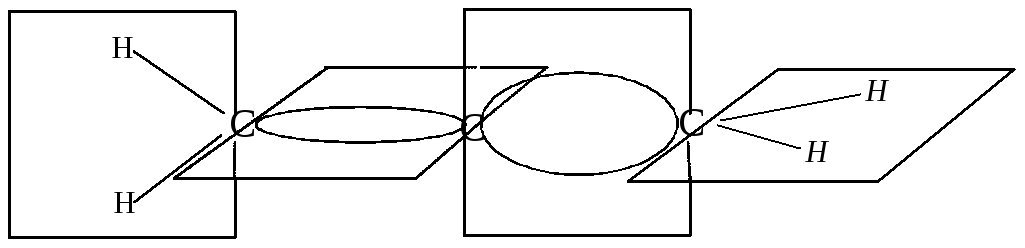
Вследствие этого замещенные аллены типа XYC=C=CXY не имеют плоскости симметрии и могут существовать в виде энантиомеров.
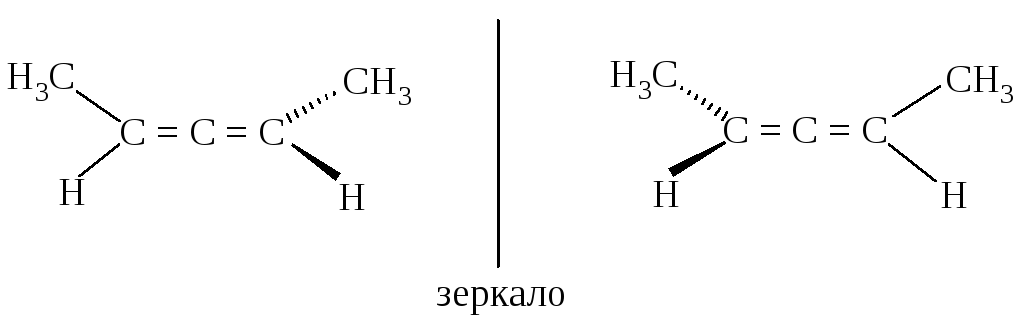
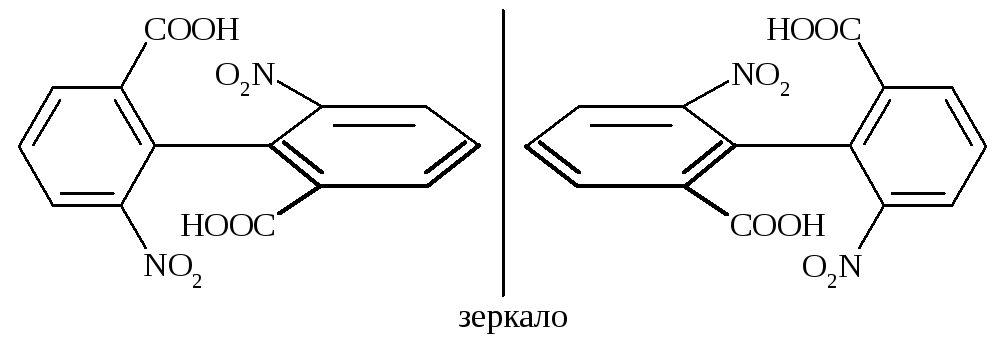
Еще одним примером могут быть производные бифенила, в которых заместители в орто-положениях достаточно велики для того, чтобы свободное вращение оказалось невозможным. Они могут существовать в виде энантиомеров, несмотря на отсутствие хиральных атомов. Такой вид изомерии называется атропоизомерией.
Не всегда соединения, не имеющие плоскости симметрии, обладают хиральностью и могут быть разделены на энантиомеры. Например, в метилэтиламине CH3(C2H5)NH азот имеет четыре разных заместителя: H, CH3, C2H5 и неподеленную пару электронов, которые лежат в вершинах тетраэдра.
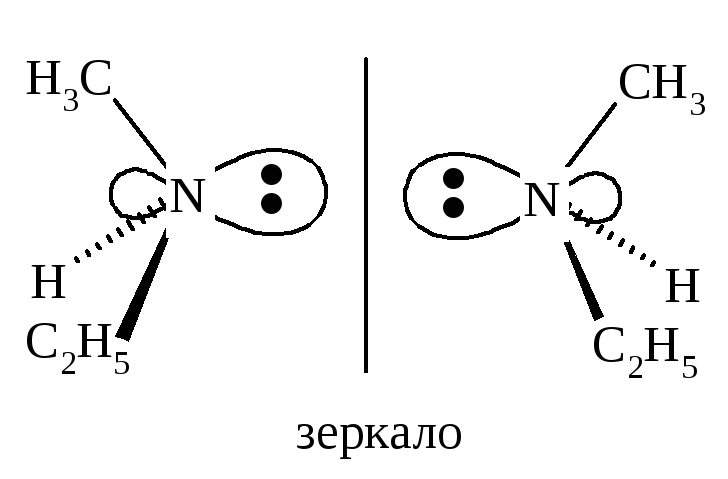
Казалось бы, такое соединение должно существовать в виде энантиомеров и проявлять оптическую активность. Однако невозможность расщепить этот амин на энантиомеры вызвана конфигурационной нестабильностью метилэтиламина, один энантиомер быстро превращается в другой.
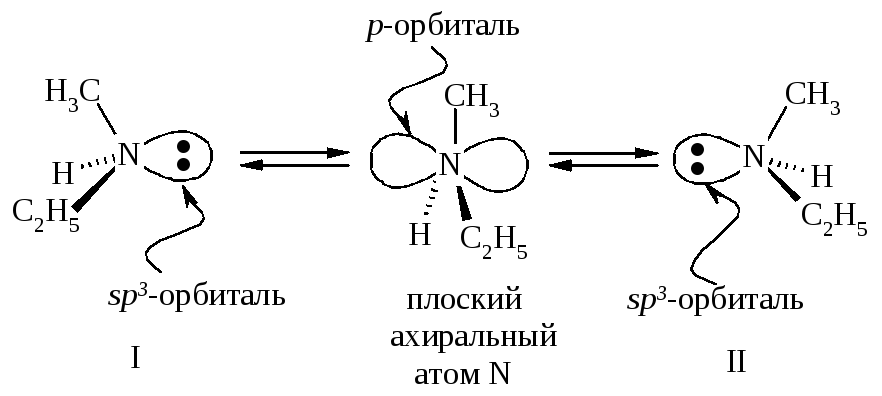
Инверсия пирамиды метилэтиламина I → II и II → I осуществляется через плоский ахиральный атом азота. Значит, метилэтиламин состоит из эквимолекулярной смеси энантиомеров, поэтому не разделяется на индивидуальные энантиомеры и не проявляет оптической активности.
Если же в этом амине за счет неподеленной пары электронов образуется связь, которая не позволяет молекуле «выворачиваться», то частица становится конфигурационно устойчивой.
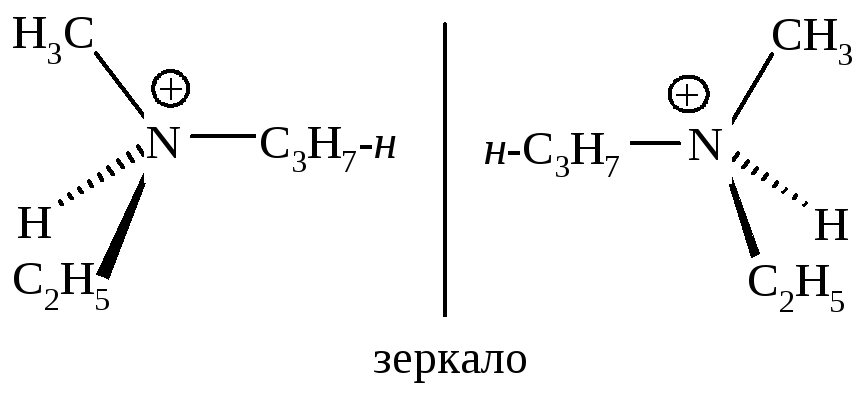
Катион метиэтилпропиламмония существует в виде энантиомеров.
Следовательно, соединения, которые не имеют плоскости симметрии, могут существовать в виде энантиомеров и проявлять оптическую активность только в том случае, когда они конфигурационно устойчивы.
Энантиомеры проявляют одинаковые физические свойства, кроме одного. Например, молекула 2-бромбутана существует в виде двух энантиомеров. Они имеют одинаковые температуры кипения, плавления, плотность, растворимость, показатели преломления. Отличить один энантиомер от другого можно по знаку вращения плоскополяризованного света. Энантиомеры вращают плоскость поляризованного света на один и тот же угол, но в разные стороны: один – по часовой стрелке, другой – на такой же угол, но против часовой стрелки.
Энантиомеры обладают одинаковыми химическими свойствами, скорость их взаимодействия с реагентами, не обладающими хиральностью, одинакова. В случае реакции с оптически активным реагентом скорости реакций энантиомеров различны. Иногда они отличаются настолько, что реакция данного реагента с одним из энантиомеров не протекает совсем.
