
- •Э.М. Нуруллаев., н.А. Вдовин
- •Оглавление
- •Введение
- •Кинематика поступательного и вращательного движения абсолютно твердого тела
- •1.1. Поступательное движение
- •1.2. Вращательное движение
- •2. Динамика поступательного движения
- •2.1. Фундаментальные взаимодействия
- •2.2. Основные характеристики динамики Ньютона
- •2.3. Закон инерции. Инерциальные системы отсчета
- •2.4. Масса и закон сохранения импульса
- •2.5. Второй закон Ньютона
- •2.6. Третий закон Ньютона и закон сохранения импульса
- •2.7. Преобразования и принцип относительности Галилея
- •2.8. Основной закон динамики поступательного движения и закон сохранения импульса для системы материальных точек
- •2.9. Некоторые силы, рассматриваемые в механике
- •2.10. Практическое применение законов Ньютона
- •2.11. Движение тела с переменной массой
- •Вопросы для самоконтроля
- •3. Динамика вращательного движения твердого тела
- •3.1. Основной закон динамики вращательного движения
- •Сумма произведений массы каждой материальной точки тела на квадрат ее расстояния до оси называется моментом инерции тела относительно этой оси. Момент инерции относительно оси Оz равен
- •3.2. Закон сохранения момента импульса
- •Вопросы для самоконтроля
- •4. Работа, мощность, энергия
- •4.1. Работа и мощность при поступательном движении
- •4.2. Работа и мощность при вращательном движении
- •4.3. Кинетическая энергия при поступательном движении
- •4.4. Кинетическая энергия вращающегося тела
- •4.5. Потенциальная энергия
- •4.6. Силы и потенциальная энергия
- •4.7. Закон сохранения энергии
- •4.8. Применение законов сохранения к соударениям тел
- •5. Колебательное движение
- •5.1. Механические колебания
- •5.2. Гармонические колебания
- •5.2.1. Кинематические характеристики гармонического колебания
- •5.2.2. Динамические характеристики гармонического колебания
- •Потенциальная энергия
- •5.3. Маятник
- •5.3.1. Математический маятник
- •5.3.2. Физический маятник
- •5.4. Сложение гармонических колебаний
- •5.4.1. Сложение колебаний одной частоты, направленных вдоль одной прямой
- •5.4.2. Биения
- •5.4.3. Сложение взаимно перпендикулярных колебаний
- •5.5. Затухающие колебания
- •Согласно формуле (5.5) период затухающих колебаний
- •5.6. Вынужденные колебания
- •6. Упругие волны
- •6.1. Волновые процессы. Продольные и поперечные волны
- •6.2. Энергия упругих волн. Вектор Умова
- •6.3. Уравнение бегущей волны. Фазовая скорость. Волновое уравнение
- •Для характеристики волн используется волновое число
- •Учитывая (6.8), уравнению (6.7) можно придать вид
- •6.4. Принцип суперпозиции. Групповая скорость
- •6.5.Интерференция волн
- •6.6. Стоячие волны
- •7. Молекулярная физика
- •7.1. Предмет молекулярной физики и термодинамики. Статистический и термодинамический методы изучения макроскопических систем
- •7.2. Основные положения молекулярно-кинетической теории
- •7.3. Газообразное состояние вещества. Идеальный газ
- •7.4. Параметры состояния идеального газа
- •7.5. Основное уравнение молекулярно-кинетической теории (уравнение Клаузиуса) и следствия из него
- •Уравнение (4) с учетом (5) примет вид
- •Произведение na равно числу молекул n, содержащихся в массе газа m. С учетом этого получим
- •А с учетом того, что число молекул в единице объема, можно записать:
- •7.6. Закон Максвелла распределения молекул идеального газа по скоростям и энергиям
- •7.8. Идеальный газ в однородном поле тяготения.
- •7.9. Число столкновений и средняя длина свободного пробега молекул
- •7.10. Явления переноса в газах
- •7.11.Реальные газы
- •7.13. Внутренняя энергия реального газа. Эффект Джоуля – Томсона
- •7.14. Элементы механики жидкостей. Давление в жидкости и газе
- •7.15. Уравнение Бернулли
- •7.16.Движение тел в жидкостях и газах
- •8. Термодинамика
- •8.1. Внутренняя энергия, работа и теплота
- •В случае идеального газа нет сил межмолекулярного взаимодействия и внутренняя энергия равна сумме энергий беспорядочного (теплового) движения всех молекул.
- •8.2. Внутренняя энергия идеального газа. Степени свободы системы
- •Внутренняя энергия произвольной массы идеального газа
- •8.3. Работа и теплота
- •8.4. Первое начало термодинамики
- •8.5. Применение первого начала термодинамики к изопроцессам в идеальном газе
- •8.6. Политропические процессы
- •8.7. Тепловые двигатели и холодильные машины. Цикл Карно и его кпд
- •8.8. Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
- •8.9. Второе начало термодинамики
- •8.10. Применение второго начала термодинамики для определения изменения энтропии в процессах идеального газа
- •8.11. Третье начало термодинамики, или теорема Нернста – Планка
- •Список литературы
Внутренняя энергия произвольной массы идеального газа
![]() ,
(8.5)
,
(8.5)
где M – масса газа; – масса одного моля газа.
Следует отметить, что внутренняя энергия идеального газа зависит только от температуры, а изменение его внутренней энергии сопровождается изменением температуры:
![]() .
(8.6)
.
(8.6)
8.3. Работа и теплота
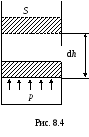
Чтобы совершить работу против силы внешнего давления, газ должен действовать на поршень с силой F, равной произведению давления газа на площадь поршня:
F = р S . (8.7)
Элементарная работа, совершаемая газом при перемещении поршня на отрезок dh,
![]() ,
(8.8)
,
(8.8)
где dV=Sdh – изменение объема газа. Работа, совершаемая при конечном изменении объема газа от V1 до V2,
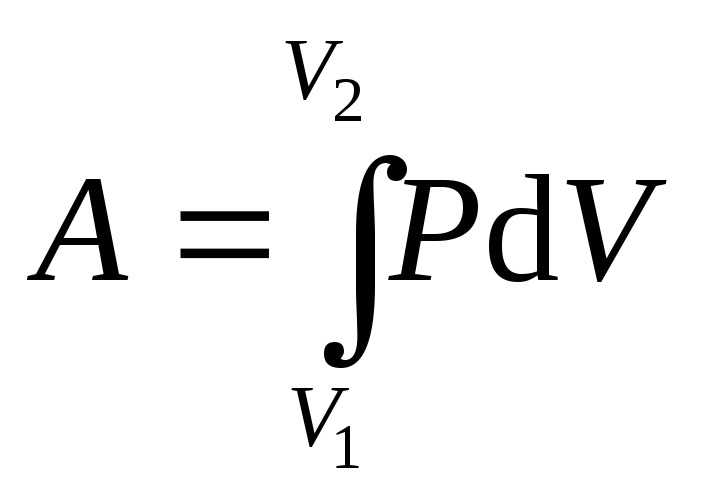 .
(8.9)
.
(8.9)
Приращение объема системы может быть как положительным, так и отрицательным. Если dV > 0, то dA > 0: система совершает работу над внешними телами – отдает им часть своей энергии. Если dV < 0, то dA < 0: внешние тела совершают над системой работу – система получает энергию извне.
Графически работа изображается в координатах p и V площадью, ограниченной кривой P = f (V) и двумя ординатами, соответствующими начальному V1 и конечному V2 объемам (рис. 8.5). Элементарная работа системы dA численно равна площади узкой заштрихованной полоски, полная работа A – площади криволинейной трапеции.
Процесс,
при котором система, пройдя некоторую
последовательность состояний, снова
возвращается в исходное состояние,
называется круговым процессом (циклом).
Вместе с тем, численное значение работы
зависит от пути перехода системы из
одного состояния в другое. Так, если
система переходит из состояния 1 в
состояние 2 один раз по пути (а),
а другой раз по пути (b)
(рис. 8.6), то A1а2
![]() A1b2.
Следовательно, работа, совершаемая при
круговом процессе, отлична от нуля. Это
означает, что силы давления –
неконсервативные силы.
A1b2.
Следовательно, работа, совершаемая при
круговом процессе, отлична от нуля. Это
означает, что силы давления –
неконсервативные силы.
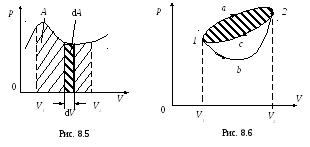
А
= А1а2
+ А2с1
.
Работа на участке 1а2 положительна (система расширяется) и по абсолютной величине равна площади криволинейной трапеции V1аV2. Работа на участке 2c1 отрицательна (объем системы уменьшается) и по абсолютной величине равна площади криволинейной трапеции V1сV2, которая меньше площади V1aV2. Следовательно,
А = А1а2 + А2с1 > 0 .
Пользуясь общим выражением работы в термодинамике (8.9), найдем работу в изопроцессах.
Изохорический процесс осуществляется при нагревании или охлаждении газа при постоянном объеме сосуда. В этом процессе dV = 0 и газ не совершает работы:
dA = pdV = 0 .
Изобарический процесс осуществляется при нагревании или охлаждении газа, находящегося в цилиндре с подвижным поршнем. В изобарическом процессе
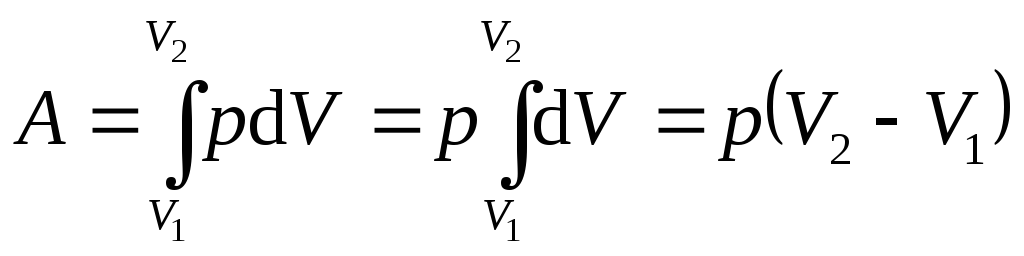 .
(8.10)
.
(8.10)
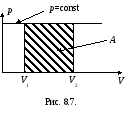
Графически работа Ав изобарическом процессе изображается заштрихованной площадью прямоугольника, приведенного на рис. 8.7.
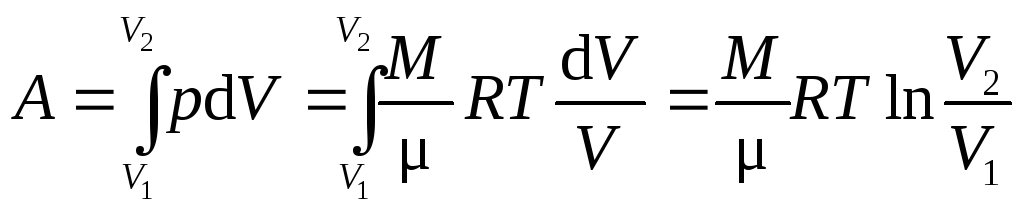 ,
(8.11)
,
(8.11)
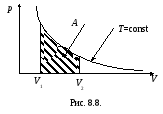
где рнаходится из уравнения Менделеева – Клапейрона. Эта работа измеряется площадью, заштрихованной на рис. 8.8.
Передача тепловой энергии (теплоты) – энергии хаотического движения молекул – зависит от физических свойств системы, характера термодинамического процесса и выражается изменением температуры тела. Для характеристики способности тел повышать свою температуру за счет полученного извне тепла вводится понятие теплоемкость.
Теплоемкость С – скалярная физическая величина, характеризующая связь между количеством сообщенного системе тепла и изменением ее температуры.Различают полную, молярную и удельную теплоемкости.
Полная теплоемкость Спол численно равна количеству тепла, которое необходимо сообщить системе, чтобы повысить ее температуру на один градус
Спол=![]() . (8.12)
. (8.12)
Молярная теплоемкость С численно равна количеству тепла, которую нужно сообщить одному киломолю вещества, чтобы повысить его температуру на один градус:
![]() ,
(8.13)
,
(8.13)
где
![]() число молей.
число молей.
Удельная теплоемкость (с) численно равна количеству тепла, которую нужно сообщить единице массы вещества, чтобы повысить ее температуру на один градус:
![]() , (8.14)
, (8.14)
где M– масса вещества.
Из сопоставления формул (8.13) и (8.14) следует, что
С= с. (8.15)
В зависимости от характера процесса различают теплоемкости при постоянном объеме СVи при постоянном давленииСр.
