
- •Э.М. Нуруллаев., н.А. Вдовин
- •Оглавление
- •Введение
- •Кинематика поступательного и вращательного движения абсолютно твердого тела
- •1.1. Поступательное движение
- •1.2. Вращательное движение
- •2. Динамика поступательного движения
- •2.1. Фундаментальные взаимодействия
- •2.2. Основные характеристики динамики Ньютона
- •2.3. Закон инерции. Инерциальные системы отсчета
- •2.4. Масса и закон сохранения импульса
- •2.5. Второй закон Ньютона
- •2.6. Третий закон Ньютона и закон сохранения импульса
- •2.7. Преобразования и принцип относительности Галилея
- •2.8. Основной закон динамики поступательного движения и закон сохранения импульса для системы материальных точек
- •2.9. Некоторые силы, рассматриваемые в механике
- •2.10. Практическое применение законов Ньютона
- •2.11. Движение тела с переменной массой
- •Вопросы для самоконтроля
- •3. Динамика вращательного движения твердого тела
- •3.1. Основной закон динамики вращательного движения
- •Сумма произведений массы каждой материальной точки тела на квадрат ее расстояния до оси называется моментом инерции тела относительно этой оси. Момент инерции относительно оси Оz равен
- •3.2. Закон сохранения момента импульса
- •Вопросы для самоконтроля
- •4. Работа, мощность, энергия
- •4.1. Работа и мощность при поступательном движении
- •4.2. Работа и мощность при вращательном движении
- •4.3. Кинетическая энергия при поступательном движении
- •4.4. Кинетическая энергия вращающегося тела
- •4.5. Потенциальная энергия
- •4.6. Силы и потенциальная энергия
- •4.7. Закон сохранения энергии
- •4.8. Применение законов сохранения к соударениям тел
- •5. Колебательное движение
- •5.1. Механические колебания
- •5.2. Гармонические колебания
- •5.2.1. Кинематические характеристики гармонического колебания
- •5.2.2. Динамические характеристики гармонического колебания
- •Потенциальная энергия
- •5.3. Маятник
- •5.3.1. Математический маятник
- •5.3.2. Физический маятник
- •5.4. Сложение гармонических колебаний
- •5.4.1. Сложение колебаний одной частоты, направленных вдоль одной прямой
- •5.4.2. Биения
- •5.4.3. Сложение взаимно перпендикулярных колебаний
- •5.5. Затухающие колебания
- •Согласно формуле (5.5) период затухающих колебаний
- •5.6. Вынужденные колебания
- •6. Упругие волны
- •6.1. Волновые процессы. Продольные и поперечные волны
- •6.2. Энергия упругих волн. Вектор Умова
- •6.3. Уравнение бегущей волны. Фазовая скорость. Волновое уравнение
- •Для характеристики волн используется волновое число
- •Учитывая (6.8), уравнению (6.7) можно придать вид
- •6.4. Принцип суперпозиции. Групповая скорость
- •6.5.Интерференция волн
- •6.6. Стоячие волны
- •7. Молекулярная физика
- •7.1. Предмет молекулярной физики и термодинамики. Статистический и термодинамический методы изучения макроскопических систем
- •7.2. Основные положения молекулярно-кинетической теории
- •7.3. Газообразное состояние вещества. Идеальный газ
- •7.4. Параметры состояния идеального газа
- •7.5. Основное уравнение молекулярно-кинетической теории (уравнение Клаузиуса) и следствия из него
- •Уравнение (4) с учетом (5) примет вид
- •Произведение na равно числу молекул n, содержащихся в массе газа m. С учетом этого получим
- •А с учетом того, что число молекул в единице объема, можно записать:
- •7.6. Закон Максвелла распределения молекул идеального газа по скоростям и энергиям
- •7.8. Идеальный газ в однородном поле тяготения.
- •7.9. Число столкновений и средняя длина свободного пробега молекул
- •7.10. Явления переноса в газах
- •7.11.Реальные газы
- •7.13. Внутренняя энергия реального газа. Эффект Джоуля – Томсона
- •7.14. Элементы механики жидкостей. Давление в жидкости и газе
- •7.15. Уравнение Бернулли
- •7.16.Движение тел в жидкостях и газах
- •8. Термодинамика
- •8.1. Внутренняя энергия, работа и теплота
- •В случае идеального газа нет сил межмолекулярного взаимодействия и внутренняя энергия равна сумме энергий беспорядочного (теплового) движения всех молекул.
- •8.2. Внутренняя энергия идеального газа. Степени свободы системы
- •Внутренняя энергия произвольной массы идеального газа
- •8.3. Работа и теплота
- •8.4. Первое начало термодинамики
- •8.5. Применение первого начала термодинамики к изопроцессам в идеальном газе
- •8.6. Политропические процессы
- •8.7. Тепловые двигатели и холодильные машины. Цикл Карно и его кпд
- •8.8. Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
- •8.9. Второе начало термодинамики
- •8.10. Применение второго начала термодинамики для определения изменения энтропии в процессах идеального газа
- •8.11. Третье начало термодинамики, или теорема Нернста – Планка
- •Список литературы
7.6. Закон Максвелла распределения молекул идеального газа по скоростям и энергиям
При выводе основного уравнения МКТ молекулам задавали различные скорости. В результате многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Однако из-за хаотического движения молекул все направления движения являются равновероятными, т.е. в любом направлении в среднем движется одинаковое количество молекул.
Согласно
молекулярно-кинетической теории, как
бы ни изменялись скорости молекул при
столкновениях, средняя квадратичная
скорость молекул газа массой М
в газе, находящемся в состоянии
равновесия приT= const, остается
постоянной![]() .
Это объясняется тем, что в газе, находящимся
в состоянии равновесия, устанавливается
некоторое стационарное, не меняющееся
со временем распределение молекул по
скоростям, подчиняющееся вполне
определенному закону. Этот закон
теоретически выведен Дж. Максвеллом.
.
Это объясняется тем, что в газе, находящимся
в состоянии равновесия, устанавливается
некоторое стационарное, не меняющееся
со временем распределение молекул по
скоростям, подчиняющееся вполне
определенному закону. Этот закон
теоретически выведен Дж. Максвеллом.
Максвелл предполагал, что газ состоит из большого числа N тождественных молекул (они находятся в состоянии хаотического теплового движения при одинаковой температуре) и, что силовые поля на газ не действуют.
Закон
Максвелла описывается некоторой функцией
f(v), называемойфункцией
распределения молекул по скоростям.Если разбить диапазон скоростей молекул
на малые интервалы, равные dv, то на
каждый интервал скорости будет приходиться
некоторое число молекул dN(v),имеющих скорость, заключенную в этом
интервале. Функцияf(v) определяет
относительное число молекул dN(v)/N,скорости которых лежат в интервале отvдоv+dv, т.е.![]() ,
откуда
,
откуда![]() .
.
Применяя методы теории вероятностей, Максвелл нашел функцию f(v) –закон для распределения молекул идеального газа по скоростям:
![]() . (7.19)
. (7.19)
Из (7.19) видно, что конкретный вид функции зависит от рода газа (масса молекулы) и от параметра состояния (температура Т).


скорости v
множитель![]() уменьшается быстрее, чем растет множительv2, то функцияf(v),начинаясь с нуля, достигает максимума
при наиболее вероятной скоростиvви затем асимптотически стремится к
нулю. Кривая несимметрична относительноvв.
уменьшается быстрее, чем растет множительv2, то функцияf(v),начинаясь с нуля, достигает максимума
при наиболее вероятной скоростиvви затем асимптотически стремится к
нулю. Кривая несимметрична относительноvв.
Относительное число молекул dN(v)/N, скорости которых лежат в интервале отvдоv+dv, находится как площадь полоски на рис 7.6. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функцияf(v) удовлетворяет условию нормировки
![]() .
.
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью vв. Значение наиболее вероятной скорости можно найти, продифференцировав выражение (7.19) (постоянные множители опускаем) по аргументуv, приравняв результат к нулю и использовав условие для максимума выраженияf(v):
![]() .
.
Значения v = 0 иv =соответствуют минимумам выражения (7.19), значениеv, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скоростьvв:
![]() .
(7.20)
.
(7.20)

Средняя
скорость молекулы![]() (средняя арифметическая скорость)определяется по формуле
(средняя арифметическая скорость)определяется по формуле
![]()
Подставляя в последнее выражение f(v) и интегрируя его, получим
![]() (7.21)
(7.21)
Скорости, характеризующие состояние газа (см. рис. 7. 6):
наиболее вероятная
 ;
;
2)
средняя
![]()
3)
средняя квадратичная
![]()
Исходя из распределения молекул по скоростям
 ,
(7.22)
,
(7.22)
можно найти распределение
молекул газа по значениям кинетической
энергии . Для этого
перейдем от переменнойvк переменной = m v2/2.
Подставив в уравнение (7.22)![]() и
и![]() ,
получим
,
получим
![]() ,
,
где dN() – число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале отдо+d.
Таким образом, функция распределения молекул по энергиям теплового движения
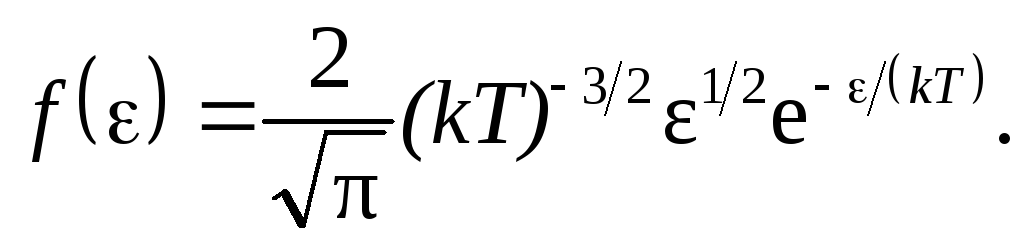
Средняя кинетическая энергия молекулы идеального газа
![]() .
.
7.7. Опыт Штерна

Зная радиусы цилиндров, их угловую скорость вращения, а также измеряя S, можно вычислить скорость движения атомов серебра при данной температуре проволоки. Результаты опыта показали, что средняя скорость атомов серебра близка к той, которая следует из максвелловского распределения молекул по скоростям.
