
- •Э.М. Нуруллаев., н.А. Вдовин
- •Оглавление
- •Введение
- •Кинематика поступательного и вращательного движения абсолютно твердого тела
- •1.1. Поступательное движение
- •1.2. Вращательное движение
- •2. Динамика поступательного движения
- •2.1. Фундаментальные взаимодействия
- •2.2. Основные характеристики динамики Ньютона
- •2.3. Закон инерции. Инерциальные системы отсчета
- •2.4. Масса и закон сохранения импульса
- •2.5. Второй закон Ньютона
- •2.6. Третий закон Ньютона и закон сохранения импульса
- •2.7. Преобразования и принцип относительности Галилея
- •2.8. Основной закон динамики поступательного движения и закон сохранения импульса для системы материальных точек
- •2.9. Некоторые силы, рассматриваемые в механике
- •2.10. Практическое применение законов Ньютона
- •2.11. Движение тела с переменной массой
- •Вопросы для самоконтроля
- •3. Динамика вращательного движения твердого тела
- •3.1. Основной закон динамики вращательного движения
- •Сумма произведений массы каждой материальной точки тела на квадрат ее расстояния до оси называется моментом инерции тела относительно этой оси. Момент инерции относительно оси Оz равен
- •3.2. Закон сохранения момента импульса
- •Вопросы для самоконтроля
- •4. Работа, мощность, энергия
- •4.1. Работа и мощность при поступательном движении
- •4.2. Работа и мощность при вращательном движении
- •4.3. Кинетическая энергия при поступательном движении
- •4.4. Кинетическая энергия вращающегося тела
- •4.5. Потенциальная энергия
- •4.6. Силы и потенциальная энергия
- •4.7. Закон сохранения энергии
- •4.8. Применение законов сохранения к соударениям тел
- •5. Колебательное движение
- •5.1. Механические колебания
- •5.2. Гармонические колебания
- •5.2.1. Кинематические характеристики гармонического колебания
- •5.2.2. Динамические характеристики гармонического колебания
- •Потенциальная энергия
- •5.3. Маятник
- •5.3.1. Математический маятник
- •5.3.2. Физический маятник
- •5.4. Сложение гармонических колебаний
- •5.4.1. Сложение колебаний одной частоты, направленных вдоль одной прямой
- •5.4.2. Биения
- •5.4.3. Сложение взаимно перпендикулярных колебаний
- •5.5. Затухающие колебания
- •Согласно формуле (5.5) период затухающих колебаний
- •5.6. Вынужденные колебания
- •6. Упругие волны
- •6.1. Волновые процессы. Продольные и поперечные волны
- •6.2. Энергия упругих волн. Вектор Умова
- •6.3. Уравнение бегущей волны. Фазовая скорость. Волновое уравнение
- •Для характеристики волн используется волновое число
- •Учитывая (6.8), уравнению (6.7) можно придать вид
- •6.4. Принцип суперпозиции. Групповая скорость
- •6.5.Интерференция волн
- •6.6. Стоячие волны
- •7. Молекулярная физика
- •7.1. Предмет молекулярной физики и термодинамики. Статистический и термодинамический методы изучения макроскопических систем
- •7.2. Основные положения молекулярно-кинетической теории
- •7.3. Газообразное состояние вещества. Идеальный газ
- •7.4. Параметры состояния идеального газа
- •7.5. Основное уравнение молекулярно-кинетической теории (уравнение Клаузиуса) и следствия из него
- •Уравнение (4) с учетом (5) примет вид
- •Произведение na равно числу молекул n, содержащихся в массе газа m. С учетом этого получим
- •А с учетом того, что число молекул в единице объема, можно записать:
- •7.6. Закон Максвелла распределения молекул идеального газа по скоростям и энергиям
- •7.8. Идеальный газ в однородном поле тяготения.
- •7.9. Число столкновений и средняя длина свободного пробега молекул
- •7.10. Явления переноса в газах
- •7.11.Реальные газы
- •7.13. Внутренняя энергия реального газа. Эффект Джоуля – Томсона
- •7.14. Элементы механики жидкостей. Давление в жидкости и газе
- •7.15. Уравнение Бернулли
- •7.16.Движение тел в жидкостях и газах
- •8. Термодинамика
- •8.1. Внутренняя энергия, работа и теплота
- •В случае идеального газа нет сил межмолекулярного взаимодействия и внутренняя энергия равна сумме энергий беспорядочного (теплового) движения всех молекул.
- •8.2. Внутренняя энергия идеального газа. Степени свободы системы
- •Внутренняя энергия произвольной массы идеального газа
- •8.3. Работа и теплота
- •8.4. Первое начало термодинамики
- •8.5. Применение первого начала термодинамики к изопроцессам в идеальном газе
- •8.6. Политропические процессы
- •8.7. Тепловые двигатели и холодильные машины. Цикл Карно и его кпд
- •8.8. Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
- •8.9. Второе начало термодинамики
- •8.10. Применение второго начала термодинамики для определения изменения энтропии в процессах идеального газа
- •8.11. Третье начало термодинамики, или теорема Нернста – Планка
- •Список литературы
7.11.Реальные газы
При описании свойств газов мы считали их идеальными, когда средние расстояния между молекулами газа достаточно велики, т.е. моделью идеального газа являются невзаимодействующие друг с другом шарики, которые движутся хаотически и объемом которых можно пренебречь. В этом случае можно не учитывать потенциальную энергию взаимодействия по сравнению с кинетической энергией молекул.
Cувеличением давления и понижением температуры средние расстояния между молекулами уменьшаются и средняя кинетическая энергия молекул становится сравнимой с потенциальной энергией взаимодействия. Поведение реального газа все больше отличается от поведения идеального газа. Так, радиус молекул большинства газов порядка 10-10м (1Ǻ), следовательно, объем молекул порядка 41030 м3. В 1 м3 газа при нормальных условиях содержится 2,71025молекул. Таким образом, собственный объем молекул в 1 м3 при нормальных условиях будет порядка 1,2104 м3, т.е. около 0,0001 от объема, занятого газом.
При увеличении давления до 5000 атм объем газа по закону Бойля Мариотта уменьшится в 5000 раз, т.е. то же число молекул должно двигаться в объеме 2104 м3. Следовательно, собственный объем молекул занимает 0,5 объема сосуда. Ясно, что в таких условиях пренебрегать размерами молекул нельзя. Кроме того, нельзя при этом не учитывать силы взаимодействия между молекулами, так как они теперь находятся друг от друга на сравнительно близких расстояниях. Очевидно, следует перейти от схемы идеального газа к реальным газам.
Для получения уравнения, более точно описывающего поведение реальных газов, необходимо основываться на более близкой к реальному газу модели.
Из большого числа уравнений, предложенных для описания поведения реальных газов, самым простым и вместе с тем дающим достаточно хорошие результаты оказалось уравнение голландского физика Ван-дер-Ваальса (1873 г.).
7.12. Уравнение Ван-дер-Ваальса
Для получения уравнения Ван-дер-Ваальс воспользовался следующей моделью: молекулы газа представляют собой абсолютно упругие шарики конечного размера, между которыми существуют силы взаимного притяжения.
В соответствии с этой новой моделью Ван-дер-Ваальс предложил внести две поправки в уравнение Менделеева – Клапейрона: рV = RT,гдеV– объем одного киломоля газа.
Учет собственного объема молекул. Первая поправка Ван-дер-Ваальсаb– поправка на так называемый недоступный объем. Если обозначить объем несжимаемой части 1 кмоля газа черезb, то уравнение состояния газа должно принять следующий вид:
р (V – b) = RT.(7.40)
При робъем газа стремится кb, а не к 0, как это следует из уравнения (7.10).
На первый взгляд может показаться, что объем bравен просто сумме объемов всех молекул. Но это не так. Следует принять во внимание, что при сжатии газа уменьшается не весь объем, а лишь разность между объемами газа и его несжимаемой части.

![]()
![]() ,
где
,
где![]() объем одной молекулы.
объем одной молекулы.
Это значит, что
недоступный объем, приходящийся на
каждую молекулу, равен
![]() ,
т.е. учетверенному собственному объему.
А недоступный объем, приходящийся на
всеNAмолекул 1-го киломоля,
,
т.е. учетверенному собственному объему.
А недоступный объем, приходящийся на
всеNAмолекул 1-го киломоля,
b= 4![]() r3
NA,
r3
NA,
т.е. учетверенному объему всех молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться на расстояние, меньше диаметра d = 2rмолекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиусаd= 2r, т.е. объем, равный восьми объемам молекулы, а в расчете на одну молекулу – учетверенный объем молекулы.
Учет силы межмолекулярного взаимодействия. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением.По вычислениям Ван-дер-Ваальса внутреннее давление обратно пропорционально квадрату молярного объема, т.е.
![]() , (7.42)
, (7.42)
где а– постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения,V– молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
![]() . (7.43)
. (7.43)
Для произвольного количества вещества с учетом того, что
![]() ,
,
уравнение (7.43) примет вид
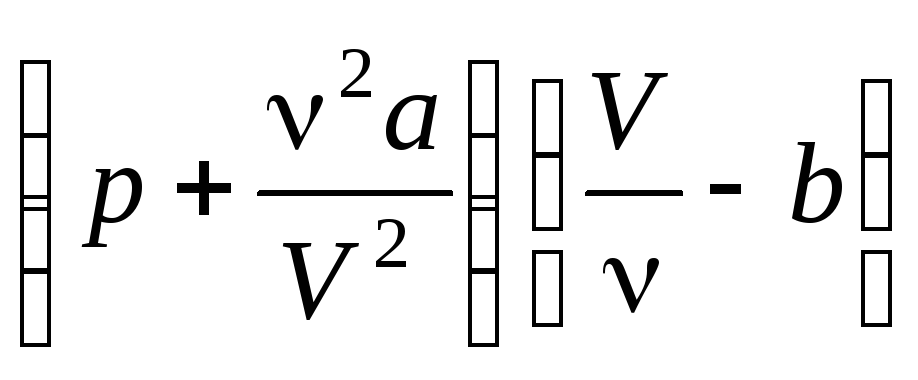
или
![]() ,
(7.44)
,
(7.44)
где поправки аиb– постоянные для каждого газа величины, определяемые опытным путем.
Исходя из уравнения (7.44), можно построить изотермы. Так как уравнение Ван-дер-Ваальса представляет собой уравнение третьей степени относительно объема V, то оно дает одно или три вещественных значенияVв зависимости отpиT.
Графически теоретические изотермы Ван-дер-Ваальса представлены на рис. 7.15, где зависимость pотVдана для различных температур.
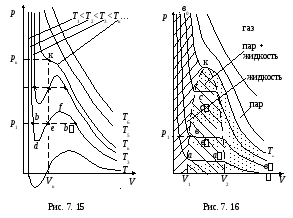
При высоких температурах эти изотермы имеют форму, близкую к гиперболе рV = const и описывают газообразное состояние вещества (почти идеальный газ).
По мере уменьшения температуры форма изотермы изменяется, и при некоторой температуре Ткона обнаруживает точку перегиба (к). При еще меньших температурах изотермы приобретают сложную форму и могут заходить даже в область отрицательных давлений (см. рис. 7.15).
Как понять столь странное поведение газа? Ответ на этот вопрос дают экспериментальные изотермы, полученные Эндрюсом для углекислоты. В толстостенном сосуде сжимался один киломоль СО2, давление измерялось манометром, температура поддерживалась постоянной. Полученные им изотермы представлены на рис. 7.16. На этих изотермах вместо горбов, характерных для теоретических изотерм Ван-дер-Ваальса, получаются прямолинейные горизонтальные участки (аа,вв,сси т.д.), постепенно уменьшающиеся с увеличением температуры и на кривой (Тк= const) вырождающиеся в точку перегиба кривой (точку к).
Что же происходит с газом? При малых давлениях, соответствующих ветви вв, газ сжимается аналогично идеальному, обнаруживая, правда, несколько большую сжимаемость. Но, когда давление газа достигает значенияр1при объемеV2, в дальнейшем оно остается неизменным до объемаV1. На этом участке газ превращается в жидкость. Конденсация газа продолжается до тех пор, пока вся масса газа в сосуде не превратится в жидкость (точкав). При дальнейшем уменьшении объема происходит сжатие жидкости. Очень крутой подъем ветвивв0свидетельствует о малой сжимаемости жидкости.
Сокращение горизонтальных участков с повышением температуры означает, что жидкое состояние все меньше отличается от газообразного и в точке перегиба (к) различие между этими состояниями вещества исчезает. Таким образом, состояние вещества, характеризуемое точкой к, с одинаковым правом можно назвать как газом, так и жидкостью. Поэтому такое состояние называют критическим, а температуру, при котором оно наступает, критической температурой Тк.
Критическая температура Тк на рис. 7.15. характеризуется точкой, которой соответствует критический объемVки критическое давлениерк. Уравнение Ван-дер-Ваальса является относительно объема алгебраическим уравнением третьей степени. В самом деле, уравнение (7.43) можно привести к виду
![]() .
(7.45)
.
(7.45)
При фиксированных значениях давления и температуры оно имеет три корня относительно V(V1, V2, V3) или
(V V1 ) (V V2 ) (V V3 ) = 0.
В критическом состоянии все три корня совпадают:
V1 = V2 = V3 = Vк, т.е. (V -Vк)3= 0 . (7.46)
Раскрывая
уравнение (7.46) и сравнивая коэффициенты
при
![]() ,
иV ,
получаем для критического состояния
(p = pк ,Т = Тк):
,
иV ,
получаем для критического состояния
(p = pк ,Т = Тк):
![]() ,Vк = 3b, pк =
,Vк = 3b, pк =
![]() . (7.47)
. (7.47)
Если на различных изотермах соединить все точки, при которых начинается процесс кипения, и точки, при которых начинается процесс конденсации, то получится некоторая область, очерченная пунктиром на рис. 7.16. Эта пунктирная куполообразная линия разделяет pVдиаграмму на три области:
1 правая часть от очерченной области соответствует газу – газ (Г), здесь вещество находится в одной газообразной фазе;
2 слева – жидкость (Ж), однофазное состояние;
3 внутри очерченной области – двухфазная система жидкость + пар (Ж+П). Выше изотермы, которая соответствует температуреТк,однофазная область – газ (Г).
При температурах выше критической нет прямолинейных горизонтальных отрезков на изотермах. Следовательно, при этих температурах, ни при каких давлениях сжижать газ нельзя. Отсюда вытекает условие сжижения газов: для превращения газа в жидкость необходимо сжимать газ при температурах ниже критической.
Сопоставление изотерм Ван-дер-Ваальса с опытными изотермами показывает, что изотермы Ван-дер-Ваальса в отличие от изотерм Бойля – Мариотта охватывают не только область газообразного состояния вещества, но и области двухфазного и жидкого состояний. При этом в области малых давлений и больших объемов наблюдается совпадение изотерм, что понятно, так как при этих условиях газ можно считать идеальным. Жидкому состоянию соответствуют круто уходящие вверх левые участки изотерм Ван-дер-Ваальса. Однако в этой области имеется лишь качественное согласие с результатами экспериментов.
Волнообразные участки (вdefв ) изотерм Ван-дер-Ваальса (см. рис. 7.15), относящиеся к двухфазному состоянию вещества, сильно отличается от соответствующих горизонтальных участков экспериментальных изотерм (пунктирные прямыевв ). Однако опыты показывают, что некоторые состояния, соответствующие участкамвdefв изотерм Ван-дер-Ваальса, практически осуществимы. Например, можно задержать кипение жидкости, тщательно удалив из нее примеси и производя нагревание в сосуде с гладкими стенками. При этом получают перегретую жидкость, различным состояниям которой соответствуют точки кривойвd.
Аналогично при медленном изотермическом сжатии газа, не содержащего пылинок, ионов и других центров конденсации, можно получить пересыщенный пар, соответствующий участку изотермы вf. При введении в пересыщенный пар пылинок или ионов происходит быстрая конденсация пара. Это явление используют в камере Вильсона для наблюдения траектории движения заряженных частиц. Участок изотермыdef практически не осуществим.
