
- •Московский государственный университет прикладной биотехнологии
- •Лабораторный практикум по физике
- •Введение
- •4Ая страница
- •Раздел I. Термодинамика. Молекулярно-кинетические явления переноса.
- •Определение показателя адиабаты методом клемана-дезорма
- •I.Описание установки.
- •II. Методика работы
- •III. Порядок выполнения работы
- •IV. Обработка результатов измерений
- •V. Вывод:
- •Контрольные вопросы
- •Определение коэффициента вязкости жидкости по методу стокса
- •I. Описание установки. Приборы и принадлежности.
- •II. Методика работы.
- •III. Порядок измерений и таблица результатов.
- •IV. Обработка результатов измерений.
- •V. Вывод:
- •Определение коэффициента вязкости воздуха капиллярным методом (методом Пуазейля)
- •I. Описание установки:
- •II. Методика работы.
- •III. Порядок измерений.
- •IV. Обработка результатов измерений
- •Литература
- •Раздел II. Колебания. Волны.
- •Исследование затухающих и вынужденных колебаний
- •Упражнение 1
- •Порядок выполнения работы
- •Упражнение 2
- •I. Методика работы
- •II. Описание установки.
- •III. Порядок выполнения работы
- •IV. Обработка результатов измерений
- •V. Выводы к упражнению 2:
- •Лабораторная работа № 5 (1-11) определение скорости звука в твердых телах методом кундта
- •I. Описание установки.
- •II. Методика работы.
- •III. Порядок выполнения работы
- •IV. Обработка результатов измерений
- •Контрольные вопросы
- •Литература
- •Вопросы для защиты в форме круглого стола
- •Раздел III. Электростатика. Постоянный ток
- •Лабораторная работа № 6 (2-4) определение емкости конденсатора баллистическим гальванометром
- •Упражнение 1.
- •III. Порядок выполнения работы
- •Упражнение 2.
- •Порядок выполнения работы
- •Контрольные вопросы.
- •Лабораторная работа № 7 (2-1) измерение сопротивлений при помощи моста уитстона
- •Из формулы сопротивления для однородного проводника
- •Или, в зависимости от знака х, наоборот:
- •III. Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Вопросы для защиты в форме круглого стола
- •Раздел IV. Электромагнетизм
- •Определение горизонтальной составляющей вектора индукции магнитного поля земли
- •I. Описание установки.
- •II. Методика работы.
- •III. Порядок выполнения работы
- •IV. Обработка результатов измерений
- •V. Вывод:
- •Контрольные вопросы
- •Лабораторная работа № 9 (2-15) определение кривой намагничиваия железа
- •I. Описание установки.
- •III. Порядок выполнения работы
- •IV. Обработка результатов измерений
- •Контрольные вопросы
- •Литература
- •Вопросы для защиты в форме круглого стола
- •Раздел V. Волновая оптика
- •Изучение явления интерференции света от двух когерентных источников (опыт Юнга)
- •III. Порядок выполнения работы
- •Контрольные вопросы.
- •Определение длин волн в спектре с помощью дифракционной решетки
- •I. Описание установки.
- •II. Методика работы.
- •III. Порядок выполнения работы
- •IV. Обработка результатов.
- •Контрольные вопросы
- •Изучение закона малюса
- •I. Описание установки.
- •II. Методика работы.
- •III. Порядок выполнения работы.
- •IV. Обработка результатов.
- •Контрольные вопросы
- •II. Методика работы.
- •Порядок выполнения работы
- •IV. Обработка результатов.
- •Контрольные вопросы.
- •Литература
- •Вопросы для защиты в форме круглого стола
- •Раздел VI. Квантовая оптика
- •Определение температуры нити накаливания с помощью яркостного пирометра
- •I. Описание установки.
- •II. Методика работы.
- •III. Порядок выполнения работы
- •IV. Обработка результатов.
- •Дополнительное задание.
- •Контрольные вопросы
- •Лабораторная работа № 14 (3-19) изучение фотоэлемента с внешним фотоэффектом
- •I. Описание установки
- •II. Методика работы
- •III. Порядок выполнения работы
- •Снятие вольтамперной характеристики
- •Снятие световой характеристики
- •Дополнительное задание
- •Контрольные вопросы
- •Ознакомление с работой газового лазера
- •Контрольные вопросы.
- •Литература
- •Вопросы для защиты в форме круглого стола
- •Приложение I. Погрешности прямых и косвенных измерений
- •2.Абсолютная и относительная погрешности
- •3.Доверительные границы. Доверительная вероятность (коэффициент надежности)
- •4.Задача обработки результатов наблюдений
- •5. Систематические и случайные погрешности
- •6. Однократные и многократные измерения а. Однократные измерения
- •Б. Многократные измерения
- •В. Сложение погрешностей
- •7.Обработка результатов прямых многократных наблюдений
- •А. Порядок операций при обработке результатов прямых многократных измерений
- •Б. Пример обработки результатов прямых многократных измерений
- •8. Обработка результатов косвенных измерений
- •А. Метод частных дифференциалов
- •Б. Метод дифференциала логарифма
- •В. Порядок операций при обработке результатов косвенных измерений
- •2. Округление погрешностей
- •3. Правила построения графиков экспериментальных зависимостей
- •Вопросы для защиты в форме круглого стола
Определение показателя адиабаты методом клемана-дезорма
Цель работы: определить показатель адиабаты для воздуха.
I.Описание установки.
Для определения показателя адиабаты используется установка Клемана-Дезорма, схема которой приведена на рис. 1.1.
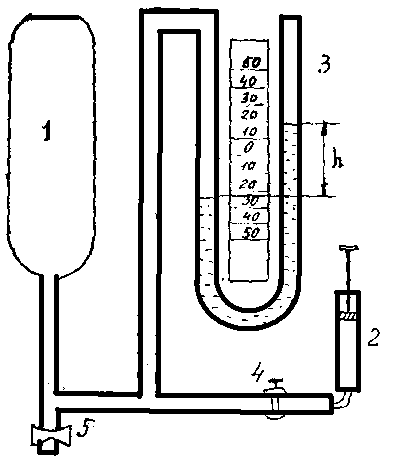
Рис. 1.1 Установка Клемана-Дезорма
К баллону 1 емкостью 10-15 л, в котором находится испытываемый газ, через кран 4 подключен насос 2, позволяющий увеличить давление по сравнению с атмосферным. Превышение давления измеряется с помощью U-образного манометра 3 по разностям уровней h жидкости в коленах. Кран 5 служит для кратковременного выпуска газа.
II. Методика работы
Если в баллон накачивают газ (например, воздух) до давления Р1, большего, чем Р0, то состояние газа характеризуется параметрами P1, V1, T1 и соответствует точке 1 на P-V диаграмме (рис. 1) (Внимание! Здесь и далее буквой V обозначается удельный объем, т.е. объем, занимаемый единицей массы газа. Это удобно для расчетов, т.к. по условиям опыта масса газа в сосуде будет изменяться.)

Рис. 1.2. P-V диаграмма газовых процессов.
Если на короткое время открыть кран баллона, то часть газа выйдет, а давление внутри баллона снизится до атмосферного Р0. При этом расширение газа, вследствие кратковременности его протекания, можно считать адиабатическим, т.е. происходящим без теплообмена с окружающей средой; такой процесс называют также изоэнтропийным, т.к. при нем не происходит изменения энтропии. Новое состояние газа будет характеризоваться параметрами P0 , V2, T2 (точка 2 на рис. 1). Так как, согласно первому началу термодинамики, работа газа при адиабатическом процессе совершается за счет убыли его внутренней энергии, то температура газа при этом понижается, т.е. Т2 Т1. Переход из состояния «1» в состояние «2» описывается уравнением Пуассона для адиабатического процесса, следовательно:
P1V1 = P0 V2, (1.1)
где - показатель адиабаты, причем по определению он равен:
= Cp/Cv , (1.2)
где Cp – теплоемкость газа при постоянном давлении,
Cv – теплоемкость газа при постоянном объеме.
(Напомним, что молярной теплоемкостью называется количество теплоты, которое нужно, чтобы нагреть 1 моль вещества на 1 К.)
Для идеального газа молярные теплоемкости Cp и Cv связаны уравнением Майера:
Cp=Cv+R, (1.3)
где R=8,31 Дж/(моль К) – универсальная газовая постоянная; отношение Cp/Cv = (i + 2)/i, (1.4)
где i – число степеней свободы молекул исследуемого газа: для одноатомного газа i=3, для двухатомного i=5, для многоатомного i=6.
Через некоторое время после закрытия крана оставшийся в баллоне газ нагреется при постоянном объеме до температуры окружающей среды Т1. При этом его давление повышается до значения Р2 (точка 3 на рис. 1). В методе Клемана-Дезорма измерение давления производят с помощью U-образного манометра (см. рис. 2); перепад h уровней жидкости в коленах манометра позволяет определить значения давления газа в баллоне Р1 и Р2 соответственно:
P1 = P0 + h1 ; P2 = P0 + h2 (1.5)
Конечное (точка 3) и начальное (точка 1) состояния газа соответствуют одной и той же температуре Т1 и связаны уравнением Бойля-Мариотта для изотермического процесса:
P1V1 = P2 V2. (1.6)
Чтобы получить формулы, связывающие показатель адиабаты с измеряемыми параметрами, возведем уравнение (1.5) в степень и разделим его почленно на уравнение (1.1):
P1 V1/(P1V1 )= P2 V2/(P0 V2), или P0 / P1 = (P2 / P1) , (1.7)
Логарифмируя уравнение (1.7), находим:
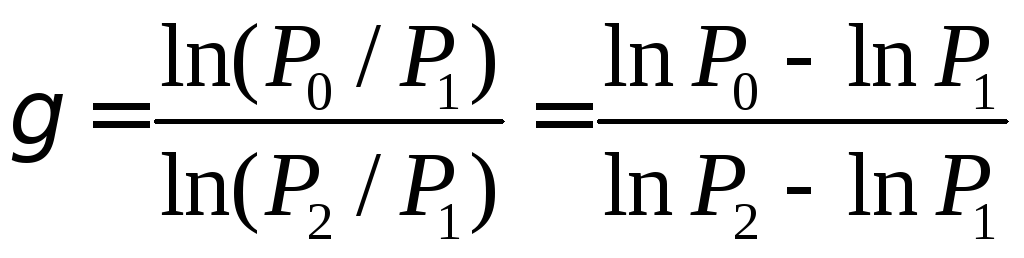 (1.8)
(1.8)
Выразим давление газа через разность уровней жидкости в манометре, подставляя (1.5) в уравнение (1.8). Получим
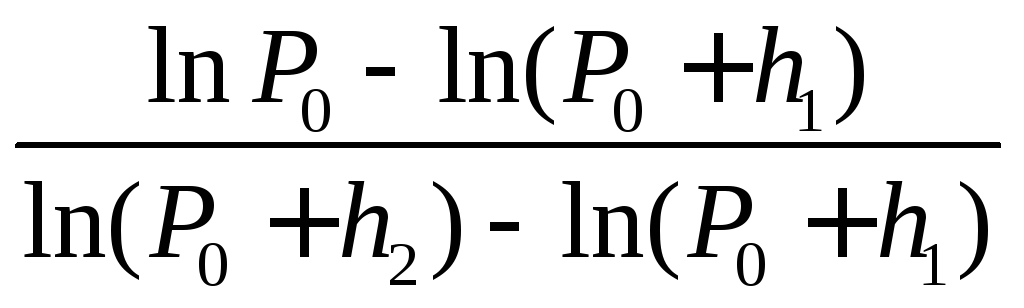 ,
(1.9)
,
(1.9)
или после преобразований:
 (1.10)
(1.10)
Отношения h1/P0 и (h1 –h2)/P0 значительно меньше единицы, поэтому, используя приближенную формулу ln(1-x) x при малых значениях х, получим из (1.10)
![]() (1.11)
(1.11)
Эта формула является расчетной для определения показателя адиабаты .
