
Ovru-all
.pdf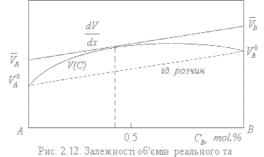
Виходячи з геометричного змісту похідної dV/dx, можна записати очевидні рівності:
|
|
|
|
|
|
|
V = xA |
VA |
|
|
+ xB |
VB |
, |
|
|
dV = dxA |
VA |
+ dxB |
VB |
, |
|
|
|
|
(2.73) |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= V - |
dV |
|
|
|
, |
|
|
|
|
= V + |
dV |
x |
|
. |
|
|
(2.74) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
x |
|
|
|
V |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
dx |
B |
|
|
|
|
B |
|
dx |
A |
|
|
|
|
|
||||||||||||||
|
Позначимо через |
DV величину відхилення об’єму розчину від |
|||||||||||||||||||||||||||||||||||||||||||
значення об’єму ідеального розчину: |
|
V = V − Vłä . Вочевидь, |
мож- |
||||||||||||||||||||||||||||||||||||||||||
на |
записати, |
|
|
|
що |
DV = x D |
|
+ x |
D |
|
, |
де |
D |
|
= D |
|
-V0 , |
||||||||||||||||||||||||||||
|
|
V |
V |
V |
V |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
2 |
2 |
|
|
|
|
|
|
|
|
1 |
1 |
1 |
||||||||||||
D |
|
2 |
= |
|
|
|
-V0 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
V |
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Аналогічно вводяться |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
інші парціальні функції: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
dS = |
|
|
dx1 + |
|
|
dx2 , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
S1 |
S2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
dH = |
|
dx1 + |
|
dx2 , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
H1 |
H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
dG = μ1dx1 + μ2 dx2 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
В |
|
останній |
|
|
|
рівності |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
замість `Gi записані хімічні потенціали, тому що в  розрахунку на одну молекулу
розрахунку на одну молекулу
mi=(дG/дNi)Т,Р,Nj(j¹i),
а в розрахунку на один моль mi=(дG/дхi)Т,Р,хj(j¹i). Оскільки виконуються також рівності
G = μ1x1 + μ2x2 і dG = μ1dx1 + μ2dx2 + x1dμ1 + x2 dμ2 ,
то з цього випливає співвідношення Гіббса-Дюгема:
x1dμ1 + x2dμ2 = 0 . |
(2.75) |
2.7.5. Ідеальний розчин |
|
Як зазначено вище для ідеального розчину |
V = V −Vłä = 0, |
H = 0 , DS = H = 0 , але Sід ¹ 0.
T
Оскільки виконується перший закон Рауля для всіх концентрацій
71

|
P01 − P1 |
= x |
2 |
, |
P02 − P2 |
= x , |
μ |
i |
= RT ln P + ϕ |
(T) , а у стандарт- |
|||
|
|
|
|||||||||||
|
P01 |
|
1 |
|
|
i |
i |
|
|
||||
|
|
|
P02 |
|
|
|
|
|
|
|
|||
ному стані для чистого компонента |
|
μ0 |
= RT ln P0 |
+ ϕ |
(T) , то з цього |
||||||||
|
|
|
|
|
|
|
|
|
i |
i |
|
i |
|
випливає вираз для зміни молярного потенціалу Гіббса при утворенні розчина за постійної температури з відповідної кількості х1 та х2 чистих компонентів
Gp = Gpî ç÷ − G0
Отже,
Оскільки dG = −SdT
Sp
|
|
|
|
|
|
|
P1 |
|
|
|
= x μ + x |
2 |
μ |
2 |
= RT x |
ln |
|
+ |
|||
|
||||||||||
1 1 |
|
|
1 |
|
P01 |
|
|
|||
|
|
|
|
|
|
|
|
|
||
Gp = RT(x1 ln x1 + x2 ln x2 ).
+ VdP + ∑μi dNi ,
i
= − ∂ ∂Gp = −R(x1 ln x1 + x2 ln x2 ) .
T
|
|
P2 |
|
x |
|
|
|
2 ln |
P02 |
|
|
|
|
|
(2.76)
(2.77)
І, відповідно, ентальпія під час утворення ідеального розчину не змінюється: Hp= Gp+ Sp=0.
Рівняння Вант Гоффа
Розглянемо рівновагу рідкого ідеального розчину з чистим А- компонентом у кристалічному стані. З умови рівноваги фаз
μs |
(T) = μl |
(T) з урахуванням (2.76) ( μ |
|
l |
(T) = (∂G/∂xl |
) |
|
) |
|
|||||||
A |
|
A |
|
|
|
|
A |
|
|
A |
T ,P,xB |
|
|
|||
|
|
|
= μ |
|
s (T) − μl |
(T) = −( H |
|
− T S |
|
) = −H |
|
− |
T |
|
||
RT ln x |
l |
A |
A |
A |
1 |
. |
||||||||||
|
||||||||||||||||
|
|
A |
|
A,xB=0 |
|
|
|
|
A |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tпл |
||
Отримане рівняння Вант Гоффа визначає нахил лінії ліквідусу (рівноважних концентрацій для рідкої фази). Перепишемо його у вигляді
|
H |
|
1 |
|
1 |
|
|
|
l |
|
A |
|
|
|
|
|
|
ln xA = |
|
|
− |
|
при T < Tпл . |
(2.78) |
||
R |
|
|
T |
|
||||
|
Tпл |
|
|
|
|
|||
За малих концентраціях другого В-компонента рівняння (2.78) збігається з третім законом Рауля.
Коефіцієнт розподілу
Коефіцієнт розподілу к= x2S/ x2l пов’язаний з нахилом ліній солідусу та ліквідусу. Знайдемо вираз для коефіцієнту розподілу для ви-
72
падку ідеальних рідкого та твердого розчинів. Візьмемо компонент А
(А≡1) у кількості х1l у твердому стані при температурі Т і переведемо його у рідкий стан
|
|
|
T |
|
|
μ1l – μ1s= H |
1 |
− |
. |
||
|
|||||
|
A |
|
|
|
|
|
|
|
TплA |
||
Утворимо рідкий розчин з рідких А і В компонентів у кількості
x1l та x2l
|
|
|
|
T |
|
|
|
|
|
Gl= x l |
H |
1 |
− |
|
+ RT(x l ln x l + x |
l ln x l ) . |
|||
|
|||||||||
1 |
|
A |
|
|
|
1 |
1 2 |
2 |
|
|
|
|
|
Tпл A |
|
|
|
||
Візьмемо рідкий компонент В у кількості х2s при температурі Т і переведемо його у твердий стан
s |
l |
|
|
|
|
T |
|
μ2 |
– μ2 |
= – |
HB |
1 |
− |
|
. |
|
|||||||
|
|
|
|
|
|
TплB |
|
Утворимо рідкий розчин із твердих А і В компонентів у кількості x1s та x2s
|
|
|
|
T |
|
s |
s |
s |
|
s |
|
Gs= – x2s |
HB |
1 |
− |
|
|
+ RT (x1 |
ln x1 |
+ x2 |
ln x |
2 |
) . |
|
|||||||||||
|
|
|
|
TплB |
|
|
|
|
|
|
|
Оскільки умовою рівноваги фаз (кристалічної та рідкої) є рівність хімічних потенціалів компонентів у кожній фазі, прирівняємо похідні від виразів потенціалів Гіббса для двох фаз по одному із компоне-
нтів (1≡A, похідні по іншому компоненту дадуть таку саму рівність)
|
|
|
|
T |
|
|
HA |
1 |
− |
|
|
|
+ RT(ln x1l − ln x2l ) = |
|
|
|
||||
|
|
|
|
TплA |
||
|
|
|
|
T |
|
|
HB |
1 |
− |
|
|
+ RT(ln x1s − ln x2s ). |
|
|
|
|||||
|
|
|
TплB |
|||
За високої концентрації основного компонента можна знехтувати
складовими RT ln x l та RT ln x s |
, а також |
H |
A |
(1 − T /T |
). Отже, |
|||||||
1 |
|
|
|
1 |
|
|
|
|
|
плА |
|
|
|
s |
|
l |
) = |
H |
|
|
− |
T |
|
|
|
ln(x |
2 |
/ x |
2 |
|
B |
1 |
|
|
. |
(2.79) |
||
|
|
|
||||||||||
|
|
|
|
|
RT |
|
|
TплB |
|
|||
73
2.7.6. Реальні розчини
Якщо надлишкова енергія взаємодії різнойменних атомів
eAB=VAB– (VAA+ VBB)/2 ¹ 0, то розчин не буде ідеальним і, відповідно, DQ ¹ 0 , DVp ¹ 0 , DHp ¹ 0 . Якщо внутрішня енергія під час
утворення розчину зменшується (eAB < 0), теплота виділяється (DQ< 0) – екзотермічна реакція. У разі збільшення внутрішньої енергії утворення розчина можливе, якщо вільна енергія все ж таки зменшується за рахунок ентропії. Роль ентропії тим більше, чим вище температура. Тому такі розчини утворюються при підвищених температурах, а теплота поглинається – ендотермічна реакція. Реальні роз-
чини мають кластерну структуру. При від’ємних значеннях eAB атоми одного сорту мають в своєму оточенні більше атомів іншого сор-
ту. А при додатних eAB утворюються кластери із атомів одного та іншого сортів (кластери з атомів типу А і кластери з атомів типу В).
У випадку реального розчину закон Рауля не виконується, тому парціальні потенціали Гіббса (хімічні потенціали) записують через значення активностей або коефіцієнтів активності:
|
Pi |
= ai = fixi |
ai – термодинамічна активність, або летючість і- |
|
|
||
|
Pi0 |
|
|
го компонента; |
fi - коефіцієнт активності; xi - відносна молярна |
||
концентрація. Отже, зміна потенціалу Гіббса при утворенні моля розчина при постійних Т,Р складатиме
DGp = x1RT ln a1 + x2 RT ln a2 = x1 RT ln( f1 x1 ) + x2 RT ln( f 2 x2 ) ; (2.80)
При цьому враховано, щоmi |
= RT ln Pi + ji (T), μi0 = ϕi (T), |
|
|
|
|||||||||||||||
m1 = RT ln a1 |
+ m1 (T) , m2 = RT ln a2 |
+ m2 |
(T). |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
Відповідно, |
|
|
|
|
|
|
|
|
|
|
|
∂ ln( f1 ) |
|
|
∂ ln( f2 ) |
||||
S = − |
¶DGp |
= −x Rln( f x )− x Rln( f x )− RT |
x |
+ x |
|
||||||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
∂T |
||||||||||||||||
p |
|
|
∂T |
|
1 |
|
1 1 |
|
2 |
|
2 2 |
|
|
|
∂T |
2 |
|||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
||||||
і DH |
p |
= DG |
p |
+ TDS |
p |
= -RT 2 |
x |
1 |
¶ ln( f1 ) + x |
¶ ln( f2 ) . |
|
|
|
||||||
|
|
|
|
|
|
¶T |
|
|
2 |
¶T |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Зв’язок законів Генрі та Рауля
Згідно закону Генрі x2=const×P2, якщо x1 ® 0 . Це означає, що коефіцієнт активності другого компонента f2=const, f2 ¹ f2 (x2 ,T). За-
74
пишемо зміну потенціалу Гіббса при утворенні розчину через значення коефіцієнтів активності й концентрації
DGp = x1RT ln( f1x1 )+ x2 RT ln( f2 x2 ) ;
Згідно із співвідношенням Гіббса-Дюгема (2.75),
dm = - |
x2dμ2 |
; а dm |
2 |
= |
RT |
dx |
2 |
( m |
2 |
= RT ln(x |
2 |
f |
2 |
)+ m |
0 |
(T) ). |
|||||
|
|
|
|||||||||||||||||||
1 |
1 |
- x2 |
|
|
|
|
x2 |
|
|
|
|
|
|||||||||
Тому |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dm = -RT |
dx2 |
= RT |
dx1 |
, |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
1 |
|
|
1 - x2 |
|
|
|
x1 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
m1 = RT ln x1 + const.
Як бачимо, у останньому виразі для хімічного потенціалу першого компонента коефіцієнт активності дорівнює 1. А це означає, що виконання для другого компонента закону Генрі (мала концентрація), обумовлює те, що для першого компонента виконується закон Рауля: Р1/Р1о= х1.
2.7.7. Регулярні розчини
Регулярними називають розчини, при утворенні яких є теплові
ефекти (DHр¹0), але за структурою вони мало відрізняються від ідеальних – слабка кластеризація. Тому зміну ентропії при утворенні такого розчину можна розраховувати за формулою для ідеального розчину (2.77). Фактично розчини із змістом другого компонента менше 1 мол.% можна розглядати як ідеальні, а при концентраціях від 1 до 10 мол.% – як регулярні. Кластеризація таких розчинів мала, тому що атоми другого компонента, яких мало, мають в якості найближчих сусідів переважно атоми першого компонента.
Легко впевнитись, що відповідність дійсності формули (2.77) означає незалежність ентальпії утворення розчину від температури
(DHр¹DHр(Т) ). Оскільки S=Sід, надлишкова ентропія DS=0 (порівняно з ідеальним розчином). Отже,
DG=DH-TDS=DH, DGA=DHA, DGB=DHB, DHід=0, DHр=DH,
DS=(дDH/дТ)Р=0, DHA¹DHA(Т), DHB¹DHB(Т).
Згідно із формулою (2.80),
DG= DGp - DGід = x1RT ln f1 + x2 RT ln f2 .
75

Тому HA= GA= RT ln f1 , HB = RT ln f2 – значення парціальної
надлишкової ентальпії визначають значення коефіцієнтів активностей:
f1=exp( H1/RT), f2=exp( H2/RT). |
(2.81) |
2.7.8.Основні уявлення квазіхімічної теорії розчинів
Уквазіхімічній теорії потенціальну енергію розчину виражають через енергії парної взаємодії атомів V11 ,V22 , V12 (усі вони від’ємні),
враховуючи кількості відповідних пар:
E = N11V11 + N22V22 + N12 ×V12 . |
(2.82) |
Загальне число різних пар обумовлено середньою кількістю найближчих сусідів (координаційне число z):
z N = z(N1 + N2 ) = N11 + N12 + N22 .
2 2
Число зв’язків атомів одного та іншого сортів теж визначається значенням координаційного числа
z |
N1 |
= N11 + |
1 |
N12 , |
z |
N2 |
= N22 |
+ |
1 |
N12 . |
(2.83) |
|
2 |
|
2 |
||||||||
2 |
|
|
2 |
|
|
|
|
||||
Звідси знаходимо зв’язки між кількостями пар атомів
N11 |
= |
zN1 − N12 |
, |
N22 |
= |
zN2 − N12 |
. |
|
|
||||||
|
2 |
|
|
2 |
|
||
Позначимо через Е0 енергію зв’язку компонентів у первісному стані (до змішування) – E0 = 21 zN1V11 + 21 zN2V22 .
Перепишемо енергію розчину у наступному вигляді
E = |
1 |
zN V + |
1 |
zN V + N |
|
ε |
|
, |
||
2 |
2 |
|
|
|||||||
|
1 |
11 |
2 |
22 |
12 |
|
12 |
|
||
де ε12=V12 – (V11+ V22)/2. Тому енергія утворення розчину |
||||||||||
|
|
H=E – E0= N12ε12 . |
|
|
|
(2.84) |
||||
Основним методом знаходження структур розчинів у рівноважному стані є мінімізація виразів для потенціалів Гіббса або Гельмгольца. Можна відразу знаходити рівноважні значення кількостей пар, або рівноважні значення так званих апостеріорних ймовірностей то-
76
го, що розглядувана пара атомів є тою або іншою. Якщо є можливість виразити всі кількості пар через один параметр упорядкування [2], то мінімізація виразів для вільної енергії проводиться за цим параметром і визначається його рівноважне значення.
Якщо розчин зовсім невпорядкований (регулярний розчин – нема кластеризації), число пар атомів N12 залежить тільки від концентрації:
N12=(x1(zN/2)·w12+x2(zN/2)·w21= (x1 x2 +x2 x1)(zN/2)= x1 x2 zN.
(w12 і w21 – імовірності мати у якості сусіда атом іншого сорту).
Тому
DH = x1 x2 zN e12= x1 x2 А. |
(2.85) |
Для розчину з певною концентрацією величина DH пов’язана з парціальними надлишками – DH = x1DH1+ x2DH2 , DH1=`H1 – H10, DH2=`H2 – H20. З геометричних міркувань (см. рис. 2.12) їх можна виразити через нахил дотичної до кривої Н(х):
DH1=DH – (1–х1)×(dDH/dх2) = (1–х12) А=х22А, DH2=DH – (1–х2)×(dDH/dх1) = (1–х22) А=х12А.
Враховуючи (2.81), запишемо для коефіцієнтів активності компонентів у випадку регулярних розчинів :
f1= exp(х22А/RT), |
f2= exp(х12А/RT). |
(2.86) |
2.7.9. Розрахунок міжатомних енергій зв’язку
Для регулярних розчинів можна знайти вираз для коефіцієнта розподілу к = xs2 / xl2 за аналогією зі співвідношенням (2.79), виходячи
із записів для зміни потенціалів Гіббса при утворені рідкого та твердого розчинів. В ці рівняння входять константи Al та As, пов’язані з надлишковими енергіями es12 та el12 для кристалічної та рідкої фаз.
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DGlѓ = DH ѓК1 xl |
|
|
1 |
- |
|
|
|
|
+ xl |
|
xl |
|
К2 Al |
+ xl |
|
RT ln xl |
|
+ xl |
xl |
2 Al |
+ xl |
RT ln xl , |
|
|||
1 |
T |
1 |
|
1 |
1 |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
1 |
|
|
2 |
2 |
|
||||||||
|
|
|
|
|
|
|
ďë 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DGsѓ = DH ѓК2 xs |
2 |
1 |
- |
|
|
|
|
+ xs |
xs |
К2 As |
+ xs |
RT ln xs |
+ xs |
xs |
2 As + xs |
RT ln xs |
, |
|||||||||
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
Tďë 2 |
|
|
|
1 |
|
|
2 |
|
|
1 |
|
1 |
2 |
|
1 |
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
77 |
|

де Hплμ |
1 , H плμ |
2 – |
молярна теплота плавлення 1-го та 2-го компонен- |
тів відповідно; |
Al |
= NAzlεl 12 As = NAzsεs 12 – теплоти змішування, в |
|
рідкому і твердому станах відповідно; NA – число Авогадро; zl , zs – число найближчих сусідів в рідкому і твердому станах відповідно;
εl12=(V12–V11/2–V22/2)l, εs12=(V12–V11/2–V22/2)S – надлишкові енер-
гії парної взаємодії; V11, V22, V12 – потенціальні енергії парної взаємодії (енергії зв’язку).
Згідно з умовою фазової рівноваги µ s1=µ l 1, µ s2=µ l 2. Прирівняємо похідні за відповідними концентраціями від записаних виразів для вільної енергій утворення розчинів і прийдемо до рівняння
x |
x |
l1 |
|
= − |
|
ln |
|
s2 |
|
||
|
|
|
|||
|
|
|
|
|
|
xl2 xs1 |
|
|
|||
(1 − 2xl2 )zlεl 12
kT
Hпл |
|
1 |
− |
1 |
|
+ |
1 |
|
|
|
|
||
|
|
|
||||
k |
|
|
|
Tпл1 |
|
|
T |
|
|
|
|||
+ (1 − 2xs2 )zsεs 12 kT
H |
пл2 |
|
1 |
− |
1 |
|
− |
|
|
|
|||||
|
|
|
|
||||
k |
|
|
|
Tпл2 |
|
|
|
T |
|
|
, |
||||
|
|
|
|
|
|
|
|
де H1пл , H2 пл – теплоти плавлення 1-го та 2-го компонентів у ро-
зрахунку на 1 атом. Наближений варіант цього рівняння за умови, що концентрація одного з компонентів дуже мала, наведений в [3]. Оскільки надлишкові енергії пов’язані зі значеннями енергій парних взаємодій Vij, то діаграмні дані про значення рівноважних концентрацій рідкої й твердої фази можна використовувати для знаходження значень енергії Vij. Зрозуміло, що для знаходження двох надлишкових енергій треба брати значення концентрацій для двох температур і розв’язувати систему двох трансцендентних рівнянь. Таку роботу краще доручити комп’ютеру. Автори цієї книги склали й використовували таку програмку з інтерфейсом, розробленим засобами Delphi. Знайдені значення енергій Vij були потрібні для моделювання за методом Монте-Карло. Розрахунки проводилися з використанням декількох концентрацій, що не перевищували 10 ат. % за другим компонентом. Приймалося, що енергія взаємодії різнойменних атомів крізь міжфазну поверхню дорівнювала енергії їх взаємодії у розплаві,
Vsl12 = Vll12.
78
Розділ 3.
ПРОЦЕСИ ПЕРЕНЕСЕННЯ. ДИФУЗІЙНІ ЗАДАЧІ РОСТУ КРИСТАЛІВ. ПРИНЦИПИ ЧИСЕЛЬНОГО РОЗВ’ЯЗКУ РІВНЯНЬ ТЕПЛО- И МАСОПЕРЕНЕСЕННЯ
3.1. Процеси перенесення
Дуже багато фізичних явищ, що використовуються в технологіях виробництва матеріалів для машино- і приладобудування пов'язані з процесами переносу тепла і речовини, у тому числі і з конвекційним переносом. Ці процеси описуються диференційними рівняннями другого порядку в частинних похідних. Їхні розв’язки залежать від початкових і граничних умов. Аналітичні рішення можна одержати тільки для простих граничних умов: за постійних значень температури і концентрації на незмінних за формою поверхнях, що розділяють різні стани речовини.
3.1.1. Дифузія
Нехай у деякій речовині є домішки інших речовин. Внаслідок хаотичного руху молекули переходять з одних місць на інші і при цьому переносять себе і свою масу. Якщо в речовині концентрація молекул домішок неоднорідна, то з часом вона вирівнюється. Це явище зветься дифузією. З макроскопічного погляду явище дифузії визначається законами Фіка. Згідно з першим законом Фіка, кількість ре-
човини, що переноситься через деяку площинку δS, перпендикулярну до осі x, у напрямку цієї осі, пропорційна градієнтові концентрації речовини домішки dC/dx, площі площинки δS і часу dt:
dM=– D(dC/dx) δS dt. |
(3.1) |
Градієнт концентрації характеризує швидкість зміни якоїсь фізичної величини у певному напрямку. Знак “ мінус” у цій формулі означає, що речовина переноситься в бік зменшення її концентрації (чи густини). Кількість речовини dМ вимірюється
в одиницях, що відповідають концентрації: кг/м3, моль/м3, або числом молекул в одиниці об’єму. Коефіцієнт дифузії D має розмірність м2/с.
Якщо перший закон Фіка є результатом узагальнення численних експериментальних результатів, то другий закон записується як умо-
79

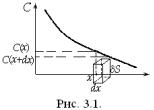
ва збереження речовини. Розглянемо деякий малий простір між двома площинками з однаковою площею dS, які мають координати х і х+dх (рис. 3.1). Через першу площинку за час dt в розглядуваний об’єм входить кількість речовини
dM1=-D(x) (dC/dx)x dS dt |
(3.2) |
(вона може бути і від’ємною, тобто насправді виходить, а не входить).
Через другу площинку виходить кількість речовини
dM2=-D(x+dx)(dC/dx)x+dx dS dt. |
(3.3) |
Якщо dM1¹dM2, то концентрація речовини в малому розглядуваному об’ємі змінюватиметься:
dC = dM1 − dM2 = dxδS
= D(x + dx)(dC /dx)x+ dx − D(x)(dC /dx)x dt. dx
З останньої формули випливає співвідношення
¶C |
|
¶ |
¶C |
|
¶t |
= |
|
D |
, |
|
||||
|
¶x |
¶x |
||
(3.4)
(3.5)
яке зветься другим законом Фіка. Це диференційне рівняння другого порядку в частинних похідних має дуже велике значення: воно є одним з основних рівнянь математичної фізики.
Якщо коефіцієнт дифузії не залежить від координат (через С(х)), то замість (3.5) можна записати
(дC/дt)=D(д2C/дx2). (3.6)
Узагальнення цього рівняння для випадку залежності концентрації від трьох координат х, у і z приводить до формули
(дC/дt)=D[(д2C/дx2)+(д2C/дy2)+(д2C/дz2)]=DÑ2C, (3.7)
де Ñ2=д2/дx2+д2/дy2+д2/дz2 - оператор Лапласа, який позначається ще так: DºÑ2.
На підставі рівняння (3.7) можна дізнатися про зміну концентрації з часом в усіх точках деякого об’єму. Для встановлення залежності концентрації від однієї координати достатньо розглядати рівняння (3.6) або (3.7). Наприклад, у разі з’єднання двох прутиків, в одному з яких є два компоненти А і В, причому концентрація В-компонента дорівнює Сo, а в іншому прутику є тільки A-компонент, на їх межі
80
