
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
Ранние модели строения комплексов, предложенные такими учеными, как Грем (1837г.), Клаус (1854г.), Бломстранд (1869г.) и Йоргенсен (1878г.) имеют в настоящее время только историческое значение. Наиболее разработанной была теория Бломстранда- Йоргенсена. Ее важнейшие положения формулировались следующим образом:
Для некоторых элементов допускалась валентность выше, чем обычно принятая. Например, считалось, что галогенидные ионы могут быть трехвалентными, кислород – четырехвалентным, а азот – пятивалентным. Напротив, валентность центральных металлических атомов считалась традиционной.
Ради сохранения валентности центрального атома в комплексных соединениях (по аналогии с органическими молекулами) допускалась возможность цепочечного сочетания таких элементов, как хлор, кислород, азот и др. Например, кристаллогидраты и аммиакаты представлялись в виде:
М – ОН2 – ОН2 – ОН2 –… М – NH3 – NH3 – NH3 –…
Экспериментально установленное различие между кислотными остатками объяснялось различным способом их связывания в комплексе. Если кислотные остатки связаны непосредственно с центральным атомом ("неионогенно"), то подобно молекулам аммиака, они не отделялись в растворах в виде ионов. "Ионогенные" связи, по которым возможна диссоциация, устанавливаются на концах цепи. Например, PtCl2·4NH3, полностью отделяющий в растворе ионы хлора, мог быть изображен в виде
 .
.
Останавливаться на подробном анализе этих идей нет большой необходимости. Достаточно отметить, что они не давали непротиворечивого объяснения таким хорошо известным на тот момент свойствам комплексов, как изомерия и особенности поведения в растворах.
Все эти недостатки были преодолены, достигнуты колоссальные успехи в объяснении и даже предсказании состава, структур и некоторых свойств комплексов в рамках координационной теории, изложенной А.Вернером в серии работ (1893г., 1895г., 1911г. – открытие оптической изомерии комплексов).20
Изучая поведение аммиакатов и сложных галогенидов в растворах, он пришел к выводу, что между их составными частями происходит перегруппировка атомов и групп атомов. При этом зачастую меняется и характер связи: связи неионогенные (по которым не наблюдался распад на ионы раньше) становятся ионогенными и наоборот. Например, в растворе PtCl4 очень плохо (медленно, не количественно) проходят реакции осаждения ионов хлора (связи Pt–Cl неионогенны, хорошо сохраняются в растворе), а после упаривания кристаллизуется вещество состава PtCl4·2Н2О. Однако после кипячения соответствующего раствора с избытком аммиака хлорид ионы легко обнаруживаются (связи Pt–Cl ионогены, ослаблены). Кристаллизующаяся фаза имеет состав PtCl4·6NН3 (учитывая, что в растворе данного соединения отсутствует щелочная среда, можно предположить, что молекулы аммиака прочно связаны с атомом платины). В свою очередь, если обработать эти кристаллы избытком соляной кислоты, то можно получить кристаллы PtCl4·2NH4Cl, которые в водном растворе вновь практически не отщепляют ионов хлора (связи Pt–Cl вновь стали неионогенными, атомы платины оказываются в составе новой достаточно стабильной многоатомной частицы). Подобные соединения, содержащие сложные по-новому организованные многоатомные группировки, сохраняющие стабильность и в водных растворах, А.Вернер предложил называть комплексными (координационными) соединениями, в отличие от двойных солей.
Например, в растворе алюмокалиевых квасцов с помощью качественных реакций легко можно обнаружить все ионы; один моль вещества (при написании формулы – K2SO4∙Al2(SO4)3∙24H2O) дает 8 моль ионов. Правда в растворе квасцов, также как и в растворе сульфата (и большинства других солей) алюминия обнаруживается кислая среда. Это свидетельствует об изменении свойств молекул воды под влиянием ионов Al3+. В пользу этого вывода говорит и то, что многие соли алюминия гигроскопичны, часто кристаллизуются из растворов в виде кристаллогидратов: Al2(SO4)3∙18H2O, Al(NO3)3∙9H2O, AlГ3∙6H2O (Г: Cl, Br, J). Эти особенности солей алюминия А.Вернеру поздней удалось объяснить на основе координационной теории и химической теории растворов Д.Менделеева, как результат сильной гидратации ионов Al3+ (образование прочных аквокомплексов).
В то же время, в растворе 2KJ∙HgJ2 очень трудно выполнить качественные реакции на
ионы
J–:
2 KJ(р-р)
+ Pb(NO3)2
(р-р)
![]() PbJ2↓
+ 2 KNO3
(р-р)
PbJ2↓
+ 2 KNO3
(р-р)
2KJ∙HgJ2
(р-р) +
Pb(NO3)2
(р-р)
![]() нет признаков реакции
нет признаков реакции
и
Hg2+:
Hg(NO3)2
(р-р) + КОН
(р-р)
![]() HgО↓
+ Н2О
+ КNO3
(р-р)
HgО↓
+ Н2О
+ КNO3
(р-р)
2KJ∙HgJ2
(р-р) +
КОН (р-р)
![]() нет признаков реакции
нет признаков реакции
Учитывая, что мольная электропроводность раствора KJ∙HgJ2 соответствует наличию в растворе трех моль ионов, можно предложить следующий вариант реакции диссоциации:
2KJ∙HgJ2
(р-р)
![]() HgJ42–
(р-р) + 2
К+(р-р)
HgJ42–
(р-р) + 2
К+(р-р)
По словам А.Вернера "ионогенные связи K–J сменились на неионогенные Hg–J".
Подобные эксперименты с другими соединениями высшего порядка позволили А.Вернеру сделать вывод о том, что атомы многих элементов (в основном металлических) после насыщения обычно присущих им (основных) валентностей способны проявить еще и дополнительную – побочную, координационную.21
Образованные за счет этого устойчивые в растворах сложные частицы составляют внутреннюю сферу соединения (комплекс). В его составе принято выделять центральный (обычно положительно заряженный) атом (комплексообразователь) и координированные вокруг него лиганды (L). Ионы, напрямую не связанные с центральным атомом, составляют внешнюю сферу комплекса и легко отделяются при растворении в воде. С учетом этих соображений приведенные выше формулы необходимо записывать следующим образом (табл.4.2):
Таблица 4.2
Варианты написания формул некоторых комплексных соединений
|
старая формула |
координационная формула |
|
старая формула |
координационная формула |
|
Fe(CN)3·3KCN |
K3[Fe(CN)6] |
|
HgJ2·2KJ |
K2[HgJ4] |
|
PtCl4·2KCl |
K2[PtCl6] |
|
KCl·CuCl |
K[CuCl2] |
|
CoCl3·6NH3 |
[Co(NH3)6]Cl3 |
|
Fe(CN)2·4KCN |
K4[Fe(CN)6] |
|
2PtCl2·4NH3 |
[Pt(NH3)4][PtCl4] |
|
AgCl∙2NH3 |
[Ag(NH3)2]Cl |
|
Fe(CN)3·2NaCN·NO·2H2O |
Na2[Fe(CN)5NO]·2H2O |
|
Cu(NO3)2∙4NH3 |
[Cu(NH3)4](NO3)2 |
|
PtCl2·2CO |
[PtCl2(CO)2] |
|
PtCl2·4NH3 |
[Pt(NH3)4]Cl2 |
|
Ni·4CO |
[Ni(CO)4] |
|
PtCl4·2Н2О |
[PtCl4(OH2)2] |
|
Fe(CN)3·Fe(CN)2·KCN |
K[Fe2(CN)6] |
|
PtCl4·6NН3 |
[Pt(NH3)6]Cl4 |
В ряде случаев в комплексах отчетливо наблюдается влияние природы комплексообразователя на прочность связывания атомов в сложных лигандах.22 Подробней эти вопросы будут рассмотрены в гл.4.4.7, а сейчас разберем лишь несколько примеров. Как отмечалось на стр.239, в растворах солей алюминия всегда наблюдается кислая среда, что свидетельствует о дополнительном ослаблении связей Н–О (усиливается их ионность, "ионогенность") и увеличении концентрации ионов Н+ за счет равновесий типа
[Al(OH2)6]3+ ⇄ [AlOH(OH2)5]2+ + Н+.23
В растворах солей некоторых d–металлов подобные реакции гидролиза протекают более глубоко. Например, при добавлении сульфата калия в раствор PtCl4 можно выкристаллизовать K2[PtCl4(OH)2], а из раствора AuCl3 в зависимости от рН (при частичной нейтрализации кислой среды раствором КОН) могут быть получены K[AuCl3OH] или даже K2[AuCl3O].
Влияние природы центрального атома на прочность связывания с лигандами, что, в свою очередь отражается на связях в молекулах аммиака можно наблюдать и на примере аммиакатов.
Аммиак в водном растворе создает щелочную среду за счет взаимодействия с молекулами воды:
NH3 + H2O ⇄ NH4+ + OH–
В растворе [Ag(NH3)2]NO3 среда нейтральная, т.к. свободных молекул аммиака практически нет. Но из состава комплекса [Ag(NH3)2] + их можно вывести в реакции с ионами H+:
[Ag(NH3)2]+ + 2H+ = Ag+ + 2NH4+
А комплекс [Co(NH3)6]3+ стабилен к действию кислот. Более того, в растворе [Co(NH3)6]Cl3 наблюдается слабокислая среда. За счет прочного связывания атома азота с центральным атомом ослабевает связь N–H в молекуле аммиака:
[Co(NH3)6]3+ ⇄ [Co(NH3)5NH2]2+ + H+.
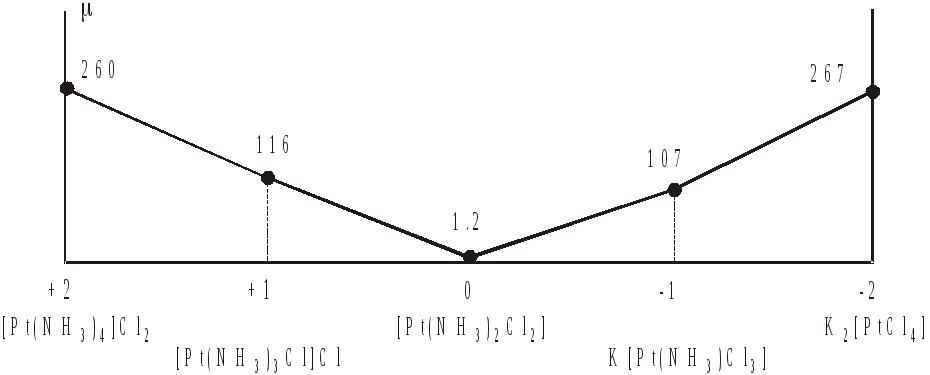
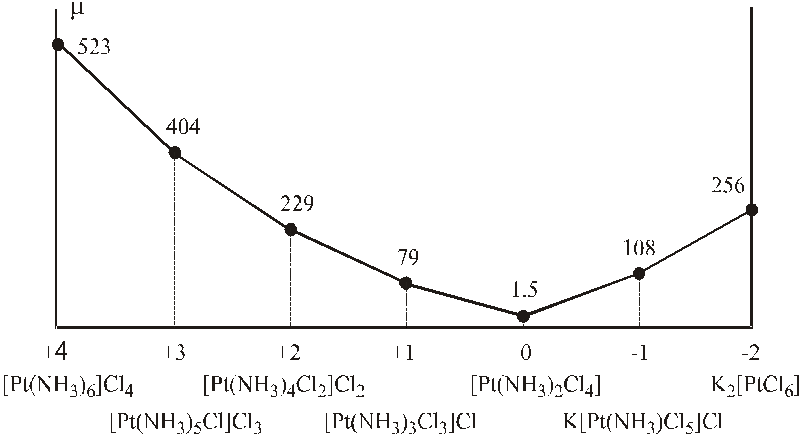
Дополнительную информацию об особенностях формирования внутренних сфер комплексов А.Вернер получил, изучая электропроводность их растворов.24 В 1893г. вслед за изложением основных положений координационной теории была опубликована статья Вернера и Миолати, в которой на основе исследования электропроводности растворов комплексных аммиакатов были даны яркие доказательства ее справедливости. Вначале были определены интервалы значений молярной электропроводности солей типа 1:1 (например, NaCl), 1:2 и 2:1 (CaCl2, K2SO4), 1:3 и 3:1 (AlCl3, Na3PO4). После чего по значению проводимости можно было определить тип того или иного электролита среди комплексных изучаемых соединений. В таблицах 4.4 и 4.5, а также на рис. 4.20 и 4.21 показаны результаты изучения проводимости растворов "двойных хлоридов двух- и четырехвалентной платины" (PtCl2·2KCl и PtCl4·2KCl) по мере их насыщения аммиаком ("переходные ряды Вернера–Миолати"), а также предложенная авторами интерпретация.
Таблица 4.3
Значение молярной электропроводности (при 25°С)
в зависимости от типа электролита
|
Тип электролита |
Интервал значений молярной электропроводности, см2/Ом·моль |
|
0 1 : 1 1 : 2, 2 : 1 1 : 3, 3 : 1 1 : 4, 4 : 1 |
0 – 5 97 – 110 230 – 268 352 – 427 430 – 560 |
Таблица 4.4
Молярная электропроводность растворов (25°С)
в зависимости от состава комплексов Pt(II)
|
Старая формула |
Молярная электропроводность, Ом-1·см2·моль-1 |
Тип электролита |
Координационная формула |
|
PtCl2·2KCl |
267 |
1:2, 2:1 |
K2[PtCl4] |
|
PtCl2·NH3·KCl |
107 |
1:1 |
K[Pt(NH3)Cl3] |
|
PtCl2·2NH3 |
1.2 |
неэлектролит |
[Pt(NH3)2Cl2] |
|
PtCl2·3NH3 |
116 |
1:1 |
[Pt(NH3)3Cl]Cl |
|
PtCl2·4NH3 |
260 |
1:2, 2:1 |
[Pt(NH3)4]Cl2 |
-
Рисунок 4.20 – Диаграмма молярной электропроводности соединений ряда [Pt(NH3)4]Cl2 – K2[PtCl4] (по оси абсцисс отложен заряд комплексного иона).
Таблица 4.5
Молярная электропроводность растворов (25°С)
в зависимости от состава комплексов Pt(IV)
|
Старая формула |
Молярная электропроводность, Ом-1·см2·моль-1 |
Тип электролита |
Координационная формула |
|
PtCl4·2KCl |
256 |
1:2, 2:1 |
K2[PtCl6] |
|
PtCl4·NH3·KCl |
108 |
1:1 |
K[Pt(NH3)Cl5] |
|
PtCl4·2NH3 |
1.5 |
неэлектролит |
[Pt(NH3)2Cl4] |
|
PtCl4·3NH3 |
97 |
1:1 |
[Pt(NH3)3Cl3]Cl |
|
PtCl4·4NH3 |
229 |
1:2, 2:1 |
[Pt(NH3)4Cl2]Cl2 |
|
PtCl4·5NH3 |
404 |
1:3, 1:3 |
[Pt(NH3)5Cl]Cl3 |
|
PtCl4·6NH3 |
523 |
1:4, 4:1 |
[Pt(NH3)6]Cl4 |
|
Рисунок 4.21 – Диаграмма молярной электропроводности соединений ряда [Pt(NH3)6]Cl4 – K2[PtCl6] (по оси абсцисс отложен заряд комплексного иона). |
Результаты этих экспериментов совместно с опытами по количественному обнаружению тех или иных ионов в растворах комплексов (см. стр. 6,7) позволили сделать несколько важных выводов:
состав внутренней сферы комплексов во многих случаях может обратимо меняться в результате конкурентной замены лигандов;
суммарное число координированных лигандов для данного комплексообразователя обычно сохраняется неизменным.25 Для его характеристики было введено понятие координационное число комплексообразователя. Наиболее распространенными координационными числами (КЧ) оказались 6 и 4. Реже встречаются комплексы с КЧ, равными 2. Позднее были получены комплексы, центральные атомы которых характеризовались КЧ =8 и другими, в том числе, нечетными: 3, 5, 7 и др.
Самостоятельным разделом координационной теории Вернера стало изучение, обоснование и предсказание пространственного расположения лигандов вокруг комплексообразователя. Задолго до появления методов прямого экспериментального изучения структуры Вернер правильно объяснил и предсказал геометрическую форму многих комплексных соединений. При этом он, подобно химикам-органикам,26 руководствовался числом возможных изомеров и некоторыми их свойствами (внешний вид, оптическая активность, растворимость и т.п.27). Вернер постулировал, что комплексы, содержащие одинаковые лиганды симметричны и характеризуются одинаковыми длинами связей. Поэтому при КЧ = 4 (ML4) они должны иметь или плоскую квадратную форму, или объемную тетраэдрическую. Реальное пространственное строение по наличию тех или иных изомерных форм можно установить при наличии разносортных лигандов ([M(L1)2(L2)2], [M L1L2L3 L4] или [M(LAB)2]).28 В частности Вернер показал наличие цис/трас-изомерии для комплексов Pt(II) и Pd(II) с общей формулой [M(L1)2(L2)2], например, [Pt(NH3)2Cl2] и, тем самым, доказал плоско-квадратное центрального атома. Кроме того, вывод о пространственном строении комплексов соответствующих металлов был подкреплен синтезом двух геометрических изомеров типа [M(LAB)2], не обладающих оптической активностью (не расщепляющихся на оптические изомеры).
Условия, при которых тетраэдрическая координация реализуется предпочтительней, чем октаэдрическая или квадратная, достаточно ограничены (см. гл.4.5). Но, в то же время, такая структура надежно установлена для многих комплексов Zn(II), Cu(I), Al(III), Fe(III), Be(II), B(III), Co(II) и ряда других элементов. Тетраэдрическую симметрию имеют и оксоанионы d–металлов в высоких степенях окисления: TiO44-, VO43-, CrO42-, MnO4- и некоторые другие.
Высокосимметричные комплексы состава [ML6] могут иметь гексагональную (типа бензола), октаэдрическую тригонально-призматическую форму (рис.4.22).
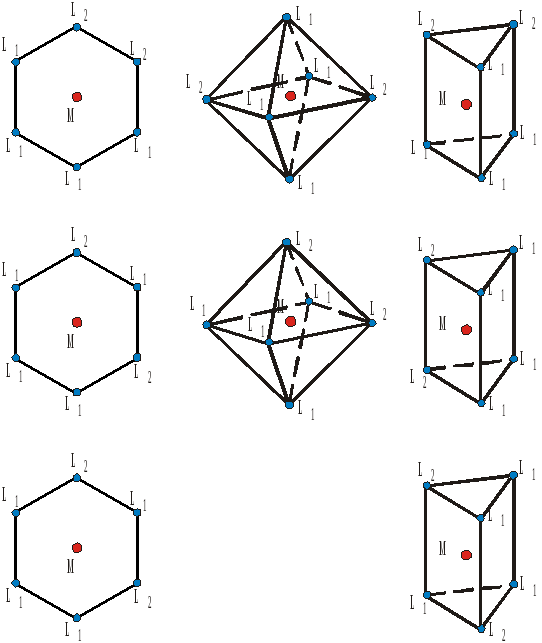
-
Рисунок 4.22 – Варианты изомеров в группировках [M(L1)4(L2)2] при разных формах координационных сфер.
При замещении в исходном комплексе двух лигандов ([M(L1)4(L2)2]), который, будучи плоским, должен иметь три изомера (мета-, пара-, орто-); в случае треугольной призмы также возможны три разных варианта размещения лигандов (см. самостоятельно); при октаэдрической конфигурации имеется лишь два пространственных изомера (табл.4.6).
Таблица 4.629
Число теоретически возможных и экспериментально
полученных изомеров комплексов с КЧ=6
|
Состав комплекса |
Теоретически возможное число изомеров |
Эксперимент | ||
|
Плоский шестиугольник |
Тригональная призма |
Октаэдр | ||
|
MA5B |
1 |
1 |
1 |
1 |
|
MA4B2 |
3 |
3 |
2 |
2 |
|
MA3B3 |
3 |
3 |
2 |
2 |
В результате тщательных экспериментов Вернеру удалось получить лишь по два изомера комплексов [Co(NH3)4Cl2]Cl и [Pt(NH3)3Cl3]Cl, что дало ему основание утверждать об их октаэдрическом пространственном строении.30
В конце этого краткого обзора напомню, что речь идет о мыслях, идеях, высказывавшихся на рубеже XIX–XXвв, когда еще ничего не было известно о существовании электрона, не было никаких объективных сведений о структуре атома. Естественно, что все современные теории химической связи также были разработаны много позднее. Поэтому нет большого смысла подробно обсуждать взгляды А.Вернера на возможную природу "обычной" и "побочной" или "координационной" валентности. Но такие понятия, сформулированные в координационной теории А.Вернера, как комплексообразователь, лиганд, координационное число, внутренняя и внешняя сфера комплексов, пространственное строение комплексов активно используются и в современной химии координационных соединений.
