
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
4.5.2.4 Недостатки ткп
Теория кристаллического поля адекватно объясняет большое число разнообразных данных (часть из них не была затронута, для более полного ознакомления следует обратиться к литературе [1,2,3]). В то же время ее основной постулат о чисто электростатической природе взаимодействия комплексообразователь–лиганд является слишком большим упрощением. Как следствие, в рамках ТКП нет удовлетворительного ответа даже на такой очевидный и принципиальный вопрос: почему максимальное "электростатическое" воздействие на орбитали центрального атома оказывает нейтральная молекула СО, дипольный момент которой практически равен нулю? В более широком плане можно сказать, что отказ от учета электронной структуры лигандов приводит к принципиально невозможности рассмотрения и анализа многочисленных свойств комплексов, которые зависят от орбиталей лиганда, от межэлектронного взаимодействия M–L. В частности, ТКП не может объяснить поглощение в УФ части спектра (полосы переноса заряда), а значит и окраску соединений переходных элементов с электронными конфигурациями d0 и d10. ТКП неприменима к π–комплесам с многоцентровыми орбиталями лигандов (С5Н5–, С6Н6…). Не учитывая возможность ковалентного взаимодействия, ТКП не может объяснить предпочтительного связывания тех или иных d–металлов с лигандами π–донорами (π–акцепторами). В рамках ТКП есть возможность или напрямую рассчитать энергию расщепления, или определить ее на основе спектров поглощения, но нельзя объяснить, почему она в каких-то случаях мала, а в каких-то – велика. Расположение лигандов в спектрохимическом ряду может быть обосновано методом молекулярных орбиталей.
4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
Поскольку расчеты по методу молекулярных орбиталей гораздо более трудоемки, чем в ТКП, поначалу были предприняты попытки частичного учета ковалентной составляющей взаимодействия M–L, соответственно были разработаны, так называемые модифицированная теория кристаллического поля (МТКП), теория поля лигандов (ТПЛ). Однако по мере развития электроники и вычислительной техники все большее распространение в описании свойств даже таких многоатомных систем как координационные соединения стал получать метод молекулярных орбиталей (ММО), основанный на применении полных волновых функций комплекса как целого.
Чтобы строго определить, взаимодействие каких орбиталей возможно с точки зрения симметрии (какие орбитали составят базис соответствующей волновой функции), следует применить принципы теории групп. В рамках данного учебника мы не сможем обсуждать этот математический аппарат, а ограничимся лишь некоторыми общими соображениями и описанием результатов, которые можно получить при использовании теории групп для октаэдрических комплексов (позже вкратце обсудим схему молекулярных орбиталей для тетраэдрического окружения), используем ее для качественного обоснования спектрохимического ряда лигандов.
Рассмотрим
вначале схему формирования МО для
описания октаэдрического комплекса
[ML6]
без π–связывания
(лигандами в этом случае могут
подразумеваться молекулы :NH3,
:P(CH3)3,
в некотором смысле Н2![]() и т.п.). Основным методом конструирования
волновой функции МО является линейная
комбинация атомных орбиталей (ЛКАО). От
центрального атома в σ–взаимодействии
в октаэдрическом комплексе могут
участвовать шесть орбиталей (объяснялось
ранее при обсуждении МВС): s,
px,
py,
pz,
dx2-y2
и dz2.
Атомные (возможно – гибридизованные)
орбитали лигандов, подходящие по
симметрии для σ–перекрывания
вначале комбинируются. При этом
получаются, так называемые, волновые
функции групповых орбиталей ΨL:
и т.п.). Основным методом конструирования
волновой функции МО является линейная
комбинация атомных орбиталей (ЛКАО). От
центрального атома в σ–взаимодействии
в октаэдрическом комплексе могут
участвовать шесть орбиталей (объяснялось
ранее при обсуждении МВС): s,
px,
py,
pz,
dx2-y2
и dz2.
Атомные (возможно – гибридизованные)
орбитали лигандов, подходящие по
симметрии для σ–перекрывания
вначале комбинируются. При этом
получаются, так называемые, волновые
функции групповых орбиталей ΨL:
ΨL = с1·Ψ1 + с2·Ψ2 + с3·Ψ3 + с4·Ψ4 + с5·Ψ5 + с6·Ψ6 , (4.22)
где Ψi – атомные орбитали лигандов; сi – коэффициенты, отражающие вклад каждой орбитали в данную групповую орбиталь лигандов.
Затем готовят выражение для волновой функции, описывающей энергию взаимодействия определенной орбитали центрального атома (в ряде случаев они тоже гибридизуются, группируются) с данной групповой орбиталью лигандов:
ΨМО = а·ΨМ ± b·ΨL , (4.23)
где ΨМ – волновая функция атомной орбитали металла; а и b – коэффициенты, отражающие вклад ΨМ и ΨL в делокализованную (связывающую или разрыхляющую) молекулярную орбиталь комплекса.
Если какие-то орбитали или центрального атома или лигандов окажутся по соображениям симметрии неспособными комбинировать с орбиталями партнера, то они остаются неизменными, несвязывающими, как, например, орбитали dε (dxy, dxz, dyz) в октаэдрических комплексах без π–связывания.
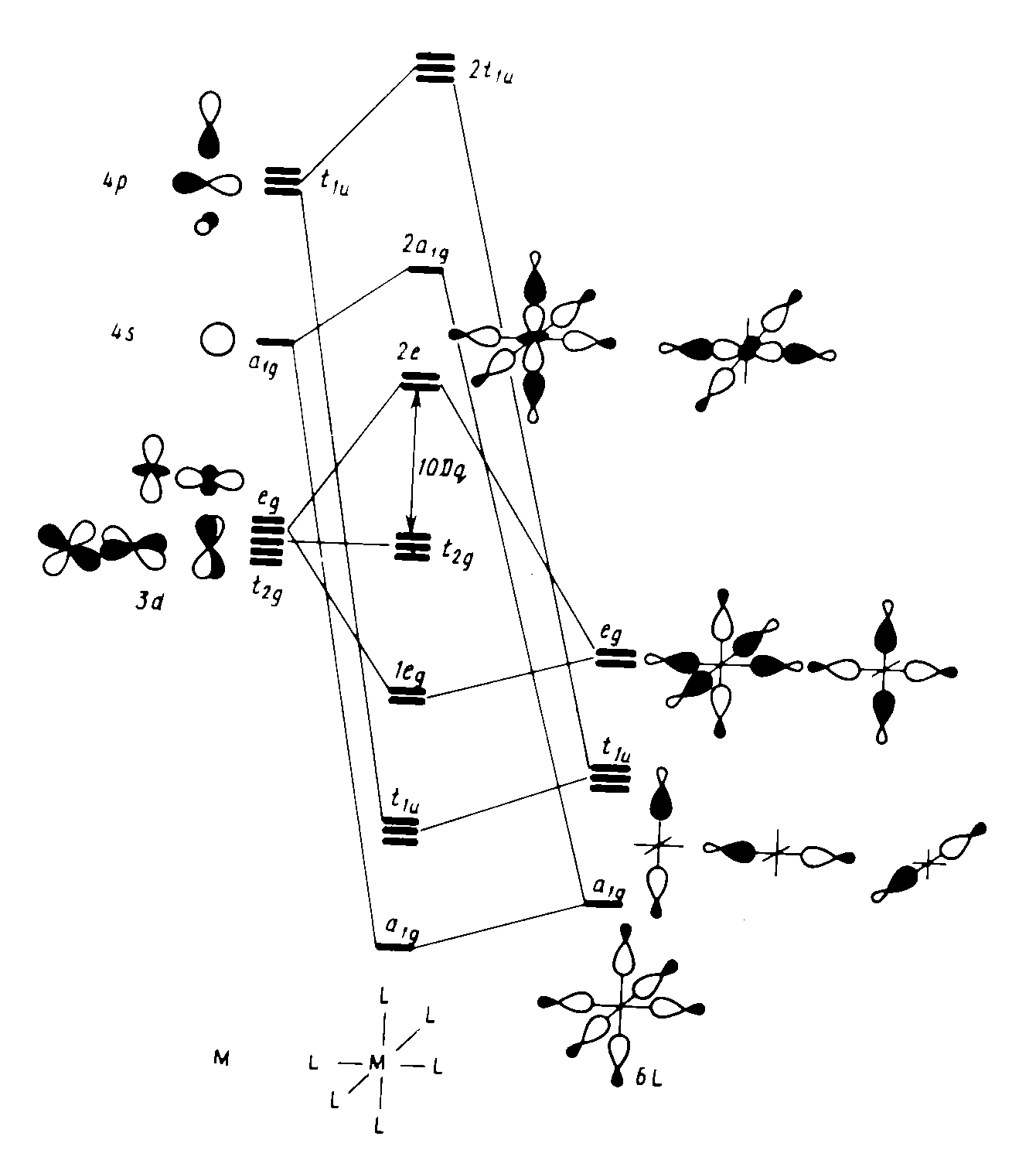
а б в
|
Рис.4.34 – Корреляционная диаграмма МО октаэдрического комплекса [ML6], построенная с использованием АО металла и групповых орбиталей лигандов (а) и схемы распределения электронов по МО: высокоспинового комплекса [CoF6]3– (б) и низкоспинового комплекса [Co(NH3)6]3+ (в). |
На рисунке 4.34 показана схема возникающих в подобных комплексах молекулярных орбиталей и влияние природы лигандов на энергию расщепления между высшими содержащими электроны группами МО: πнесв – несвязывающими орбиталями центрального атома и σ* – разрыхляющими МО, в волновые функции которых основной вклад дают dγ–орбитали металла (в рамках ТКП эти орбитали были бы чистыми орбиталями комплексообразователя: dε и dγ, соответственно). Энергия октаэдрического расщепления зависит с точки зрения ММО от таких факторов, как прочность σ–взаимодействия, а также – от возможности и донорно-акцепторного способа образования дополнительных π–связей между металлом и лигандами. Полная схема МО в октаэдрических комплексах с π–связями, во-первых, весьма сложна, а, во-вторых, не может быть универсальной, т.к. от типа лигандов сильно зависит степень выраженности того или иного варианта π–перекрывания: при обсуждении МВС упоминались такие, как πd(M)→p(L), πd(M)→d(L), πp(M)←p(L), πd(M)←p(L); теперь к ним нужно добавить и взаимодействие с вакантными разрыхляющими π*-молекулярными орбиталями таких потенциальных лигандов-π–акцепторов, как С2Н4, CN–, P(C6H5)3, CO, C5H5– и т.п.: πd(M)⇄π*(L) (рис.4.35). Подробно этот вопрос мы разбирать не станем, отметим лишь, что при условии прочного σ–связывания центральный атом может в π–перекрывании задействовать по сути только dε–орбитали. В свою очередь из 12 π–групповых орбиталей лигандов только три (t2g) удовлетворяют симметрийным требованиям для таких взаимодействий. Их результат сильно зависит от соотношения в энергиях между названными группами орбиталей (dε и t2g).

|
Рис.4.35 – Варианты перекрывания электронных облаков при взаимодействии комплексообразователя с π–акцепторами. |
Если лиганд является сильно электроотрицательным элементом (стало быть его t2g–орбитали будут низколежащими) и имеет на сформированных групповых орбиталях неподеленные электронные пары (F–, O22–, OH–, в меньшей степени Н2О, еще в меньшей степени Cl– и другие Г–), то их взаимодействие с dε–орбиталями металла приведет в конечном итоге к уменьшению Δокт по сравнению с лигандами, не склонными ни к каким формам π–связывания. Соответствующие лиганды окажутся преимущественно лигандами слабого поля (рис.4.36).
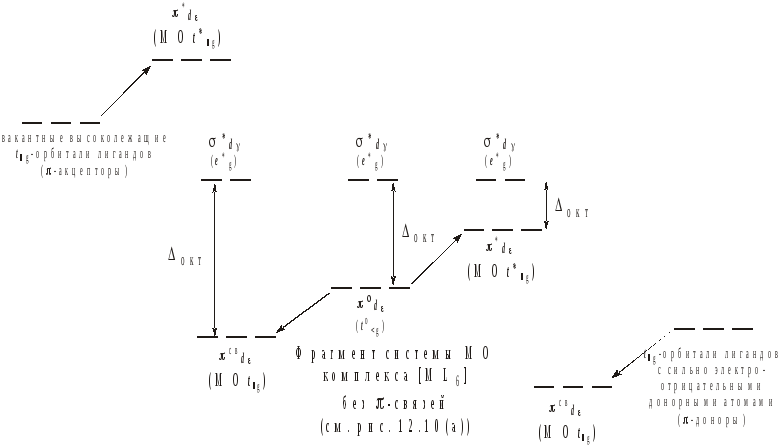
|
Рис.4.36 – Зависимость Δокт от возможности π–взаимодействия с лигандами π–акцепторами (а) и π–донорами (б). |
Если лиганд не содержит сильно электроотрицательного элемента и, к тому же, задействует в π–связывании свои разрыхляющие π*-молекулярные орбитали (разрыхляющие орбитали обычно вакантны, т.к. являются достаточно высоколежащими), то соотношение в энергии между орбиталями dε и t2g зеркально меняется, что приводит к увеличению Δокт. К таким лигандам, например, относятся P(C6H5)3 и, чаще упоминающиеся CN–, CO, чуть в меньшей степени NO2– (рис.4.36). Все эти лиганды принадлежат к лигандам сильного поля. Таким образом, на основе идей метода молекулярных орбиталей можно обосновать структуру спектрохимического ряда лигандов.
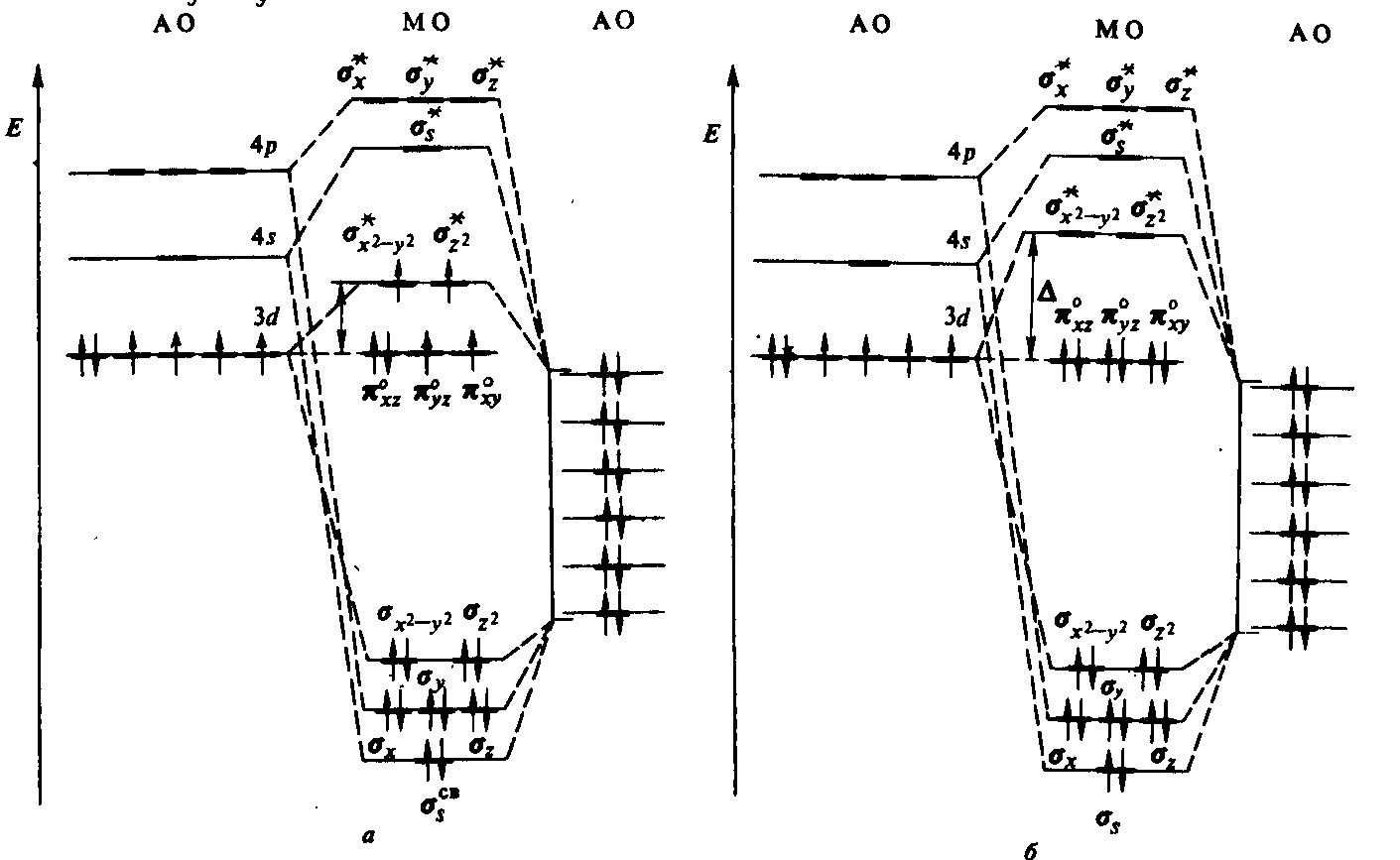
В заключение коротко разберем схему МО (рис.4.37) для весьма важных тетраэдрических комплексов с π–связыванием. Примерами такого рода частиц являются оксоанионы d–металлов в высоких степенях окисления: CrO42–, MnO42–, MnO4–, TiCl4 и т.п. Теория кристаллического поля к подобным группировкам вообще не применима (их обычно называют "комплексами в нехарактерных степенях окисления").

|
Рис.4.37 – Энергетическая диаграмма МО тетраэдрического комплекса [ML4], построенная с использованием АО металла и линейной комбинации р–орбиталей кислорода . |
Несколько упрощая ситуацию, взаимодействие комплексообразователя и лигандов можно представить следующим образом. В σ–связвание при этом вовлекаются по четыре групповые орбитали металла (sp3-гибридизованные) и лигандов (линейная комбинация четырех p-АО атомов кислорода). В π–перекрывании от лигандов могут принимать участие восемь групповых орбиталей, представляющих собой линейные комбинации оставшихся p-АО атомов кислорода.45 В то же время центральный атом может предоставить для этого все d–орбитали, но как было показано еще при обсуждении ТКП, dγ–орбитали располагаются к тетраэдрически координированным лигандам ближе и, соответственно, сильней перекрываются, обеспечивают более прочное π–связывание (πМО, сформированные с их участием, являются более низколежащими, нежели те, которые получаются при линейной комбинации с dε–орбиталями металла).
Отметим, что волновые функции π*МО сформированы главным образом за счет преобладающего вклада волновых функций d–орбиталей металла и представляют собой ту самую систему орбиталей, которая анализируется в теории кристаллического поля. Видно, что, как и в случае октаэдрических комплексов с π–связыванием, Δтетр в значительной степени определяется особенностями π–взаимодействия в системе.
Применим, представленную на рис.4.37 схему для анализа некоторых свойств ионов MnO4– и MnO43–. В обоих случаях на МО находится четное число электронов: 24ē и 26ē, соответственно.46 В перманганат-ионе они все попарно распределены на связывающих и несвязывающих МО. В итоге ион диамагнитен. В ионе MnO43– появляются два электрона сверх тех, что имеются в ионе MnO4–. Они заселяют разрыхляющие π*dγ и в соответствии с правилом Хунда должны быть неспаренными: MnO43– – парамагнитный ион.
Оба иона окрашены: MnO4– - пурпурно-красный (λотраж ≈ 720 нм), MnO43– - синий (λотраж ≈ 450 нм). Окраска иона MnO43– может быть объяснена электронными переходами между π–разрыхляющими МО (π*dγ → π*dε), что с точки зрения ТКП соответствует dγ→dε переходам в тетраэдрическом комплексе. Окрашенность перманганат-иона в рамках ТКП объяснить в принципе нельзя, т.к. центральный атом имеет высшую положительную степень окисления и на его d–орбиталях вообще нет электронов (d⇄d–переходы невозможны). Но в соответствии с ММО возможны электронные возбуждения с заселенных электронами несвязывающих орбиталей, принадлежащих лигандам, на π*dγ МО, почти полностью соответствующие dγ–орбиталям металла. Такие электронные переходы, как уже отмечалось ранее, вызывают появление в спектрах так называемых полос переноса заряда. Такие возбуждения требуют квантов с большим запасом энергии (ближняя ультрафиолетовая часть спектра). Как следствие отраженному излучению соответствует большая длина волны (см. таблицу дополнительных цветов – табл. 4.17).
Наконец, тот факт, что в трехзарядном анионе MnO43– присутствуют электроны на очень высоколежащих разрыхляющих МО сильно дестабилизирует данный комплекс по сравнению с перманганат-ионом. Этим принято объяснять высокую склонность манганата (+V) к диспропорционированию (в водной среде его можно сохранить только при чудовищно высоких значениях рН):
3MnO43– + 4Н2О → 2MnO2 + MnO4– + 8ОН–.
Оба Mn-содержащих продукта данной реакции более стабильны, чем MnO43–: перманганат-ион – по причинам, рассмотренным выше, а MnO2 (минерал пиролюзит) является трехмерным полимером со структурой рутила TiO2. Атом марганца в составе пиролюзита имеет степень окисления (+IV), находится в октаэдрическом кислородном окружении. Электронная структура Mn4+, а также перспектива Ян-Теллеровского искажения координационных групп [MnO6] могут быть продуманы с использованием теории кристаллического поля.
Проектное задание
Сформулируйте основные положения координационной теории А.Вернера и подтвердите их примерами. Учитывая, в том числе, и современные представления о теории строения атома, систематизируйте круг потенциальных комплексообразователей и лигандов. Приведите примеры известных в комплексах типов изомерии, раскройте на примерах роль их изучения в становлении координационной теории.
Перечислите круг вопросов, которые могут быть объяснены на основе изложенных в тексте теорий строения координационных соединений, в том числе кратко сравните способы объяснения:
а) магнитных свойств комплексов в рамках МВС, ТКП, ММО;
б) спектральных свойств комплексов в рамках ТКП и ММО;
в) предпочтения к связыванию тех или иных комплексообразователей с определенного типа лигандами в рамках МВС, ТКП и ММО.
Вопросы для самоподготовки:
В рамках самоподготовки по данному модулю рекомендуется продумать следующие вопросы:
1. Какие виды изомерии, кроме приведенных в тексте, дополнительно возможны в комплексах?
2. Почему по константам нестойкости нельзя однозначно сравнивать стабильность комплексов, имеющих разную стехиометрию?
3. Почему осадки гидроксидов М(ОН)х стехиометрического состава легче получаются при осаждении из щелочных растворов?
4. Почему при конфигурации d8 в сильном поле лигандов квадратная координация гораздо более распространена, нежели октаэдрическая?
5. Применяя ММО, объясните, почему в ряду MnO4–, CrO42–, VO43–, TiO44– поглощение, связанное с переносом заряда, все сильней смещается в УФ область и в видимой части спектра ионы постепенно утрачивают окраску?
6. Используя ТКП, объясните, почему при одинаковом электронном строении центрального атома комплексы [NiBr4]2– и [PtBr4]2– отличаются пространственным строением, а также по магнитным и оптическим свойствам?
7. Кратко объясните смысл нефелоауксетического эффекта и его роль в понимании характера взаимодействия комплексообразователь–лиганд.
ТЕСТ РУБЕЖНОГО КОНТРОЛЯ № 4
|
1. Теория «электронного газа» рассматривает взаимодействие в кристаллах металлов | |||||||||
|
1. |
Как ковалентную двухэлектронную и двухцентровую химическую связь. |
2. |
Как электростатическое притяжение между слоями катионов и слоями электронов | ||||||
|
3. |
Как многоцентровую химическую связь в пределах элементарной ячейки. |
4. |
Как вариант ММО ЛКАО. | ||||||
|
2. Теория «электронного газа» на качественном уровне не может объяснить | |||||||||
|
1. |
Снижение электропроводности металлов с ростом температуры. |
2. |
Пластичность металлов | ||||||
|
3. |
Непрозрачность металлов и их отражательную способность |
4.
|
Структуру металлов | ||||||
|
3. «Зонная теория» рассматривает химическую связь в кристаллах металлов как | |||||||||
|
1. |
Ионную. |
2. |
Двухэлектронную, двухцентровую | ||||||
|
3. |
Многоэлектронную и многоцентровую. |
4. |
Особый тип связи, присущий только Рассматриваемым фазам | ||||||
|
4. Общими моментами в теории «электронного газа» и в «зонной теории» являются такие свойства связи в металлах как | |||||||||
|
1. |
Направленность. |
2. |
Насыщаемость | ||||||
|
3. |
Ненаправленность и ненасыщаемость |
4. |
Свойства химической связи в рамках данных концепций различны. | ||||||
|
5. Более высокая температура плавления у кальция по сравнению с магнием в рамках «зонной теории», объясняется как следствие | |||||||||
|
1. |
Роста радиуса атома |
2. |
Роста к.ч.. | ||||||
|
3. |
Снижения потенциала ионизации |
4. |
Формирования зоны с большим числом МО. | ||||||
|
6. Максимальные температура плавления и энергия кристаллических решёток у простых веществ элементов подгрупп ванадия и хрома объясняется | |||||||||
|
1. |
d - сжатием |
2. |
Заполнением sd– зоны электронами ≈ наполовину | ||||||
|
3. |
Формированием структур типа ОЦК |
4. |
Смешанным характером связи в кристаллах этих веществ | ||||||
|
7. Недостатком МВС является | |||||||||
|
1. |
Неспособность обосновать пространственное строение комплексов |
2. |
Неспособность предсказать геометрическую форму комплекса | ||||||
|
3. |
Неспособность предсказать дополнительное π–связывание М–Cl |
4. |
Неспособность предсказать дополнительное π–связывание М–CO | ||||||
|
8. Большая величинаΔоктпо сравнению сΔтетробъясняется | |||||||||
|
1. |
Различием в координационных числах |
2. |
Более близким расположением лигандов к d–облакам металла | ||||||
|
3. |
Более короткими связями в [ML6] |
4.
|
Более длинными связями в [ML4] | ||||||
|
9. Искажение октаэдрических комплексов в рамках ТКП объясняется | |||||||||
|
1. |
Несимметричным экранированием лигандов электронами металла |
2. |
Яном и Теллером | ||||||
|
3. |
Неравноценным π–связыванием |
4. |
Взаимным отталкиванием лигандов | ||||||
|
10. Состав карбонильных комплексов d–элементов объясняется | |||||||||
|
1. |
Стремлением обеспечить низкоорбитальную гибридизацию |
2. |
Энергетически благоприятным заселением МО комплекса | ||||||
|
3. |
Стремлением обеспечить центральному атому стабильную электронную конфигурацию |
4. |
Достижением максимального энергети-ческого эффекта за счет чрезвычайно сильного расщепления d–орбиталей | ||||||
|
11. Спектрохимический ряд лигандов | |||||||||
|
1. |
Построен на основе особенностей π–взаимодействияM–L |
2. |
Позволяет сравнить Δтетрв комплексахd–элементов | ||||||
|
3. |
Может быть обоснован с использованием ММО |
4. |
Отражает закономерности электро-статического взаимодействия M–L | ||||||
|
12. Лигандами среднего поля оказываются те, которые | |||||||||
|
1. |
Не склонны к π–связыванию |
2. |
Имеют только в своем составе атом N | ||||||
|
3. |
Имеют только одну электронную пару на донорном атоме |
4. |
Обеспечивают не очень сильное расщепление d–орбиталей центрального атома | ||||||
|
13. Комплексы от двойных солей отличаются | |||||||||
|
1. |
Составом |
2. |
Способом написания формул | ||||||
|
3. |
Принадлежностью к определенным классам неорганических соединений |
4. |
Возможностью выполнить качест-венные реакции на свои составные части | ||||||
|
14. Выберите формулу, которой соответствует большее число изомеров | |||||||||
|
1. |
CrCl3·3NH3 |
2. |
[PtCl2Br2C2O4]2– | ||||||
|
3. |
[PtCl2(C2O4)2]2– |
4.
|
[Pt(C2O4)3]2– | ||||||
|
15. При увеличении порядкового номера d–элемента разнообразие воднорастворимых комплексов растет, т.к. | |||||||||
|
1. |
Увеличивается поляризующее действие комплексообразователя |
2. |
Исходное утверждение в принципе неверно | ||||||
|
3. |
Уменьшаются акцепторные свойства комплексообразователя |
4. |
Уменьшаются ионные радиусы и длины связей металл–лиганд | ||||||
|
16. Амбидентантные лиганды являются полидентантными | |||||||||
|
1. |
Если содержат более двух атомов и имеют нелинейное строение |
2. |
В полимерных комплексах | ||||||
|
3. |
Если содержат более двух донорных атомов |
4. |
Всегда, эти понятия – синонимы | ||||||
|
17. Диссоциация внутренней сферы комплекса K2[TiF6] проходит слабо, т.к. | |||||||||
|
1. |
Этому препятствуют продукты первичной диссоциации |
2. |
Комплексный ион стабильней, чем набор одноатомных гидратированных ионов | ||||||
|
3. |
Очень велика энергия связи Ti–F |
4. |
Константа нестойкости комплекса имеет маленькое значение | ||||||
|
18. Более легкое растворение Cu(OH)2в избытке аммиака, нежели, чем в избытке КОН связано | |||||||||
|
1. |
С предпочтительным связыванием Cu–N |
2. |
Со слабовыраженными кислотными свойствами гидроксида меди | ||||||
|
3. |
С пониженным сродством меди к кислороду и разной способностью ОН–иNH3выступать в роли мостиковых лигандов |
4. |
С тем, что реакция с аммиаком представляет собой замену лигандов, а реакция с КОН таковой не является | ||||||
Бланк ответа
|
|
1 |
2 |
3 |
4 |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
9 |
|
|
|
|
|
10 |
|
|
|
|
|
11 |
|
|
|
|
|
12 |
|
|
|
|
|
13 |
|
|
|
|
|
14 |
|
|
|
|
|
15 |
|
|
|
|
|
16 |
|
|
|
|
|
17 |
|
|
|
|
|
18 |
|
|
|
|
Критерии для самоконтроля степени усвоения материала модуля:
Оценка при выполнении теста: 25 – 37 баллов – удовлетворительно
38 – 47 баллов – хорошо
48 – 56 балла - отлично.
СПИСОК ЛИТЕРАТУРЫ
Дей К., Селбин Д. Теоретическая неорганическая химия. //М.:Химия, 1976.–568с.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. // М.:Мир, Т.1, 1969.–224с.
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. //М.:Химия, 1987.–696с.
Ахметов Н.С., Общая и неорганическая химия, М., «Высшая школа»,1981.–679с.
Я.А.Угай «Общая химия» М., «Высшая школа», 1977.–408с.
