
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
1.9 Электроотрицательности атомов и закономерности их изменения
Понятие об электроотрицательности атомов впервые было применено еще в 1811г. шведским химиком И.Я.Берцеллиусом для классификации элементов, позднее (1858г.) это оно использовалось в работах С.Канницаро, И.Штарка. В 1916г. Дж.Н.Люис в в теории ковалентной связи рассматривал полярность как смещение центра тяжести валентного электронного облака в сторону "более электроотрицательного" атома. Однако количественная шкала электроотрицательностей впервые была разработана Л.Полингом в 1932 и последующих годах. В то же время, несмотря на столь долгую историю, до сих пор не выработано однозначного объективного критерия, характеризующего электроотрицательность атомов. Существует множество (более 20) систем или шкал, основанных как на экспериментальных результатах, так и на квантово-механических расчетах или их комбинации. Численные значения в разных системах в той или иной степени отличаются, но, во-первых, как правило, тенденции их изменения выглядят одинаково, а, во-вторых, сами абсолютные значения электроотрицательностей часто с помощью различных подгоночных преобразований нормируют по шкале Полинга. В рамках данного пособия будут кратко проанализированы лишь самые известные и чаще всего использующиеся.
Л.Полинг использовал понятие электроотрицательность как способность данного атома, конкурируя с другими атомами–партнерами, притягивать к себе общие валентные электроны химических связей. Таким образом, по Полингу: электроотрицательность – это свойство не изолированных, а связанных атомов (в отличие от энергии ионизации и сродства к электрону). Он использовал это понятие для объяснения того факта, что энергия гетероатомной связи А–В практически всегда больше среднеарифметического (или среднегеометрического) значения энергий гомоатомных связей А–А и В–В. Тогда при использовании среднеарифметической величины можно записать:
ЕА–В = 1/2·(ЕА–А + ЕВ–В) + ΔАВ.17 (1.28)
Анализ большого числа экспериментальных фактов показал, что, если энергию связей выражать в кДж/моль, то ΔАВ можно связать с некоторыми с некоторыми константными характеристиками атомов (электроотрицательностями) выражением
ΔАВ = 96.12·(χА – χВ)2, (1.29)
из которого следует
|
χА
– χВ|
= 0.102·![]() ,
(1.30)
,
(1.30)
где χА , χВ – электроотрицательности элементов.
На основе этих выражений можно рассчитывать разность электроотрицательностей разных элементов. Для того, чтобы определить значение электроотрицательности для каждого элемента в отдельности необходимо какой-либо из них выбрать в качестве эталонного и постулировать для него значение χВ. В этом качестве Полинг выбрал водород, для которого вначале принял χН = 0, а позднее (в 1939г.) приписал водороду χН = 2.1, чтобы избежать отрицательных значений для электроотрицательности металлических элементов. Одновременно он изменил и формулу для расчета энергии ковалентной связи (1.28). Необходимость в этом возникла из-за того, что для гидридов щелочных металлов ΔМе–Н оказалась отрицательной величиной, что противоречит логике предложенного Полингом подхода. Для преодоления этой проблемы он изменил способ вычисления энергии ковалентной связи, заменив среднеарифметическое на среднегеометрическое усреднение:
ЕА–В
= ![]() + ΔАВ.
(1.31)
+ ΔАВ.
(1.31)
Чтобы при этом сохранить ранее полученные значения электроотрицательностей элементов, оказалось необходимым заменить числовой сомножитель в выражении (1.30) на 0.089. Предложенные Полингом величины относительных электроотрицательностей широко применяются и в настоящее время. Вместе с тем, его работы стимулировали множество исследований, в которых уточнялась и расширялась экспериментальная база данных, предлагались новые критерии для построения систем электроотрицательностей (орбитальная, связевая, спектроскопическая, ионизационная и т.д.).
Исключительно ценно и широко используется химиками эмпирическое рассмотрение электроотрицательности как силы, действующей на электроны на расстоянии ковалентного радиуса
χЭ
= 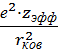 (1.32)
(1.32)
которое предложили Оллред и Рохов. Для нормировки к шкале Полинга используется выражение
χЭ
= 0.359·  + 0.744.
(1.33)
+ 0.744.
(1.33)
Еще одна очень известная система, претерпевшая в дальнейшем разнообразные модернизации, была предложена Р.С.Малликеном. Его идея состояла в том, способность атомов конкурировать за общие электроны должны зависеть от их энергий ионизации и сродства к электрону. Например, тепловой эффект образования ионной молекулы А+В– должен зависеть от I1(А) и Еē(В):
ΔНА+В– = f [I1(А) – Еē(В)]. (1.34)
Тепловой эффект противоположного варианта перераспределения электрона:
ΔНА– В+ = f [I1(В) – Еē(А)]. (1.35)
Если реально молекула слабо поляризована с частичным смещением заряда в сторону атома В (атом В более электроотрицателен, χА < χВ), то
ΔНАδ+Вδ– = ΔНА+В– – ΔНА– В+ = f [I1(А) – Еē(В)] – f [I1(В) – Еē(А)] (1.36)
или
ΔНАδ+Вδ– = f*[(I1(А) + Еē(А)) – (I1(В) + Еē(В))] =
= f**[I1(А) + Еē(А)] – f**[I1(В) + Еē(В)]. (1.37)
Такой способ перераспределения электрона оказался энергетически выгодным (ΔНАδ+Вδ– < 0), если
f**[I1(А) + Еē(А)] < f**[I1(В) + Еē(В)]. (1.38)
Логично эти функции считать электроотрицательностями атомов. В самом первом предложенном Малликеном варианте электроотрицательность была приравнена полусумме первой энергии ионизации и сродства к электрону:
χЭ (М) = ½·[I1(Э) + Еē(Э)] (1.39)
В дальнейшем было предложено несколько способов нормировать (сблизить) малликеновские электроотрицательности со шкалой Полинга. Лучшей оказалась формула, предложенная С.С.Бацановым с коллегами:
χЭ(Р) ≈ 0.4·[χЭ (М) – 0.4]. (1.40)
Таблица 1.9
Значения электроотрицательностей
для s– и р–элементов периодической системы
(1-я строка – χ по Полингу; 2-я и 3-я строки – χ по Малликену
(рассчитанная по формулам (1.39 ) и (1.40)); 4-я строка – χ по Оллреду-Рохову)
|
H 2.10 7.18 (2.67) 2.20 |
|
|
|
|
|
|
He – 12.18 (4.67) 5.50 |
|
Li 0.98 2.58 (0.99) 0.97 |
Be 1.57 4.56 (1.62) 1.47 |
B 2.04 4.28 (1.51) 2.01 |
C 2.55 6.00 (2.20) 2.50 |
N 3.04 7.24 (2.70) 3.07 |
O 3.44 7.54 (2.82) 3.50 |
F 3.98 10.42 (3.97) 4.10 |
Ne – 10.64 (4.06) 4.84 |
|
Na 0.93 2.84 (0.94) 1.01 |
Mg 1.31 3.72 (1.29) 1.23 |
Al 1.61 3.22 (1.09) 1.47 |
Si 1.90 4.76 (1.70) 1.74 |
P 2.19 5.62 (2.05) 2.06 |
S 2.58 6.22 (2.29) 2.44 |
Cl 3.16 8.30 (3.12) 2.83 |
Ar – 7.72 (2.89) 3.20 |
|
K 0.82 2.42 (0.77) 0.91 |
Ca 1.00 2.37 (0.75) 1.04 |
Ga 1.81 3.19 (1.08) 1.82 |
Ge 2.01 4.80 (1.72) 2.02 |
As 2.18 5.31 (1.92) 2.20 |
Se 2.55 5.89 (2.16) 2.48 |
Br 2.96 7.61 (2.84) 2.74 |
Kr – 6.79 (2.52) 2.94 |
|
Rb 0.82 2.33 (0.73) 0.89 |
Sr 0.95 2.09 (0.64) 0.99 |
In 1.78 3.05 (1.02) 1.49 |
Sn 1.96 4.27 (1.51) 1.72 |
Sb 2.05 4.79 (1.72) 1.82 |
Te 2.10 5.51 (2.00) 2.01 |
J 2.66 6.73 (2.49) 2.21 |
Xe – 5.85 (2.14) 2.4 |
|
Cs 0.79 2.18 (0.67) 0.86 |
Ba 0.89 2.37 (0.75) 0.97 |
Tl 1.83 3.16 (1.06) 1.44 |
Pb 2.06 3.89 (1.36) 1.55 |
Bi 2.02 4.12 (1.45) 1.67 |
Po 2.00 4.88 (1.75) 1.76 |
At 2.20 6.00 (2.20) 1.90 |
Rn – 5.16 (1.86) 2.06 |
Наиболее интересным в методе Малликена является возможность вычисления значений χЭ для разных валентных состояний, принимая в расчет энергии ионизации с тех орбиталей, которые задействованы в образовании конкретных связей (возможно в том или ином долевом участии). В этом случае легко показать, что χЭ увеличивается в ряду sp3→sp2→sp-гибридизованных атомов. Например, электроотрицательность углерода в направлении кратных связей занижается до ~2.2 (при двойной) и ~ 2.1 (при тройной), а в противоположных, наоборот, растет (~3.1 и ~3.4, соответственно).
В настоящее время ионизационные модели, основанные на подходе, предложенном Малликеном, являются лучшими и наиболее корректными из теоретических методов определения электроотрицательности элементов. Они наиболее адекватно позволяют показать, что электроотрицательность атома может изменяться в зависимости от его окружения, степени окисления, валентного состояния (от процентного вклада тех или иных орбиталей в связывание).
Как видно из приведенных в табл. 1.9 данных, электроотрицательность элементов в периодах в целом растет, а в подгруппах (главных) в целом уменьшается. Обсуждать же детальные закономерности не имеет большого смысла, поскольку, как уже было сказано, электроотрицательность элементов, строго говоря, не является абсолютно неизменной величиной, а зависит от перечисленных выше параметров.
Проектное задание
Дайте объяснение причин принципиальной невозможности описать движение электронов в рамках классических представлений о траектории движения тела. Сформулируйте правила квантования и заселения атомных орбиталей электронами (определите границы применимости соответствующих положений). На основе современных представлений об электронном строении атомов объясните структуру периодической системы элементов. Сформулируйте закономерности изменения электронного строения атомов и ионов, причины и условия осуществления электронных проскоков. Учитывая влияние различных факторов, определяющих особенности притяжения электронов к ядру и межэлектронных взаимодействий, объясните закономерности изменения важнейших атомных свойств в периодах и подгруппах периодической системы элементов.
Вопросы для самоподготовки:
В рамках самоподготовки по данному модулю рекомендуется продумать следующие вопросы:
1. Почему даже с точки зрения классической механики в многоэлектронных атомах практически невероятны круговые стационарные орбиты?
2. Каково электронное строение лантаноидов и актиноидов? Как объяснить случаи электронных проскоков в соответствующих рядах?
3. Как будет меняться внешний вид графиков радиального распределения электронной плотности для l = 0, l = 1 при изменении направления радиус-вектора? Что такое узловые точки, узловые и граничные поверхности?
Как меняется вероятность электронных проскоков в рядах d–элементов, почему они гораздо чаще наблюдаются у элементов V-го периода?
Как объяснить характер изменения орбитальных и металлических радиусов в ряду 3d–элементов?
Сравните друг с другом первые, вторые, третьи и четвертые энергии ионизации Mg и Al? Объясните полученный результат.
Почему электроотрицательность элементов подгруппы ванадия в степени окисления +II растет, а в высшей – уменьшается? Как это должно отразиться на изменении характера связывания в соответствующих соединениях?
ТЕСТ РУБЕЖНОГО КОНТРОЛЯ № 1
|
1. Несостоятельность модели Резерфорда объясняется | |||
|
1. |
Противоречиями между отдельны-ми положениями |
2. |
Противоречиями эксперименталь-ным фактам |
|
3. |
Необоснованностью утверждения о поступательном (вращательном) движении электронов |
4. |
Отсутствием возможности количественного описания атомных свойств |
|
2. К недостаткам модели Бора относится | |||
|
1. |
Постулированность исходных положений |
2. |
Невозможность объяснить природу межатомных взаимодействий |
|
3. |
Проблемы с объяснением извест-ных на тот момент свойств атомов |
4.
|
Внутренняя противоречивость |
|
3. Сверхтонкая структура атомных спектров в ранних моделях строения атома объяснена | |||
|
1. |
Введением понятия спина |
2. |
С использованием понятия "эффект проникновения" |
|
3. |
Введением трех квантуемых степеней свободы для описания движения электрона |
4. |
Признанием волновой природы электрона и других микрочастиц |
|
4. Разрешенные значения квантовых чисел, характеризующих движение электрона в атоме, определяются | |||
|
1. |
Правилами квантования |
2. |
Законами теории относительности |
|
3. |
Решением волнового уравнения с учетом релятивистских эффектов |
4. |
Энергией и формой атомных орбиталей |
|
5. "Пустая" атомная орбиталь представляет собой | |||
|
1. |
Область пространства, лишенная электронного облака |
2. |
Набор квантовых чисел, определяющих нереализованный закон движения электрона |
|
3. |
Пустую "квантовую ячейку" |
4. |
Волновую функцию, соответству-ющую возбужденному состоянию атома |
|
6. Полная энергия электрона в атоме определяется | |||
|
1. |
Волновой функцией с учетом релятивистских поправок |
2. |
Зарядом ядра и эффектами экранирования и проникновения |
|
3. |
Всеми четырьмя квантовыми числами, определяющими значение волновой функции |
4. |
Расстоянием до ядра и скоростью перемещения |
|
7. Валентными следует считать | |||
|
1. |
Орбитали, на которых находятся самые плохо удерживаемые в атоме электроны |
2. |
Орбитали, которые могут участвовать в перераспределении электронов с другими атомами |
|
3. |
Орбитали внешнего энергетичес-кого уровня |
4. |
Самые высоколежащие орбитали, заселенные электронами |
|
8. Орбитальные радиусы атомов меняются зависимости от заряда ядра и | |||
|
1. |
Строения внутренних электронных оболочек |
2. |
Значением главного и орбитального квантовых чисел валентных электронов |
|
3. |
Эффекта проникновения электронов на орбиталях валентного уровня |
4.
|
Можно ограничиться упоминанием только "эффективного" заряда ядра |
|
9. Смысл эффекта проникновения состоит в усиливающемся притяжении к ядру по причине | |||
|
1. |
Особой формы электронного облака |
2. |
Особой траектории движения, предполагающей частое пребывание вблизи ядра |
|
3. |
Особого электронного строения остова |
4. |
Особого вида графиков радиальной составляющей волновой функции |
|
10. Увеличение первой энергии ионизации ожидается в следующих парах элементов | |||
|
1. |
As – Se |
2. |
Nb – Mo |
|
3. |
Ag – Au |
4. |
Sb –Bi |
|
11. Присоединение дополнительного электрона осуществляется на | |||
|
1. |
Наиболее низколежащую орбиталь |
2. |
Орбиталь, обеспечивающую мини-мальное межэлектронное отталкива-ние |
|
3. |
Орбиталь, обеспечивающую макси-мальный эффект проникновения |
4. |
Орбиталь, обеспечивающую мини-мальную энергию возникающей новой электронной системе |
|
12. Зависимость энергий связи от электроотрицательности элементов можно объяснить | |||
|
1. |
Различием структур гетеро- и гомоатомных молекул |
2. |
Изменением длин связей за счет перераспределения валентных электронов |
|
3. |
Изменением энергии электронов остова за счет изменения эффекта их экранирования |
4. |
"вкладом ионных резонансных форм" в энергию системы |
Бланк ответа
|
|
1 |
2 |
3 |
4 |
|
1 (2 балла) |
|
|
|
|
|
2 (2 балла) |
|
|
|
|
|
3 (3 балла) |
|
|
|
|
|
4 (2 балла) |
|
|
|
|
|
5 (2 балла) |
|
|
|
|
|
6 (3 балла) |
|
|
|
|
|
7 (3 балла) |
|
|
|
|
|
8 (4 балла) |
|
|
|
|
|
9 (4 балла) |
|
|
|
|
|
10 (4 балла) |
|
|
|
|
|
11 (3 балла) |
|
|
|
|
|
12 (4 балла) |
|
|
|
|
Критерии для самоконтроля степени усвоения материала модуля:
Оценка при выполнении теста: 18 – 24 баллов – удовлетворительно
25 – 30 баллов – хорошо
31 – 36 балла - отлично.
СПИСОК ЛИТЕРАТУРЫ
Дей К., Селбин Д. Теоретическая неорганическая химия. //М.:Химия, 1976.–568с.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. // М.:Мир, Т.1, 1969.–224с.
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. //М.:Химия, 1987.–696с.
Бацанов С.С. Структурная химия: факты и зависимости. //М.:"Диалог-МГУ", 2000.–292с.
Эмсли Дж. Элементы // М.:Мир, 1993.–257с.
Ganguly P. Orbital Radii and Environment-Independent Transferable Atomic Length Scales. // J. Am. Chem. Sос., 1995, V.117, P.1777-1782.
Шредингер Э. Лекции по физике. // Ижевск: НИЦ "Регулярная и хаотическая динамика", 2001.–160с.
