
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
2.4. Теория поляризации.
К
 ак
мы уже видели, представление об ионах
как о жестких несжимаемых сферах далеко
не всегда позволяет согласовать
теоретические и экспериментальные
данные. Это связано с тем, что под
действием электромагнитного поля
соседних ионов происходит деформация
электронной плотности иона-партнера.
Для оценки величины напряженности
электрического поля (Е), создаваемого
ионами, напомним, что для точечного
заряда е на расстоянии r оно определяется
выражением Е=е/r2. Принимая r=10Å, для
однозарядного иона (е=1,6·10–19
к) получим Е=14,4·106
В. Расстояние же между ионами в молекулах
и кристаллах меньше, чем 10Å и, следовательно,
напряженность поля, действующего на
соседний ион, должна быть еще выше.
Следует отметить, что при строгом расчете
напряженности поля вблизи иона, его
конечно нельзя рассматривать как
точечный заряд. Однако, приведенный
результат дает правильное представление
о порядке рассматриваемых величин:
напряженность электрического поля,
действующего на данный ион в молекуле
или кристалле, составляет десятки
миллионов вольт. Результатом воздействия
на ион электрического поля является
его деформация. Для простых ионов она
заключается в смещении их электронной
плотности по отношению к ядру: т.е.
электронная плотность иона вытягивается
в сторону частицы, имеющей положительный
заряд, и деформируется в противоположном
направлении, если заряд соседнего иона
отрицателен:
ак
мы уже видели, представление об ионах
как о жестких несжимаемых сферах далеко
не всегда позволяет согласовать
теоретические и экспериментальные
данные. Это связано с тем, что под
действием электромагнитного поля
соседних ионов происходит деформация
электронной плотности иона-партнера.
Для оценки величины напряженности
электрического поля (Е), создаваемого
ионами, напомним, что для точечного
заряда е на расстоянии r оно определяется
выражением Е=е/r2. Принимая r=10Å, для
однозарядного иона (е=1,6·10–19
к) получим Е=14,4·106
В. Расстояние же между ионами в молекулах
и кристаллах меньше, чем 10Å и, следовательно,
напряженность поля, действующего на
соседний ион, должна быть еще выше.
Следует отметить, что при строгом расчете
напряженности поля вблизи иона, его
конечно нельзя рассматривать как
точечный заряд. Однако, приведенный
результат дает правильное представление
о порядке рассматриваемых величин:
напряженность электрического поля,
действующего на данный ион в молекуле
или кристалле, составляет десятки
миллионов вольт. Результатом воздействия
на ион электрического поля является
его деформация. Для простых ионов она
заключается в смещении их электронной
плотности по отношению к ядру: т.е.
электронная плотность иона вытягивается
в сторону частицы, имеющей положительный
заряд, и деформируется в противоположном
направлении, если заряд соседнего иона
отрицателен:
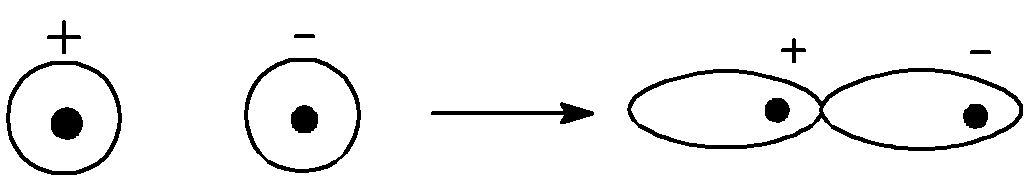
Рис. 8.2. Взаимная деформация электронных оболочек ионов при их взаимодействии.
Согласно расчетам такое взаимодействие приводит к снижению реально наблюдаемых зарядов на ионах, т.е. к уменьшению полярности химической связи и к появлению признаков ее направленности.
Т.к. электроны внутренних энергетических уровней несравненно прочнее связаны с ядром, чем электроны валентного уровня (см, например, значения I1 и I2 для атома натрия), в первом приближении можно считать, что под действием электрического поля происходит деформация только электронной плотности валентного уровня.
Непосредственной мерой деформируемости является величина диполя, возникающего в ионе под действием внешнего электрического поля. Эта величина при фиксированной напряженности поля зависит от двух факторов: степени деформации отдельных электронных орбиталей внешнего энергетического уровня и числа деформирующихся орбиталей. Поэтому возможен такой случай, когда небольшая деформация нескольких орбиталей создает в результате больший диполь, чем значительная деформация меньшего числа орбиталей. С другой стороны, при одинаковой электронной структуре ионов деформируемость их оболочек должна быстро уменьшаться с ростом заряда ядра иона ,т.к. сила притяжения электронов ядром в этом случае быстро возрастает. И, наконец, с ростом эффекта экранирования и увеличением радиуса ионов, связь их валентных электронов с ядром уменьшается, что облегчает деформацию их внешних электронных орбиталей. Отсюда можно сделать выводы:
При прочих равных условиях минимальной деформируемостью будут обладать катионы с инертно-газовой электронной оболочкой, т.к. у них деформации должны подвергаться электронные орбитали предвнешнего уровня. Деформируемость катионов с близкими значениями радиусов и одинаковым зарядом иона растет по мере увеличения числа электронов на внешнем энергетическом уровне и достигает максимальных значений у ионов с электронной конфигурацией ns2np6nd10 (18е-оболочка) и ns2np6nd10 (n+1)s2 (18+2e оболочка).
При одинаковой электронной структуре деформируемость иона быстро уменьшается с ростом заряда его ядра. Например, для ионов с электронной конфигурацией внешнего уровня 2s22p6: O2–>F–>Ne>Na+>Mg2+>Al3+>Si4+.
При одинаковом заряде и аналогичной электронной структуре внешнего уровня ионов их деформируемость растет по мере увеличения числа внутренних заполненных энергетических уровней:
Li+<Na+<K+<Rb+<Cs+ F–<Cl–<Rr–<I–<At–


увеличение деформируемости увеличение деформируемости
т.е. деформируемость ионов в главных подгруппах увеличивается сверху вниз.
4. Т.к. понижение плотности заряда иона (п.2) с одной стороны, и увеличение числа внутренних энергетических уровней - с другой стороны(п.3), сопровождается ростом радиуса ионов, то можно сделать вывод, что деформируемость ионов, имеющих одинаковую или аналогичную электронную конфигурацию и одинаковый заряд, увеличивается с ростом их радиуса.
Как уже было отмечено, взаимодействие двух ионов приводит к их взаимной деформации. Способность данного иона создавать в ионе-партнере наведенный диполь называется поляризующим действием иона. Поляризующее действие иона должно возрастать по мере увеличения напряженности создаваемого им поля и увеличения его деформируемости, что, как будет показано ниже, способствует возникновению дополнительного поляризационного эффекта. Следовательно:
При одинаковой или аналогичной электронной конфигурации внешнего электронного уровня, при одинаковом заряде и близком значении радиусов ионы с электронной конфигурацией ns2np6 (8e) обладают наименьшим поляризующим действием, т.к. имеют минимальное значение деформируемости. По мере увеличения числа электронов на внешнем уровне (электронная конфигурация 8+n) поляризующее действие увеличивается и достигает максимальных значений у ионов с электронной конфигурацией ns2np6nd10 (18e) и ns2np6nd10(n+1)s2 (18+2e).
При сходной структуре внешней электронной оболочки и одинаковом заряде поляризующее действие слабодеформируемых ионов возрастает по мере уменьшения их радиусов. Этим, в частности, объясняется высокое поляризующее действие катионов с 2е оболочкой (Li+, Be2+, B3+ и т.д.). В случае же ионов с 18е и (18+2)е оболочками, взаимодействующих с ионами, характеризующимися высокой способностью к деформации, поляризующее действие ионов может в ряде случаев увеличиваться с ростом их радиуса. Для объяснения последнего положения рассмотрим взаимодействие легко деформирующихся катиона М+ и аниона Х–. За счет действия поля М+ на Х– и поля Х– на М+ в ионах возникают наведенные диполи m1 и m2, которые усиливают поляризующее действие как аниона, так и катиона. В результате этого происходит дальнейшее взаимное сближение частиц, что приводит к росту их поляризующего действия. Препятствовать смещению электронной плотности будут положительные заряды ядер ионов, что, в конечном итоге, приведет к достижению равновесного состояния. Отсюда следует, что максимальный дополнительный поляризационный эффект будет наблюдаться при взаимодействии частиц, одновременно обладающих высоким поляризующим действием и высокой деформируемостью.
Сложные ионы обладают относительно низким поляризующим действием из-за больших значений их ионных радиусов (например, rNH4+»rК+, a rСlО4-=2,36Å). В то же время их деформируемость в целом уступает деформируемости простых анионов (за исключением F–). Для сравнения в оба ряда включена молекула воды:
C lO4–<F–<NO3–<H2O<OH–<CN–<Cl–<Br–<I–
lO4–<F–<NO3–<H2O<OH–<CN–<Cl–<Br–<I–
увеличение деформируемости
S O42–<H2O<CO32–<O2–<S2–
O42–<H2O<CO32–<O2–<S2–
увеличение деформируемости
Поэтому, в большинстве случаев, для прогноза свойств соединений, в состав которых входят сложные ионы, достаточно рассмотреть только действие катиона на анион.
Разберем влияние поляризующего действия на свойства бинарных соединений (образованных атомами только двух элементов).Т.к. взаимная поляризация ионов ведет к образованию диполей и способствует их сближению, энергия химической связи между ионами в кристалле должна возрастать, что приводит к увеличению энергии кристаллической решетки. Рассмотрим влияние фактора электронной оболочки на энергию межионного взаимодействия (табл. 8).
Анализируя данные таблицы 8.2 (учитывая, что rCu+=0,96; rNa+=0,95, rAg+=1,26 по шкале Полинга), можно сделать следующие выводы:
При близких значениях ионов радиусов Сu+ и Na+, имеющих, соответственно, 18е и 8е оболочки, более высокое поляризующее действие ионов Сu+ приводит к формированию кристаллической структуры с меньшим значением КЧ, что должно уменьшать энергию кристаллической решетки. Но одновременно уменьшается и расстояние между ионами в кристалле, что согласно уравнению 1.2 приводит к снижению потенциальной энергии системы и, следовательно, к росту энергии кристаллической решетки. Одновременное действие указанных факторов предопределяет более высокие значения Ер. галогенидов меди (I) по сравнению с галогенидами натрия.
Таблица 8.2. Энергия кристаллической решетки (Ер), координационное число (КЧ) ионов в кристаллах соединений типа АХ и значения межядерных расстояний (rо).
|
Соединение |
Ер кДж/моль |
КЧ (А+) |
КЧ (Х–) |
rо (Å) |
|
CuF |
1020 |
4 |
4 |
1,84 |
|
CuCl |
866 |
4 |
4 |
2,34 |
|
CuBr |
829 |
4 |
4 |
2,46 |
|
CuI |
787 |
4 |
4 |
2,62 |
|
NaF |
940 |
6 |
6 |
2,32 |
|
NaCl |
774 |
6 |
6 |
2,82 |
|
NaBr |
741 |
6 |
6 |
2,99 |
|
NaI |
694 |
6 |
6 |
3,24 |
|
AgF |
871 |
6 |
6 |
2,46 |
|
AgCl |
783 |
6 |
6 |
2,77 |
|
AgBr |
757 |
6 |
6 |
2,88 |
|
AgI |
736 |
4 |
4 |
2,81 |
При сравнении энергий кристаллических решеток NaГ и АgГ видно влияние дополнительного поляризующего действия. Так как rAg+>rNa+, можно предположить, что rо у галогенидных фаз серебра больше чем у аналогичных фаз, в состав которых в качестве катиона входит натрий. Однако это выполняется только у пары (NaF – AgF), что объясняется наименьшей деформируемостью F– по сравнению с другими галогенид-ионами. Поэтому при равном KЧ Екр.р.(NaF)>Екр.р.(AgF). Во всех же остальных случаях наблюдается обратная картина. Взаимная поляризация достигает max значения в паре Ag+–I–, что приводит к формированию у этого вещества кристаллической решетки с КЧ=4. Аналогичная картина наблюдается и для близких по размеру двухзарядных катионов.
Таблица 9.2. Энергия кристаллических решеток галогенидов Са(II) и Сd(II).
|
Вещество |
CaF2 |
CaCl2 |
CaBr2 |
CaI2 |
CdF2 |
CdCl2 |
CdBr2 |
CdI2 |
|
Ер, кДж/моль |
2580 |
2198 |
2128 |
2040 |
2770 |
2502 |
2480 |
2358 |
r(Ca2+)=0,99Å r(Cd2+)=0,97Å
Удовлетворительно теория поляризации объясняет и полиморфизм веществ. Полиморфизмом называется способность вещества определенного состава существовать в виде нескольких кристаллических фаз, отличающихся друг от друга строением кристаллических решеток, а, следовательно, имеющих различные физико-химические свойства. Каждая из этих фаз стабильна в определенной области температур и давлений и называется полиморфной модификацией. С точки зрения теории поляризации влияние температуры на формирование структуры вещества связывается с ростом односторонних деформаций при нагревании кристалла. При низких температурах амплитуда колебания частиц в кристалле сравнительно невелика и, поэтому возникающий в результате взаимного смещения ионов индуцированный диполь еще не способен привести к существенному сближению взаимодействующих частиц и способствовать нарушению симметрии кристалла. С ростом температуры амплитуда колебания ионов возрастает. В результате этого для компенсации сил отталкивания между одноименно заряженными ионами расстояние между некоторыми из них и центральной частицей уменьшается, тогда как другие ионы внешней сферы удаляются от нее. При этом последние сближаются с противоионами следующей сферы, что еще больше ослабляет их связь с первой центральной частицей. Противоборство сил притяжения и отталкивания, увеличивающееся с ростом температуры, будет дестабилизировать систему. Одним из вариантом, позволяющих сохранить в ней совокупность более прочных коротких связей и уменьшить отталкивание между одноименно заряженными ионами, является формирование новой фазы, в которой ионы имеют более низкое значение КЧ. Например, CsCI при Т<4450С имеет объемноцентрированную кубическую структуру (КЧ=8), а выше этой температуры – структуру типа NaCI (КЧ=6). Такое же изменение КЧ, как мы видели выше, происходит при замене слабее поляризующего иона сильнее поляризующим, или иона с низкой деформируемостью на ион с большей деформируемостью. В связи с этим теория поляризации проводит формальную аналогию между поляризующим действием катиона с одной стороны и температурой – с другой: из двух веществ с одинаковыми анионами более "нагретым" является то, в состав которого входит катион с бóльшим поляризующим действием.
Попробуем на основе этого положения предсказать изменения температур плавления веществ с одним и тем же анионом. Согласно поляризационным представлениям температура плавления таких веществ должна уменьшаться:
1. С ростом поляризующего действия катиона.
2. С ростом радиуса катиона.
3. С уменьшением деформируемости катиона.
Проанализируем изменение Тпл при переходе от галогенидов лития к галогенидам натрия:
Ион Li+ имеет минимальное значение радиуса среди ионов щелочных металлов и 2-х е оболочку. В связи с этим он по поляризующему действию значительно превосходит ион Na+, что должно предопределять более высокие температуры плавления галогенидов натрия по сравнению с галогенидами лития.
Одновременно рост радиуса иона при переходе от Li+ к Na+ должен понизить температуру плавления производных последнего иона.
Частичная компенсация второго фактора происходит за счет роста деформируемости иона Na+.
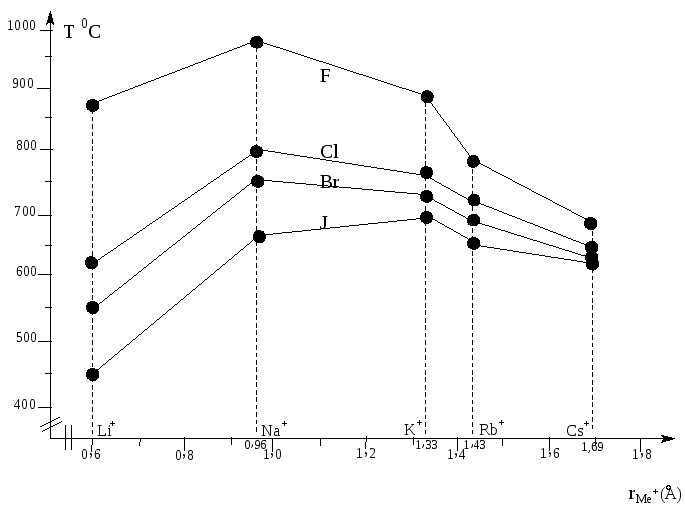
Рис. 9.2. Температуры плавления галогенидов щелочных металлов.
Таким образом, первый из факторов является предопределяющим и Тпл галогенидов натрия будет выше, чем у галогенидов лития (рис. 9.2). При переходе от NaГ к КГ изменение поляризующего действия катионов значительно меньше, чем в первом случае, т.к. Na+ и К+ имеют 8е оболочку. Меньше и разности в деформируемости ионов Nа+ и К+ (в 2 раза по сравнению с парой Li+–Na+), поэтому предопределяющим фактором в этом случае является увеличение r иона, что при одинаковом анионном составе приводит к снижению Тпл фторидов, хлоридов и бромидов калия по сравнению с аналогичными солями натрия.
Рассуждая аналогичным образом, можно придти к выводу, что Тпл в ряду КГ–RbГ–CsГ будет продолжать понижаться (рис.9.2). Несколько изменяется картина для Тпл иодидов щелочных металлов, что связано с высокой поляризуемостью иона I-: небольшого поляризующего действия иона Na+ оказывается достаточно для значительной односторонней деформации электронной оболочки этого аниона, что снижает Тпл NaI по сравнению с КI.
С ростом деформируемости катиона увеличивается взаимная деформация катиона и аниона, что способствует росту Тпл. Из рассматриваемых ионов Ме+ наибольшая деформируемость у Cs+ и потому в данном случае рост радиуса галогенионов в значительной степени компенсируется увеличением деформируемости по ряду F––Cl––Br––I–. Это приводит к тому, что Тпл всех галогенидов Cs+ достаточно близки (рис. 9.2). Но при этом поляризуемость Cs+ (8е оболочка) оказывается недостаточной для полной компенсации роста радиусов галогенионов и температура плавления в ряду CsF–CsI несколько снижается.
В случае ионов с 18е оболочкой, обладающих и высокой деформируемостью и высоким поляризующим действием, характер изменения Тпл в рядах МеГn несколько другой. Так, например, при переходе от СuF к СuСl Тпл снижается, а в ряду CuCl–CuBr–CuI – возрастает (табл. 10.2). С точки зрения теории поляризации высокая Тпл(CuF) объясняется низкой деформируемостью F– и его малым поляризующим действием, поэтому как односторонняя, так и взаимная деформация ионов невелика, и предопределяющим фактором Тпл является минимальное значение межядерного расстояния между Сu+ и F– в кристалле (таблица 8.2). Рост радиуса Г– при переходе от F– к Cl– увеличивает длину химической связи, что уменьшает ее энергию.
Таблица 10.2 - Температура плавления галогенидов различных элементов.
|
Состав вещества |
Тпл оС |
Состав вещества |
Тпл оС |
Состав вещества |
Тпл оС |
Состав вещества |
Тпл оС |
|
СuF |
908 |
NaF |
955 |
ZnF2 |
872 |
GaF3 |
950 |
|
CuCl |
422 |
NaCl |
801 |
ZnCi2 |
318 |
GaCi3 |
77 |
|
CuBr |
504 |
NaBr |
747 |
ZnBr2 |
394 |
GaBr3 |
125 |
|
CuJ |
605 |
NaJ |
661 |
ZnJ2 |
446 |
GaJ3 |
210 |
В то же время взаимная деформируемость Cu+ и Cl– еще относительно мала и не может скомпенсировать влияния первого фактора. В случае же Br– и J– взаимная деформируемость увеличивается, что, несмотря на рост радиуса галогенид-ионов, приводит к росту Тпл. Аналогичная картина наблюдается и для галогенидов Zn2+ (табл. 10.2). Однако, в связи с бóльшим поляризующим действием иона Zn2+, температура плавления его галогенидов ниже, чем у галогенидов Сu+. Дальнейшее увеличение поляризующего действия при сохранении электронной структуры ионов (например, галогениды Ga3+), приводит к еще большему снижению Тпл. При этом выявленная зависимость Тпл от природы галогенид-иона остается прежней. При еще большем поляризующем действии за счет уменьшения полярности химической связи происходит формирование веществ молекулярного типа (например, галогениды Ge(IV)). Температуры плавления предопределяются уже силами межмолекулярного взаимодействия, которые не рассматриваются в рамках теории поляризации. Из выше сказанного следует еще один практически важный вывод: если радиусы катионов близки, а их заряды одинаковы, то меньшей температурой плавления характеризуются вещества, в состав которых входят катионы с 18е или (18+2)е оболочками (табл.10.2).
При нагревании вещества могут не только изменять свою структуру или плавиться, но и разлагаться. Из выше сказанного следует, что чем выше односторонняя деформация ионов в молекулах или кристаллах бинарных соединений, тем ниже температура их разложения. Т.к. односторонняя деформация растет по мере увеличения поляризующего действия катиона, то можно предположить, что при одинаковом заряде ионов и близком значении их радиусов термическая стабильность однотипных соединений будет зависеть только от электронной конфигурации иона. Например, галогениды Y3+(r=1,06Å) и Zr4+(r=0,87Å) (ионы с 8е оболочкой), значительно стабильнее аналогичных соединений Tl3+ (r=1,05Å) и Pb2+(r=0,84Å) (18e оболочка ионов). С другой стороны, с ростом деформируемости аниона односторонняя деформация также увеличивается. Поэтому термическая стабильность, например, галогенидов любого катиона по ряду F–I всегда уменьшается. В случае же низкой деформируемости аниона (гидриды, нитриды и т.д.) термическая стабильность снижается по мере увеличения радиуса катиона (рост длины химической связи). В связи с этим LiH и Li3N более стабильны, чем гидриды и нитриды других элементов главной подгруппы первой группы.
В отличие от бинарных соединений, состав солей кислородных кислот предопределяет не только температуру, но и состав продуктов их разложения. Одним из вариантов протекания реакции в данном случае является образование двух оксидов:
CaCO
3
![]() CaO
+ CO
2
CaO
+ CO
2
Таким образом, процесс сводится к отщеплению атома кислорода от аниона. Из сформулированных выше положений теории поляризации следует, что чем выше будет поляризующее действие катиона, тем при более низкой температуре деформация аниона окажется достаточной для его разрушения (табл. 11.2).
Таблица 11.2. Температуры, при которых давление СО2 над карбонатами типа МеСО3 равно 1атм.
|
Катион |
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
Fe2+ |
Cd2+ |
Pb2+ |
|
r (Me2+), Å |
0,78 |
1,06 |
1,27 |
1,43 |
0,83 |
1,03 |
1,32 |
|
Электронная оболочка |
8 |
8 |
8 |
8 |
8+6 |
18 |
18+2 |
|
Т, 0С |
600 |
900 |
1290 |
1360 |
280 |
360 |
300 |
Как видно из приведенных данных, с уменьшением поляризующего действия катионов по ряду Мg2+ – Ва2+ (увеличение радиуса ионов при их неизменном заряде и электронной конфигурации) термическая стабильность карбонатов быстро возрастает. В то же время, термическая стабильность солей, в состав которых входят катионы с электронной структурой типа (8+n, 18, 18+2) оказывается значительно ниже, чем у карбонатов щелочно-земельных металлов, катионы которых имеют такой же заряд и близкий радиус (например, СаСО3–СdСО3).
Особое место среди катионов занимает ион Н+. Несмотря на минимальное значение положительного заряда, он обладает очень высоким поляризующим действием за счет того, что его радиус на несколько порядков меньше, чем у любого другого катиона. Отсюда следует важный практический вывод: термическая стабильность кислородных кислот, в подавляющем большинстве случаев, ниже, чем у их солей.
Другим вариантом разложения солей при нагревании является распад аниона с отщеплением кислорода. Например:

 2KNO3
KNO2
+ O2
2KNO3
KNO2
+ O2
Этот процесс связан с односторонней деформацией ионов кислорода в анионе за счет высокого поляризующего действия иона N5+. С ростом температуры эта односторонняя деформация возрастает, что и ведет к разрыву одной из связей N–O. В то же время LiNO3 распадается с образованием Li2O:
 2NO2
2NO2
 2LiNO3
Li2O
+ N2O5
2LiNO3
Li2O
+ N2O5
1⁄2 O2
Анализируя причину образования различных продуктов реакции в процессе разложения этих двух солей, можно придти к выводу, что она связана с различной величиной поляризующего действия ионов K+ и Li+. Первый из этих ионов, имея 8е оболочку и достаточно большой ионный радиус, обладает низким поляризующим действием и поэтому слабо деформирует электронную плотность ионов кислорода, входящих в состав иона NO3–. Поляризующее же действие иона N5+ значительно больше, чем у иона К+, что и предопределяет характер разложения данного соединения. В то же время ион Li+ характеризуется более высоким поляризующим действием (2е-оболочка, меньший радиус) по сравнению с ионом К+, что, как было показано выше, способствует отрыву атома кислорода от аниона.
Таким образом, по первой из представленных схем будут разлагаться нитраты, в состав которых входят катионы, обладающие низким поляризующим действием (ионы элементов первой и второй главных подгрупп, за исключением Li+). Нитраты же большинства p и d – элементов будут разлагаться с образованием оксида элемента (аналогично нитрату лития). Если же образующийся оксид нестабилен при температуре разложения нитрата, то одним из продуктов реакции будет простое вещество:
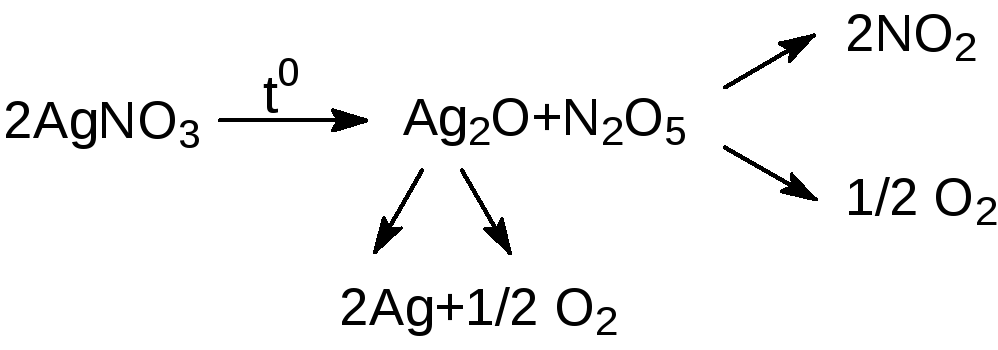
2 AgNO3
2Ag
+ 2NO2
+ O2
AgNO3
2Ag
+ 2NO2
+ O2
На основе поляризационных представлений достаточно успешно интерпретируются и окислительные свойства анионов кислородных кислот: с ростом деформации электронной плотности этих анионов (уменьшение стабильности) значения их Red/Ox потенциалов должны увеличиваться. Как уже отмечалось, ионы Н+ по поляризующему действию превосходят большинство катионов с зарядами +1 - +3 и поэтому кислородные кислоты являются более сильными окислителями, по сравнению с их солями. При введении в раствор солей кислородных кислот ионов Н3О+ (подкисление растворов) наблядается рост окислительных свойств системы. Этим же объясняется, например, более высокое значение Red/Ox потенциала ионов NO3– в растворе Mg(NO3)2 по сравнению с Red/Ox потенциалом этих ионов в растворе LiNO3, хотя поляризующее действие Mg2+ приблизительно равно поляризующему действию Li+ (гидролиз иона Mg2+ способствует росту [H+]).
Процесс гидролиза различных типов соединений интерпретируется теорией поляризации как изменение состава катионных или анионных аквакомплексов за счет возникновения в них односторонних деформаций. Например, в образующемся при растворении соли бериллия ионе за счет достаточно высокого поляризующего действия центральной частицы (2е- оболочка, небольшой радиус) происходит деформация электронной плотности атомов кислорода. В результате этого длина связей Ве–О уменьшается, а их энергия возрастает. Это, в свою очередь, уменьшает энергию связи О–Н, увеличивает ее полярность и облегчает отрыв гидратированного иона водорода:


 [
Be(OH2)4]2+
+ HOH [Be(OH2
)3OH]+
+ H3O+
[
Be(OH2)4]2+
+ HOH [Be(OH2
)3OH]+
+ H3O+
Отсюда можно сделать вывод, что с ростом поляризующего действия катионов процесс разрушения молекул Н2О внутренней сферы будет протекать все в большей степени, т.е. степень гидролиза по катиону будет возрастать. Рассуждая аналогичным образом, можно придти к выводу, что при гидролизе по аниону степень гидролиза должна увеличиваться по мере роста поляризующего действия аниона и его деформируемости. Рассмотрим это положение на ряде примеров. Пример 1. NO2– и NO3–
В частице NO2– центральный ион N3+ имеет меньшее поляризующее действие, чем N5+ в NO3–. Поэтому, отрицательные заряды на атомах кислорода в NO2– имеют большее абсолютное значение и характеризуются большей деформируемостью. В результате гидратации этих ионов образуется аквакомплекс с высокой энергией водородной связи, что ведет к ослаблению связи в молекуле Н–О–Н и ее распаду:
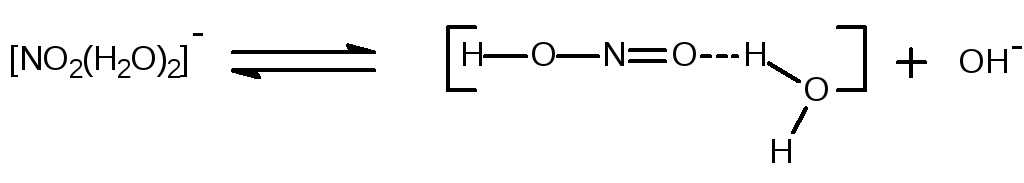
Таким образом, увеличение поляризующего действия центрального иона в анионе кислородной кислоты будет уменьшаться степень гидролиза последнего.
В случае простых анионов с одинаковой электронной структурой и равным зарядом поляризующее действие увеличивается по мере уменьшения радиуса частиц, поэтому степень гидролиза, в частности, возрастает в ряду Te2–<Se2–<S2–. Проведя аналогичные рассуждения, можно показать, что с ростом поляризующего действия центральной частицы в анионах одноосновных кислородных кислот их степень диссоциации будет расти. Например:
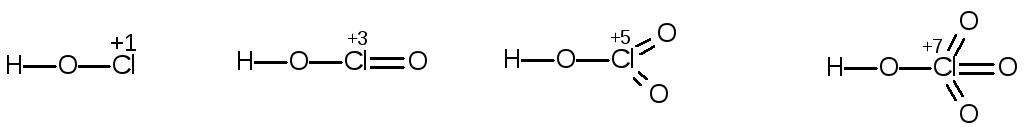
По мере увеличения степени окисления ионов Cln+ их радиус уменьшается, т.е. оба фактора (уменьшение радиуса ионов и рост их заряда) увеличивают поляризующее действие центральной частицы в данном ряду слева направо. Это ведет к увеличению полярности связи Н–О, уменьшению ее энергии и,как следствие, к росту степени диссоциации кислот Кд (НСlO) = 5·10–8, Kд(HСlO2)=2·10–2, HClO3 и HСlO4 – сильные электролиты. По мере сближения поляризующего действия частицы, соединенной с атомом кислорода группы ОН– с поляризующим действием иона Н+, значения констант диссоциации соединений типа R–О–Н по кислотному и основному типу сближаются. Такие электролиты, как известно, называются амфотерными. Если же поляризующее действие Rn+ значительно ниже, чем у иона водорода, наименее полярной и наиболее прочной оказывается связь Н–О-, и такие вещества диссоциируют по основному типу. Например:
![]()
поляризующее действие ионов Crn+ в этом ряду возрастает за счет роста их зарядов и уменьшения радиусов, что способствует увеличению значений констант диссоциации гидроксидов по кислотному типу: «Cr(OH)2» – основание, «Cr(OH)3» – амфотерный электролит, H2СrO4 – сильная кислота.
В малых периодах слева направо свойства гидроксидов, в которых атомы элементов находятся в высшей положительной степени окисления, изменяются от типично основных через амфотерные к кислотным (табл. 12.2).
Таблица 12.2 – Характер гидроксидов и их константы диссоциации по первой (К1) и второй (К2) ступеням.
|
Состав |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H4SiO4 |
H3PO4 |
H2SO4 |
HClO4 |
|
Характер гидроксид. |
сильное основание |
слабое основание |
амфотерный электролит |
слабая кислота |
средняя кислота |
сильная кислота |
сильная кислота |
|
К1 |
|
4·10–1 |
2·10–6 |
1,3·10–10 |
7,6·10–3 |
|
|
|
К2 |
|
3·10–3 |
4·10–13 |
1,6·10–12 |
6,2·10–8 |
1,2·10–2 |
|
С точки зрения теории поляризации такое изменение объясняется тем, что слева направо поляризующее действие ионов Na+–Mg2+–Al3+–Si4+–P5+–S6+–Cl7+ увеличивается за счет уменьшения их радиуса и роста заряда при сохранении 8е оболочки.
В главных подгруппах наблюдается общая тенденция к увеличению сверху вниз основных свойств гидроксидов (при одинаковой степени окисления центрального иона). Это обусловлено увеличением радиусов ионов этих элементов, что приводит к снижению их поляризующего действия (табл. 13.2).
Таблица 13.2. Константы диссоциации гидроксидов по основному типу
|
Состав |
Be(OH)2 |
Mg(OH)2 |
Ca(OH)2 |
Sr(OH)2 |
Ba(OH)2 |
|
К2 |
5·10–11 |
3·10–3 |
4·10–2 |
9·10–2 |
7·10–1 |
Однако, при прогнозе изменения значений констант диссоциации по основному (кислотному) типу, в данном случае необходимо учитывать возможность изменения электронной конфигурации иона. Например:
H3PO4 H2SiO4 H2SO4
К1 7,6·10–3 К1 1,3·10–10 К2 1,2·10–2
Эл. конф. иона 8е 8е 8е
H3AsO4 H2GeO4 H2SeO4
К1 6,0·10–3 К1 11·10–10 К2 9·10–3
Эл. конф. иона 18е 18е 18е
Близость Кд гидроксидов элементов одной и той же подгруппы связана с компенсацией фактора, уменьшающего поляризующее действие ионов (рост радиусов), фактором, увеличивающим их поляризующее действие (изменение электронной конфигурации от 8е к 18е).
Значительное влияние на степень диссоциации гидроксидов оказывает и их химическое строение, например:
(HPO3)3 H4P2O7 H3PO4
H3P3O9
K1 1,14 3,0·10–2 7,6·10–3
К2 2·10–1 4,4·10–3 6,210–8
К3 9·10–3 2,5·10–7 4,410–13
В молекулах всех трех представленных кислот степень окисления фосфора +5, т.е. его поляризующее действие формально одинаково, что может без учета фактора строения этих веществ привести к неверному выводу о близких значениях Кд всех форм фосфорных кислот. На рис.10.2 представлены графические формулы молекул рассматриваемых соединений.
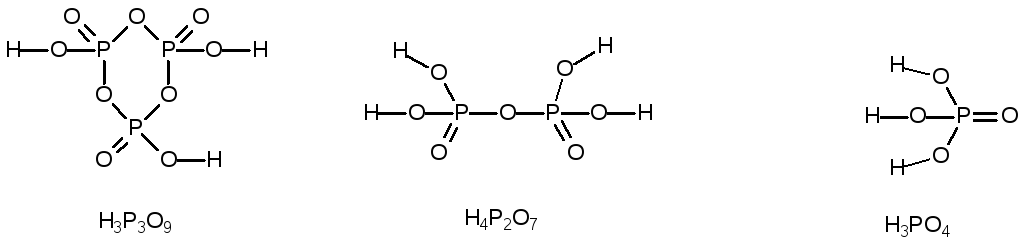
Рис.10.2.. Графические формулы фосфорных кислот
И з
рис.2.5 видно, что причиной изменения Кд
этих кислот является различная
односторонняя деформация ионов О2–
окружающих ион Р5+.
Наибольшую одностороннюю деформацию
испытывают ионы кислорода в
группировке, так как они непосредственно
связаны только с одним атомом фосфора,
что уменьшает положительный заряд
последнего на величину D,
т.е. снижает значение его ПД.
з
рис.2.5 видно, что причиной изменения Кд
этих кислот является различная
односторонняя деформация ионов О2–
окружающих ион Р5+.
Наибольшую одностороннюю деформацию
испытывают ионы кислорода в
группировке, так как они непосредственно
связаны только с одним атомом фосфора,
что уменьшает положительный заряд
последнего на величину D,
т.е. снижает значение его ПД.
П ри
присоединении к одному из атомов
кислорода иона Н+
за счёт контрполяризующего действия
указанной частицы отрицательный заряд
на двух других атомах кислорода
уменьшается, что снижает способность
частицы к присоединению следующих ионов
водорода, т.е. степень гидролиза
последующих форм (кислых ионов) снижается,
а степень диссоциазии их возрастает.
За счёт высокой основности полярность
связи Н–О в молекуле Н3РО4
невелика, что предопределяет относительно
низкие значения ее Кд.
Если же группировки соединяются друг
с другом через атом кислорода, то
поляризующее действие иона фосфора
изменяется мало:
ри
присоединении к одному из атомов
кислорода иона Н+
за счёт контрполяризующего действия
указанной частицы отрицательный заряд
на двух других атомах кислорода
уменьшается, что снижает способность
частицы к присоединению следующих ионов
водорода, т.е. степень гидролиза
последующих форм (кислых ионов) снижается,
а степень диссоциазии их возрастает.
За счёт высокой основности полярность
связи Н–О в молекуле Н3РО4
невелика, что предопределяет относительно
низкие значения ее Кд.
Если же группировки соединяются друг
с другом через атом кислорода, то
поляризующее действие иона фосфора
изменяется мало:
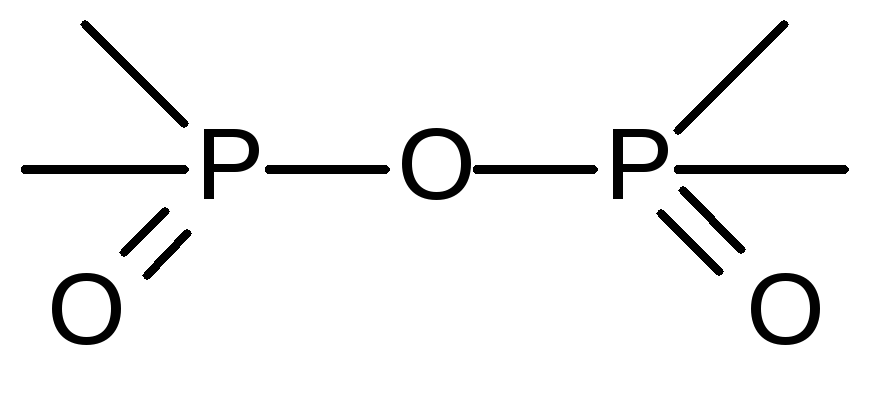
(односторонней деформации электронной плотности иона кислорода в сторону одного из атомов фосфора препятствует равное по величине и противоположное по направлению ПД другого иона фосфора).
Таким образом, при формировании цикла поляризующее действие ионов фосфора, входящих в его состав, оказывается значительно выше, чем у иона фосфора, входящего в состав фосфат-иона, что и предопределяет более высокую степень диссоциации триметафосфорной кислоты по сравнению с H3PO4. Рассуждая аналогичным образом, можно прийти к выводу, что по степени диссоциации H4P2O7 будет занимать промежуточное положение между H3P3O9 и H3PO4. Из выше сказанного следует важный вывод: с ростом числа групп ОН–, непосредственно соединенных с одним и тем же центральным ионом сила кислот будет уменьшаться.
Последовательная ионизация многоосновных кислот и многокислотных оснований также приводит к изменению ПД центральной частицы. При отщеплении иона водорода от группа –ОН, отрицательный заряд на ионе кислорода возрастает, что увеличивает его деформируемость. Это, в свою очередь, приводит к снижению ПД центральной частицы и уменьшению деформации ионов кислорода в оставшихся в анионе групп –ОН. Как было показано выше, это уменьшает значения Кд по кислотному типу:
H3PO4
![]() H+
+ H2PO4–
K1=7,6
· 10-3
H+
+ H2PO4–
K1=7,6
· 10-3
H2PO4–![]() H+
+ HPO42–
K2=6,2
· 10-8
H+
+ HPO42–
K2=6,2
· 10-8
HPO42–
![]() H+
+ PO43–
K3=4,4
· 10-13
H+
+ PO43–
K3=4,4
· 10-13
При диссоциации по основному типу отщепление группы ОН– от гидроксида увеличивает ПД катиона и полярность связи между катионом и анионами кислорода оставшихся групп ОН уменьшается, что затрудняет процесс диссоциации по данному типу. Например, для «Pb(OH)2» константы диссоциации по основному типу составляют: К1=9,5·10–4, К2=3,0·10–8.
Как уже отмечалось ранее, поляризующее действие ионов и их взаимная деформируемость предопределяет не только преимущественный характер диссоциации соединений типа R–О–Н и глубину протекания процесса их ионизации, но и состав этих соединений. Рассмотрим данный вопрос на примере гидроксидов элементов III периода Периодической системы. Например, теоретически гидроксид Р(V) может иметь состав Р(ОН)5. Однако за счет высокого поляризующего действия ионов Р5+ происходит значительная односторонняя деформация электронной плотности анионов кислорода групп ОН, что должно способствовать уменьшению длин связей Р–О–. Но сближение групп ОН с центральной частицей приводит к увеличению отталкивания между ними. Противодействие сил отталкивания и притяжения способствует тому, что часть связей Р–О действительно укорачивается, тогда как другие удлиняются:

Уменьшение длины и полярности связи между ионом фосфора и кислорода, как было показано выше, облегчает отрыв иона Н+, тогда как с ростом длины связи Р–О возрастает вероятность диссоциации соединения по основному типу. В результате этого в системе протекает процесс "внутримолекулярной нейтрализации", сопровождающийся образованием молекулы Н2О. Атом кислорода, оставшийся у иона фосфора после отщепления молекулы Н2О, за счет наличия на нем отрицательного заряда еще сильнее деформируется центральным ионом. Это способствует образованию между этими частицами дополнительной связи и снижению ПД иона фосфора. В связи с уменьшением ПД центральной частицы деформация оставшихся 3-х групп ОН уменьшается, что снижает вероятность дальнейшего протекания процесса, связанного с уменьшением основности кислоты. В тоже время, при бóльшем ПД центральной частицы становятся возможными и последующие его стадии:

Таким образом, можно сделать вывод, что с ростом ПД центрального иона основность кислот будет уменьшаться. (В приведенном примере ионы Р5+, S6+, Cl7+ имеют одинаковое строение электронных оболочек, а их радиусы по Полингу равны r(Р5+)=0,34Å, r(S6+)=0,29Å, r(Cl7+)=0,26Å, что с учетом роста зарядов ионов резко увеличивает ПД по ряду слева направо.)
Ион Si4+ по сравнению с Р5+ характеризуется меньшим ПД, поэтому одной из форм кремниевых кислот является H4SiO4 – ортокремниевая кислота. Снижение ПД центрального иона приводит к сближению значений Кд этого гидроксида по кислотному и основному типу. За счет этого между молекулами данного гидроксида протекает процесс поликонденсации ("межмолекулярной нейтрализации"):
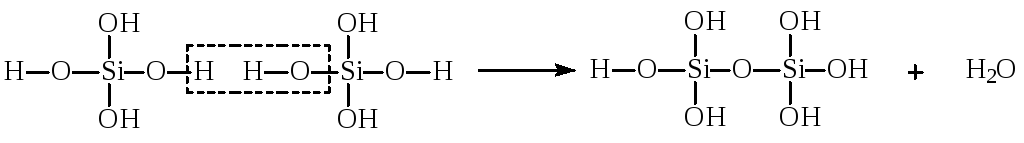
Так как появление атома кислорода между двумя атомами кремния мало влияет на значения ПД центральных частиц, дальнейший процесс поликонденсации приводит к образованию многочисленных полимерных форм кремниевых кислот линейного, слоистого или объемного строения. С ростом степени поликонденсации растворимость образующихся соединений уменьшается, и они выделяются из раствора в виде геля или же образуют с с жидкой фазой коллоидный раствор.
При уменьшении заряда катиона на единицу при сохранении электронной конфигурации иона (Al3+) Кд по кислотному и основному типу остаются достаточно близкими ( в отличие от H4SiO4 Кд гидроксида Al(III) по основному типу больше, чем Кд по кислотному). Это, как мы видели на примере H4SiO4, должно приводить к формированию полимерной структуры этого вещества и выделению его из раствора в виде гелеобразной фазы. Такая же ситуация сохраняется и в случае Кд осн>>Кд кис, однако степень поликонденсации в этом случае значительно ниже, чем в случае гидроксида Al(III). Это, в частности приводит к тому, что растворимость гидроксида Mg(II) в воде в среднем в 1000 раз выше, чем у гидроксида Al(III). При дальнейшем снижении ПД катиона процесс поликонденсации подавляется, поэтому крупных полимерных частиц в растворах NaOH или Ca(OH)2 не фиксируется. Отсюда следует важный в практическом отношении вывод:
Одноядерные формы гидроксидов кислотного типа образуются только в случае достаточно высокого ПД центральной частицы аниона. Эти формы хорошо растворимы в Н2О и имеют высокие значения степени электролитической диссоциации.
При среднем ПД катиона образуются полимерные формы гидроксидов, плохо растворимые в воде и имеющие низкие значения Кд как по основному, так и по кислотному типу.
Гидроксиды катионов, характеризующихся низким ПД, представляют собой кристаллические вещества с преимущественно ионным характером связи. Они хорошо растворимы в воде и их степень диссоциации по основному типу равна 100% (по первой стадии в случае двухкислотных гидроксилов).
В заключение отметим положительные и отрицательные стороны теории поляризации. Ценность любой теории оценивается с точки зрения степени согласования ее выводов с экспериментальными данными. Как следует из выше изложенного, теория поляризации дает правильный прогноз химических и физико-химических свойств разнообразных веществ, предсказывает их строение и состав. Однако выводы этой теории скорее качественные, чем количественные. Например, с ее помощью можно показать, что ВеО·хН2О будет амфотерным и его Кд по основному и кислотному типу имеют низкие значения, но она не позволяет рассчитать абсолютные величины этих констант. С другой стороны успешно интерпретируя изменение свойств соединений с одинаковой электронной структурой (по периодам и подгруппам), теория поляризации сталкивается со значительными трудностями при сравнении строения и свойств соединений, в состав которых входят ионы различных подгрупп с одинаковым строением электронных оболочек. Например, ионы Cr6+ и S6+ имеют 8е оболочку, r(Cr6+)=0,52Å, r(S6+)=0,29Å, следовательно ПД S6+ выше ПД Cr6+, что подтверждается значениями К2 для H2SO4 и H2CrО4, которые равны, соответственно, 1,2·10–2 и 3,2·10–7, и более низкой термической H2CrО4 устойчивостью по сравнению с H2SO4. Но тогда с точки зрения теории поляризации основность хромовой кислоты должна быть выше, чем серной, что не подтверждается на опыте. Hапример, дихромовая кислота могла бы иметь строение:
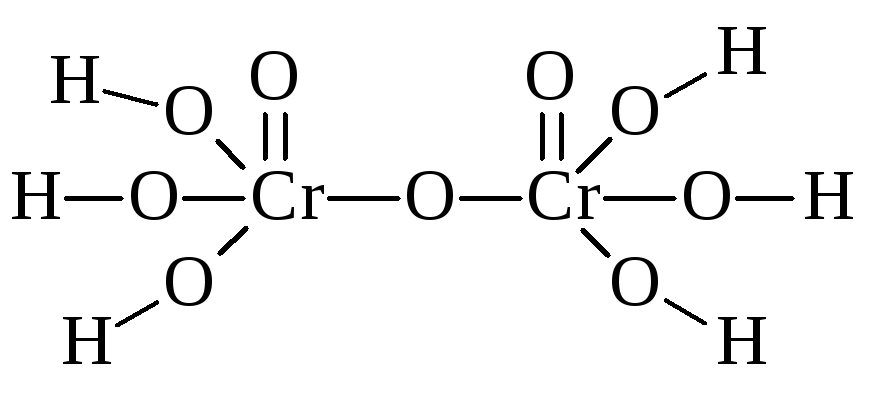
тогда как экспериментально установлено, что она двухосновна:
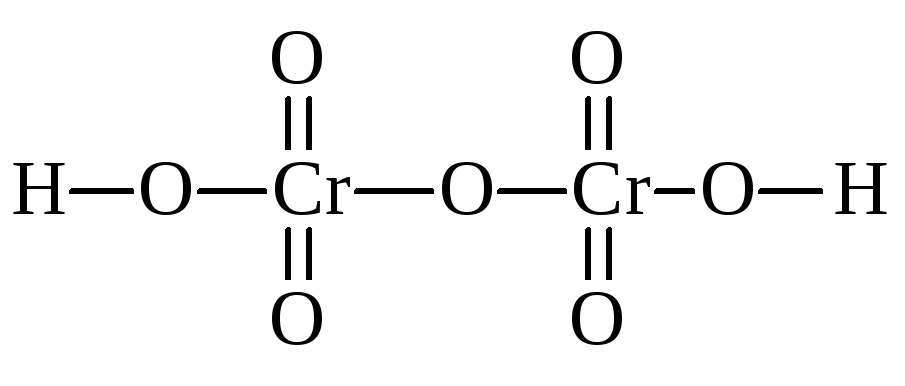
Рассчитать, какая же из представленных форм для дихромовой кислоты энергетически более выгодна, теория поляризации не позволяет. Однако, несмотря на указанные недостатки, рассмотренная теоретическая концепция дает возможность ориентироваться в разнообразном фактическом материале неорганической химии без использования сложных математических расчетов, что выгодно отличает ее от квантовомеханических теорий химической связи.
