- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
Модуль №1
1 Развитие представлений о строении атома
Комплексная цель
В результате изучения данного модуля необходимо познакомиться с историей развития представлений о структуре атома, с достоинствами и недостатками наиболее известных моделей: У.Томсона и Дж.Дж.Томсона ("кексовая"), Э.Резерфорда ("ядерная" или "планетарная"), Н.Бора и Бора–Зоммерфельда ("квантовая") и современная квантово-механическая модель. Нужно научиться анализировать внутреннюю согласованность положений той или иной модели, а также их совместимость с известными на данный момент экспериментальными фактами. Необходимо научиться применять количественные модели для расчета важных атомных характеристик. Поскольку математический аппарат квантово-механической модели не входит в школьную программу, в рамках данной модели необходимо усвоить полуколичественные правила квантования и их влияние на электронное строение атомов и ионов.
Изучая материал, изложенный в модуле, важно усвоить зависимость электронного строения атомов (и одноатомных ионов) от положения элемента в периодической системе, взаимосвязь между строением электронного остова и способом заселения валентных орбиталей. Необходимо научиться анализировать факторы, влияющие важнейшие атомные свойства (орбитальные радиусы, энергии ионизации, сродство к электрону и электроотрицательность) и усвоить закономерности изменения этих свойств в периодах и подгруппах периодической системы.
Содержание
Ранние модели строения атома
Атом (в переводе с греческого – неделимый) долгое время считался простейшей, элементарной частицей мироздания. Но в самом конце XIX века были открыты некоторые явления, а также выполнены эксперименты, результаты которых свидетельствовали о сложности атома:
Радиоактивность (самопроизвольный распад атомов некоторых элементов);
Фотоэффект (испускание электронов металлами, при облучении их светом).
Катодные лучи (испускание потока электронов при создании большой разности потенциалов между двумя металлическими электродами).
Осмысление новых
фактов потребовало изменить представление
об атоме как о примитивном материальном
объекте. Возникла необходимость
задуматься об устройстве атома. 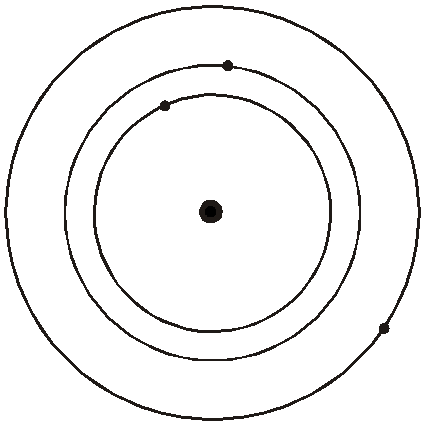
–
Рисунок
1.1- Схема ядерной (планетарной) модели
атома Резерфорда в соответствие с
законами классической механики.
образом, достигалась электронейтральность атома, и качественно объяснялись их спектральные свойства.
– Экспериментальная проверка подобных моделей была выполнена Э.Резерфордом с коллегами. В опытах по рассеянию α-частиц при облучении тонкой золотой фольги было убедительно показано, что в атомах имеется ничтожная по размеру, но очень массивная положительно заряженная частица. Выявленные факты указывали на то, что такая частица в атоме имеется лишь одна. Стало ясно, что отличаются атомы разных элементов величиной положительного заряда этой частицы и числом электронов, суммарный отрицательный заряд которых делает атом нейтральным. Чтобы "предотвратить сближение, прилипание" электронов к положительной частице в предложенной Э.Резерфордом "планетарной" модели строения атома (1911г.) положительная частица размещалась в его центре (ядро атома), а электроны двигались вокруг него по круговым орбитам (как планеты вокруг солнца) под действием центробежной силы.
М
Рисунок
1.2 - Схема движе-ния электрона в модели
Резерфорда в соответствие с законами
классической элек-тродинамики.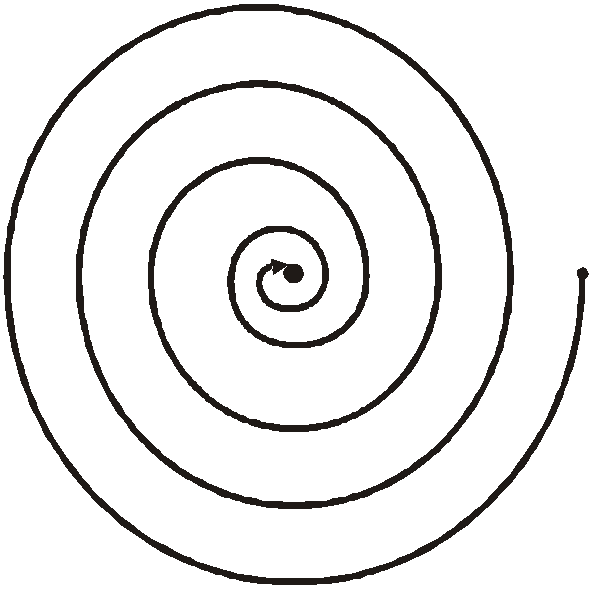 одель
была проста, основана на узнаваемой
аналогии и полностью удовлетворяла
выявленным на тот момент сведениям осоставе
атомов. Но, в то же время, понятная
качественная аналогия с солнечной
системой таила в себе и серьезную
качественную проблему: невозможно
представить, чтобы столкновение с другой
планетарной системой или телом
сопоставимой массы осталось бы без
серьезных взаимных последствий, а
атомы, сталкиваясь, взаимодействуя друг
с другом, не утрачивают своей
индивидуальности, могут быть вновь
выделены в неизменном виде. Более того,
даже в изолированном состоянии атом,
устроенный в соответствии с моделью
Резерфорда, не мог быть стабилен. Дело
в том, что в соответствии с законами
классической электродинамики (раздел
физики, описывающий законы движения
заряженных тел) движущаяся по круговой
орбите заряженная частица (электрон)
обязан испускать энергию. Но при этом
будет нарушаться баланс центробежной
силы и силы кулоновского притяжения
отрицательного электрона к положительному
ядру атома. Поэтому электрон в итоге
должен упасть на ядро. В соответствие
с выполненными оценочными расчетами,
"время жизни" атома в планетарном
виде не должно превышать ~10-8с.
Непрерывное понижение энергии электрона
должно было приводить к "непрерывному",
сплошному спектру
испускания атома, в котором бы
присутствовали компоненты электромагнитного
излучения с разными, непрерывно
меняющимися длинами волн. На самом деле
атомные спектры испускания всегда
содержат набор отдельных линий (линейчатый
спектр). Причем еще в конце
XIXв
были установлены важные закономерности
в их структурах. Простейшая спектральная
картина наблюдалась при термическом
возбуждении атомарного водорода (в
искровой дуге). В воспринимаемой
человеческим глазом части спектра
(рис.1.3(а)) наблюда-
одель
была проста, основана на узнаваемой
аналогии и полностью удовлетворяла
выявленным на тот момент сведениям осоставе
атомов. Но, в то же время, понятная
качественная аналогия с солнечной
системой таила в себе и серьезную
качественную проблему: невозможно
представить, чтобы столкновение с другой
планетарной системой или телом
сопоставимой массы осталось бы без
серьезных взаимных последствий, а
атомы, сталкиваясь, взаимодействуя друг
с другом, не утрачивают своей
индивидуальности, могут быть вновь
выделены в неизменном виде. Более того,
даже в изолированном состоянии атом,
устроенный в соответствии с моделью
Резерфорда, не мог быть стабилен. Дело
в том, что в соответствии с законами
классической электродинамики (раздел
физики, описывающий законы движения
заряженных тел) движущаяся по круговой
орбите заряженная частица (электрон)
обязан испускать энергию. Но при этом
будет нарушаться баланс центробежной
силы и силы кулоновского притяжения
отрицательного электрона к положительному
ядру атома. Поэтому электрон в итоге
должен упасть на ядро. В соответствие
с выполненными оценочными расчетами,
"время жизни" атома в планетарном
виде не должно превышать ~10-8с.
Непрерывное понижение энергии электрона
должно было приводить к "непрерывному",
сплошному спектру
испускания атома, в котором бы
присутствовали компоненты электромагнитного
излучения с разными, непрерывно
меняющимися длинами волн. На самом деле
атомные спектры испускания всегда
содержат набор отдельных линий (линейчатый
спектр). Причем еще в конце
XIXв
были установлены важные закономерности
в их структурах. Простейшая спектральная
картина наблюдалась при термическом
возбуждении атомарного водорода (в
искровой дуге). В воспринимаемой
человеческим глазом части спектра
(рис.1.3(а)) наблюда-
а
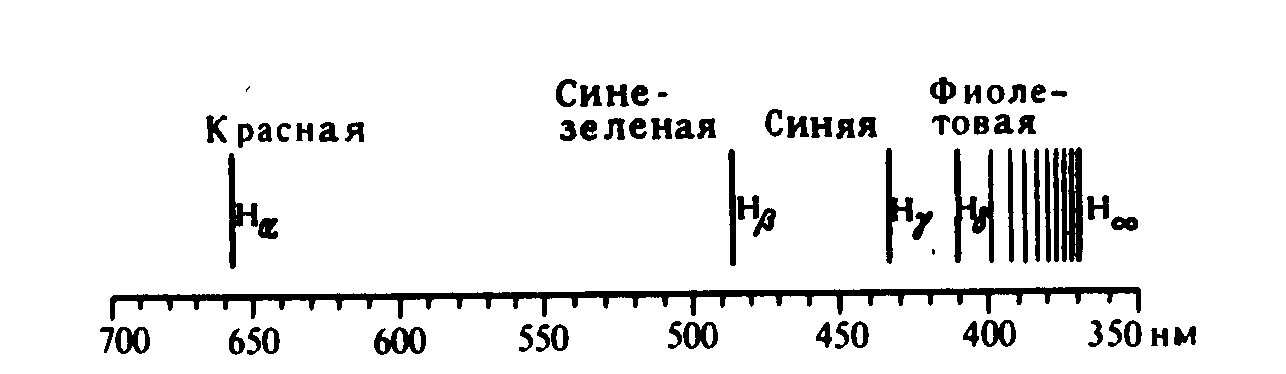
б
-
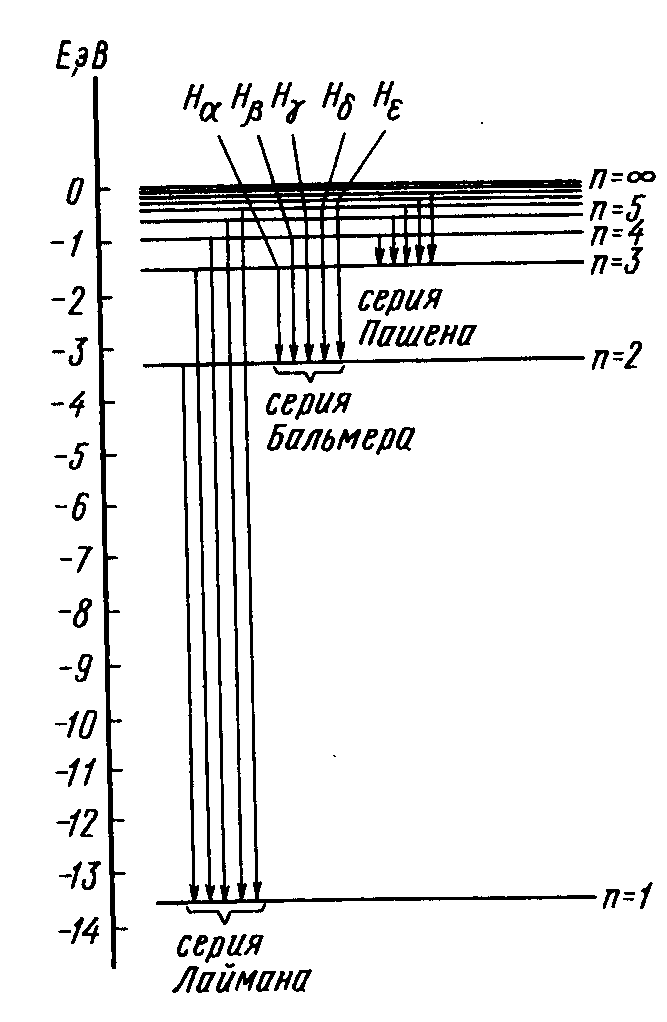
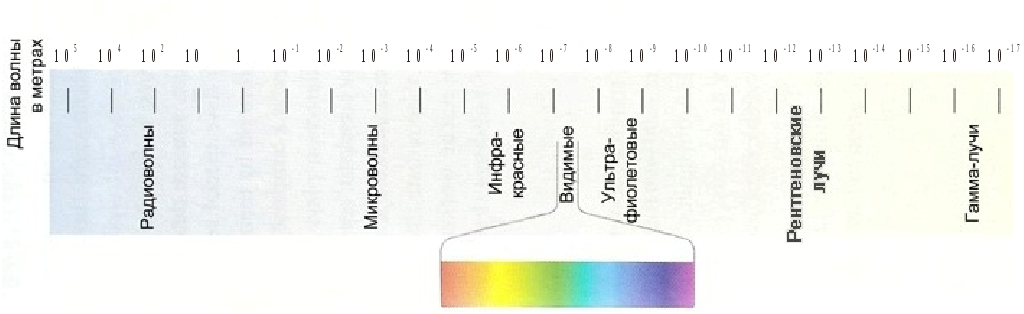
Рисунок 1.3 – Полный энергетический спектр электромагнитного излучения (а) и спектр испускания атома водорода (б)
ются четыре отдельные линии (рис.1.3(б)). В 1885г. швейцарский физик И.Я.Бальмер эмпирическим путем установил, что длины волн соответствующих линий пропорциональны одному изменяющемуся целому числу:
![]() (1.1)
(1.1)
где λ0 – некоторая постоянная длина волны; n принимает целые значения 3, 4, 5 и т.д.
В 1900г. шведский физик И.Р.Ридберг, анализируя спектральные свойства, в том числе, других элементов, показал, что подобные закономерные серии наблюдаются и в спектрах испускания атомов других элементов, причем они все могут быть описаны одной обобщенной формулой:
![]() =
R·(1/n12
– 1/n22)
(1.2)
=
R·(1/n12
– 1/n22)
(1.2)
где
константа R
= 109 677
см-1
получила в дальнейшем название постоянной
Ридберга; n2>n1
– целые числа;
![]() -так называемые,
волновые
числа линий– величины, обратные
длине волны соответствующих
колебаний:
-так называемые,
волновые
числа линий– величины, обратные
длине волны соответствующих
колебаний:
Е
= h·ν
= h·
C/λ,
соответственно λ
= C/ν,
тогда ![]() =
1/λ
= ν/С.
=
1/λ
= ν/С.
Еще раз отметим, что модель атома, предложенная Резерфордом, не объяснила накопленных данных по спектральным свойствам атомов, более того, она фактически им противоречила. Это все прекрасно понимал и сам Э.Резерфорд. Он откровенно признавал, что для устранения и построения полноценной теории строения атома на тот момент не было достаточной информации о свойствах микрочастиц (в частности, электронов). Поэтому важнейшим ценным результатом считал обоснование наличия в составе атома тяжелой положительной частицы и называл предложенную модель "ядерной".
Наличие ядра в последующих моделях никогда не оспаривалось. Уточнялся их состав, анализировалась природа внутриядерных сил, изучались особенности реакций распада и синтеза ядер. Решающий вклад в эти исследования внес Э.Резерфорд и его ученики. Им был предложен термин "протон" (как название ядра самого простого атома водорода), теоретически обосновано наличие нейтронов в ядрах других атомов, предсказано наличие изотопов и многое другое.
Но самым сложным долгое время оставалось описание законов движения электронов. Законы классической механики И.Ньютона не давали согласия с важнейшими (в первую очередь, оптическими) свойствами атомов. В 1913г. Н.Бор впервые попытался описать энергетические состояния электрона в простейшем атоме водорода с использованием квантовой теории электромагнитного излучения, незадолго до этого разработанной М.Планком. Последовательно обосновать свою модель атома Н.Бору не удалось, поэтому он сформулировал ее основные положения в виде постулатов (неочевидные утверждения, данные без доказательства). Это было явным недостатком модели, но в, то же время, она была внутренне достаточно хорошо согласована. С помощью высказанных идей было дано качественное объяснение устойчивости электронной структуры атома (почему электрон не падает на ядро), линейчатого спектра испускания атомов. расчетным путем удалось получить важные атомные характеристики водорода, прекрасно согласовавшиеся с экспериментом (радиус атома, длины волн тех спектральных линий, которые находятся в видимой и в ближней инфракрасной областях энергетического спектра1). Более того, Бор предсказал наличие еще нескольких серий в спектре испускания атома водорода (в ультрафиолетовой и дальней инфракрасной областях). В 1915-1953гг. соответствующий участок спектра атома водорода был экспериментально установлен и расшифрован Лайманом (1915г.), Брэкетом (1922г.), Пфундом (1924г.) и Хемфри (1953г.).
В современной учебной литературе постулаты Н.Бора обычно формулируются следующим образом:
– В атоме водорода электрон вращается вокруг ядра по некоторой стационарной круговой орбите и удерживается на ней под действием центростремительной силы кулоновского взаимодействия.
Стационарность орбит подразумевала неизменность их характеристик, в том числе и энергии. Таким образом, обосновывалась стабильность атома: электрон на стационарной орбите не должен испускать (терять) энергию. Электростатический характер центростремительной силы позволяет записать выражение:
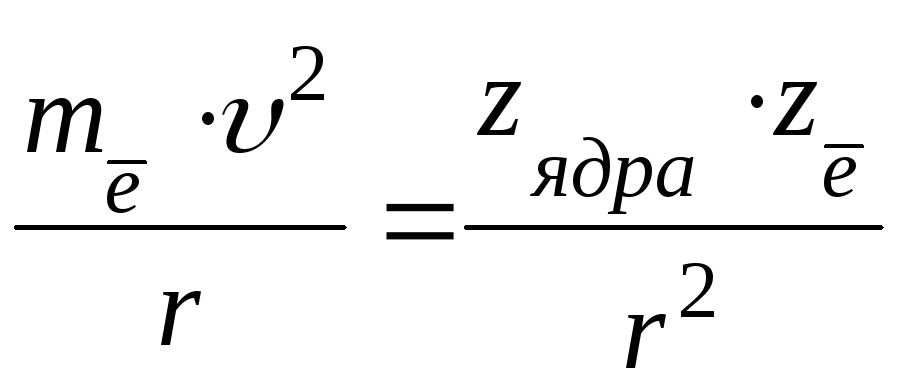 или
в системе
СИ
или
в системе
СИ
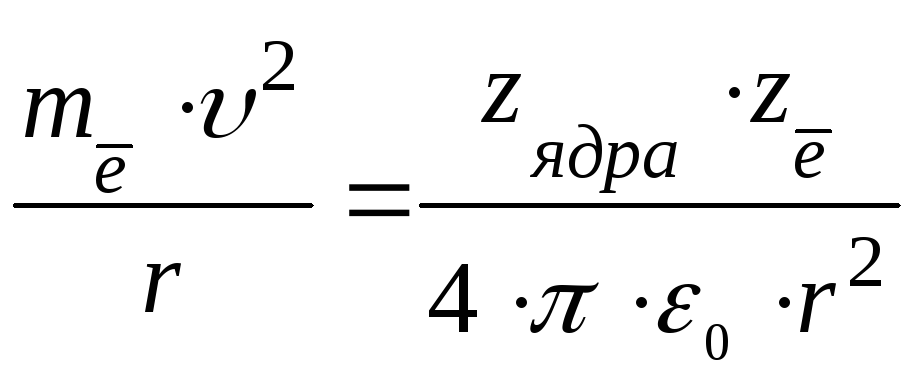 ,
(1.3)
,
(1.3)
где mē, zē, υ – масса, заряд электрона и скорость его движения по орбите радиусом r вокруг ядра с зарядом zядра, ε0 – относительная диэлектрическая проницаемость вакуума.
– В атоме имеется множество разрешенных стационарных орбит, энергия которых меняется дискретно (квантуется).
Строго говоря, Н.Бор постулировал представление о квантованности момента количества движения электрона на разных орбитах:
![]() или
mē·υ·r
= n·ћ,
(1.4)
или
mē·υ·r
= n·ћ,
(1.4)
Здесь произведение в левой части равенства – момент количества движения электрона по орбите радиусом r, h – постоянная Планка, ћ = h/2·π – часто называют постоянной Дирака, n – целочисленный сомножитель (квантовое число, n ≥ 1). Таким образом, момент количества движения электрона в атоме по модели Бора не может иметь любые (произвольные) значения, а зависит от выбранного значения n:
|
Некоторые возможные значения n |
1 |
2 |
3 |
|
Соответствующие значения момента количества движения электрона |
ћ |
2·ћ |
3·ћ |
Как будет показано ниже, это привело к выводу о дискретности энергетических состояний электрона. Состояние атома, когда электрон находится на орбите с минимальной энергией, называется основным, а все прочие – возбужденными. Таким образом, энергия электрона может меняться только при переходе с одной стационарной орбиты на другую (квантовый скачок). Для возбуждения электрона (атома) требуется поглощение энергии (обычно тепловой, но возможны и другие варианты), а при переходе на орбиты с более низкой энергией должно наблюдаться выделение энергии. Причем количество однократно выделяемой порции энергии (квант) равно разности энергий соответствующих орбит:
Екванта энергии = h·ν = Еорбиты na – Еорбиты nb (1.5)
(na > nb)
Из этого выражения следует, что величина кванта энергии (длина волны порции излучения) зависит от номеров орбит. Это качественно объясняет линейчатость спектра испускания атомов.
Таким образом, с помощью сформулированных постулатов Н.Бору удалось преодолеть принципиальные недостатки планетарной (ядерной) модели строения атома, предложенной Э.Резерфордом.
Теперь рассмотрим подробней предложенные количественные соотношения:
 (1.6)
(1.6)
mē·υ·r = n·ћ. (1.7)
В этой системе уравнений две величины были на тот момент неизвестны: скорость движения электрона и радиус орбиты. Они обе могут быть выражены через константы, входящие в эти выражения.
Если обе части первого уравнения умножить на mē·r3, получим
![]() (1.8)
(1.8)
Левая часть этого равенства представляет собой квадрат левой части выражения (1.4), тогда и правая часть равенства (1.8) может быть приравнена квадрату правой части выражения (1.4):
![]() (1.9)
(1.9)
Отсюда
 или
или ![]() (1.10)
(1.10)
Если данное выражение подставить в уравнение (1.4), то получим
![]() (1.11)
(1.11)
Видно, что радиусы орбит и скорости движения электрона по ним меняются дискретно в зависимости от значения квантового числа n: с увеличением номера орбиты растет ее размер и уменьшается скорость электрона на ней. Используя значения соответствующих констант, можно, например, рассчитать радиус первой боровской орбиты (радиус атома водорода в основном состоянии):
rn=1 = 0.53 Ǻ
(предварительные оценки, основанные на свойствах жидкого
и твердого водорода, давали результат ~1Å).
Энергетический спектр водорода можно проанализировать, если получить формулу для полной энергии электрона в зависимости от главного квантового числа:
Кинетическая энергия движения электрона
Екин = mē·υ2/2 или после подстановки υ из формулы (1.11)
Екин
= 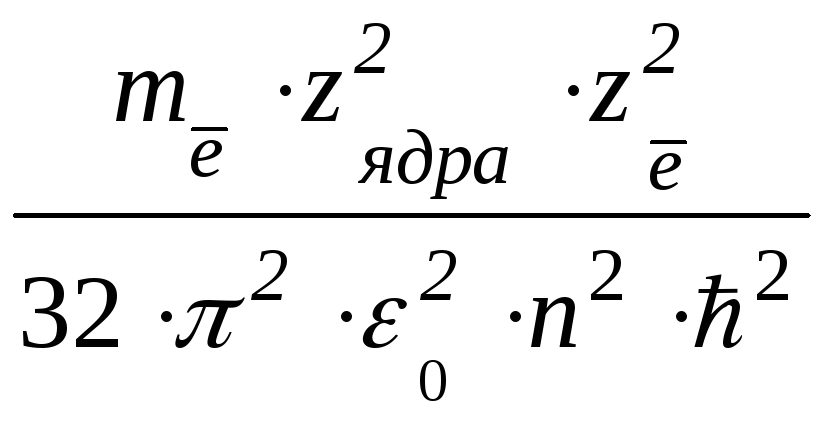 или Екин
=
или Екин
=  (1.12)
(1.12)
Потенциальная энергия взаимодействия электрона с электрическим полем ядра
Епот
= – ![]() (1.13)
(1.13)
или после подстановки r из формулы (1.10)
Епот
= – 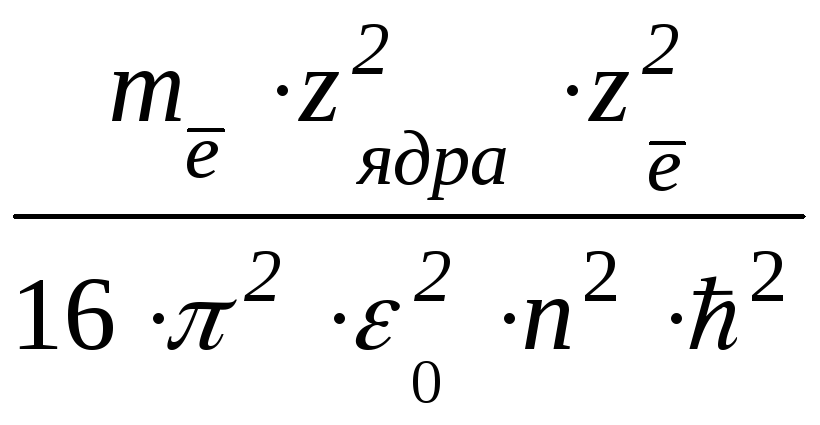 или Епот
= –
или Епот
= – 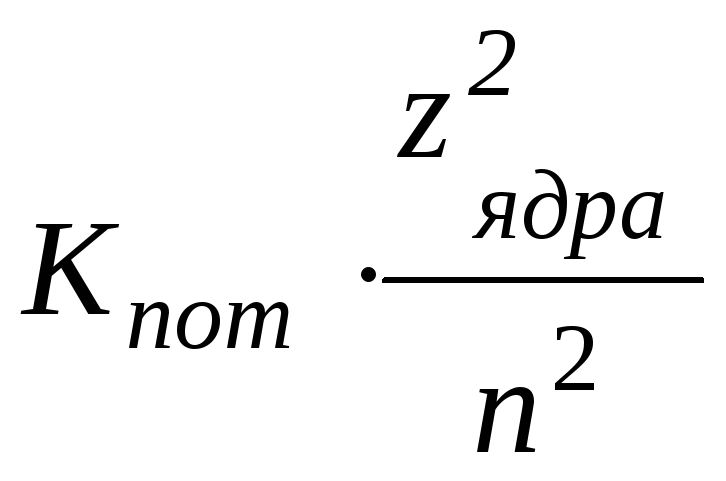 (1.14)
(1.14)
Полная энергия электрона в атоме водорода
ЕΣ
= – 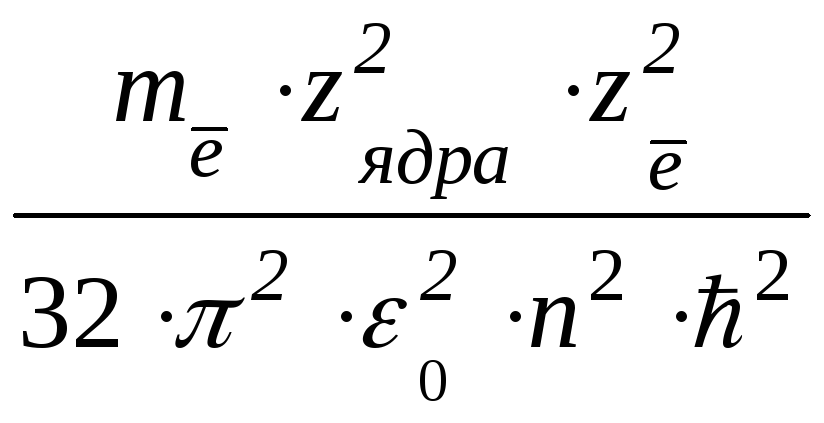 или ЕΣ
= –
или ЕΣ
= –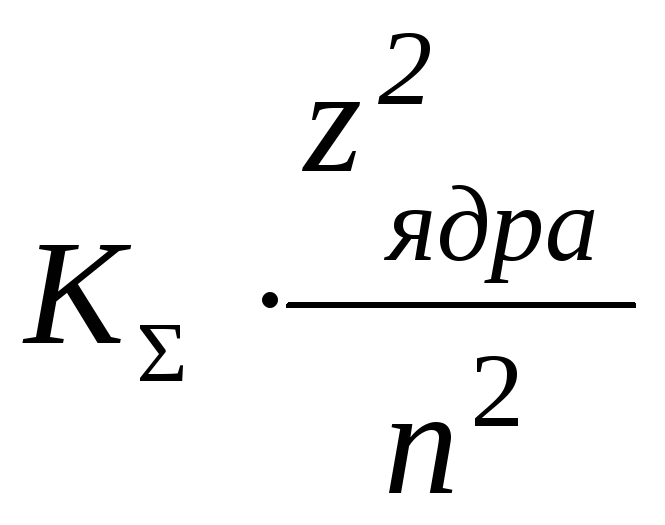 .
(1.15)
.
(1.15)
Тогда при переходе с высоколежащей на низколежащую орбиту выделяется квант энергии
h·ν
=  ·(1/na2
–
1/nb2)
(1.16)
·(1/na2
–
1/nb2)
(1.16)
Соответственно, частота колебаний испускаемого электромагнитного излучения находится:
ν
= 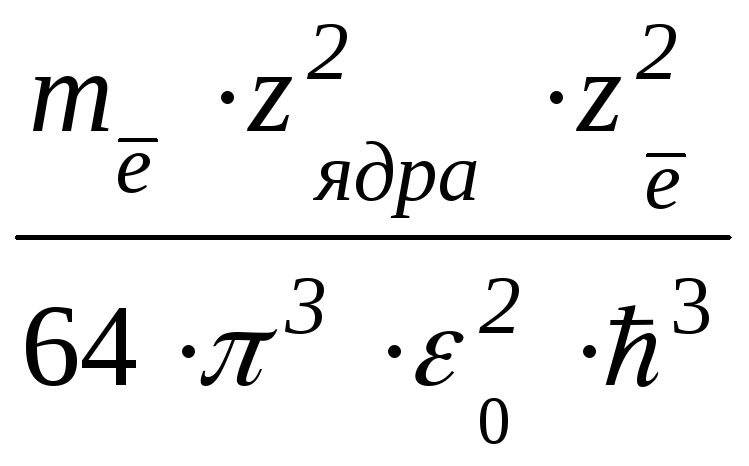 ·(1/na2
–
1/nb2)
(1.17)
·(1/na2
–
1/nb2)
(1.17)
Обычно для характеристики спектральных свойств атомов (и веществ) используют волновые числа (стр.10), то:
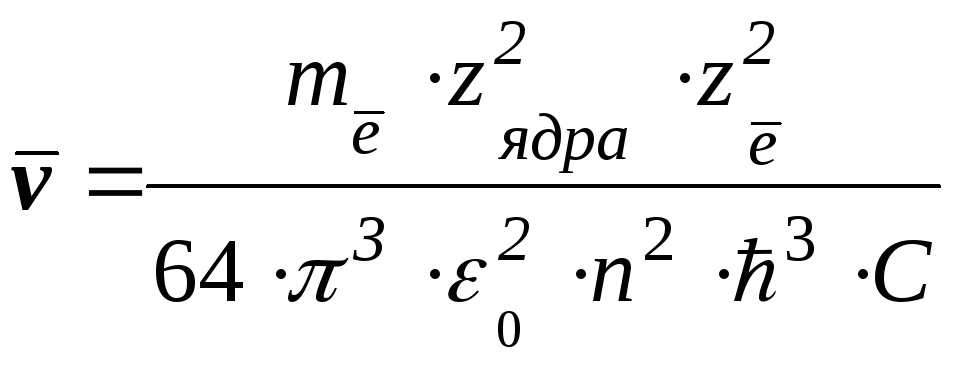 (1.18)
(1.18)
и, объединяя уравнения (1.16) и (1.18), получаем:
![]() =
R·(1/na2
– 1/nb2)
(1.19)
=
R·(1/na2
– 1/nb2)
(1.19)
где R – константа Ридберга, ранее найденная опытным путем при изучении атомных спектров и впервые рассчитанная Н.Бором через фундаментальные константы:
R
= 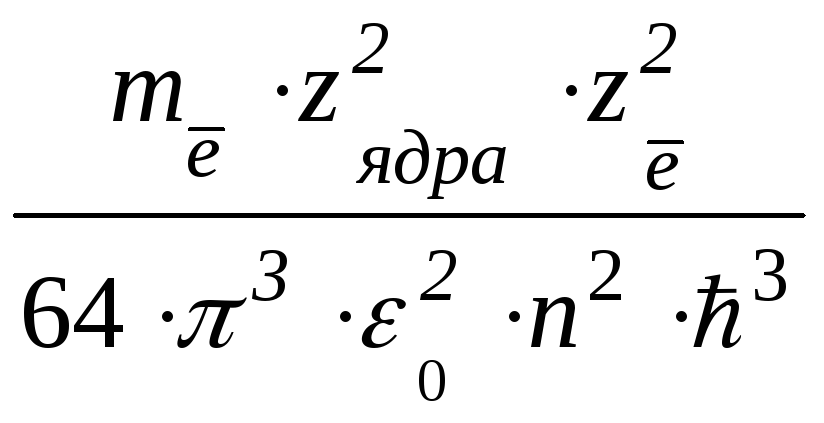 (1.20)
(1.20)
|
| |
|
Рисунок 1.4 – Схема энергетических уровней в атоме водорода (модель Бора) и квантовые переходы, складывающиеся в спектральные серии (без учета тонких эффектов). |
|
С использованием этой формулы, как уже отмечалось ранее (стр.11), Н.Бору удалось обосновать известные на тот момент спектральные серии Бальмера и Пашена, как результат выделения энергии при возвращении возбужденных электронов на вторую и третью атомные орбиты. Кроме того, была предсказана серия линий, которые должны были соответствовать переходу возбужденных электронов в основное состояние атома водорода (на орбиту с n=1,… серия Лаймана,… см. стр.11, а также рис.1.4).
Теория Н.Бора, разработанная для атома водорода, позволила успешно объяснить спектральные свойства, энергии ионизации и других одноэлектронных частиц (He+, Li2+, В3+ и т.п.). Однако попытки применить эту модель для описания спектров сложных атомов (даже в случае двухэлектронного атома Не) оказались неудачными. К тому же, в ходе совершенствования техники эксперимента было показано, что даже спектр одноэлектронных частиц состоит не из набора отдельных линий. В зависимости от разрешающей способности спектрометра или отдельные линии (тонкая структура), или все (сверхтонкая структура спектров) "расщеплялись" на сочетания нескольких близко расположенных дублетов, триплетов и более сложных мультиплетов.
В 1916-1924гг. А.Зоммерфельд опубликовал несколько работ, в которых, модернизируя идеи Бора (теория Бора-Зоммерфельда), показал, что тонкую структуру спектров атома водорода, Не+, щелочных металлов можно объяснить, если допустить, что в пределах одного энергетического уровня (при одном значении n) имеется несколько близких по энергии орбит: не только круговых, но и эллиптических. Он ввел понятие второго (побочного) квантового числа (k), связанного с орбитальным движением электронов. При этом предполагалось, что главное квантовое число (n) определяет размер большой полуоси данного семейства эллипсов (в частном случае окружности – ее радиус). Величина малой полуоси определяется побочным квантовым числом, которое также принимает только целочисленные значения, но не больше главного. Например, для главного квантового числа n = 3 возможны три типа эллипсов (31, 32 и 33), для которых соотношение между величинами большой и малой полуоси равны 3:1, 3:2 и 3:3, соответственно. В последнем случае имеем дело с частным случаем эллипса – окружностью. Это позволило объяснить небольшое различие в энергии орбит с одинаковым главным квантовым числом n.
Если электроны вращаются только по круговым орбитам, то электрон, находящийся на внешней орбите, слабей связан с ядром не только из-за большего расстояния, но и по причине экранирования заряда ядра внутренними электронами: в идеале каждый внутренний электрон формально на единицу уменьшает величину заряда, действующего на последующие электроны. В модернизированной модели Бора-Зоммерфельда (рис.1.5) при одном и том же n электрон на более вытянутой орбите в процессе своего движения оказывается непосредственно вблизи ядра и, тем самым, проникает под экранирующую оболочку и поэтому на части своей траектории испытывает действие возрастающего заряда ядра. Отсюда следует, что сильно вытянутые эллиптические орбиты будут обладать дополнительной стабильностью, более низкой энергией.
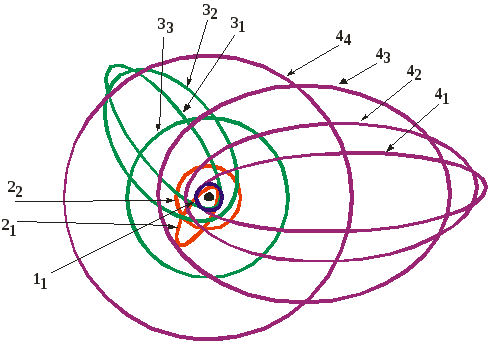
|
Рисунок 1.5 – Схема модели строения атома по Бору-Зоммерфельду. |
Однако даже такого усовершенствования оказалось недостаточно, чтобы объяснить сверхтонкую структуру спектров (пришлось вводить, уже малообоснованно, понятие о третьем квантовом числе). Еще большие проблемы возникали при попытке объяснить структуру периодической системы элементов. Такие попытки предпринимались, но они, опять же, требовали введения дополнительных правил, ограничений, не вытекавших из теории. И, наконец, теории Бора, Бора-Зоммерфельда были совершенно непригодны для количественного описания межатомного взаимодействия, теории химической связи. Например, не удалось получить приемлемого совпадения с экспериментальными значениями энергии связи, межатомного расстояния не только в простейшей молекуле Н2, но и в одноэлектронной частице Н2+. расчет по модели Н.Бора давал отрицательное значение энергии связи для молекулярного иона Н2+. Это означало, что существовать он не может. На самом деле ион такой известен и энергия связи в нем составляет ~255 кДж/моль.