
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
3.3. Метод молекулярных орбиталей (ммо).
Рассмотренные выше недостатки МВС способствовали развитию другого квантовомеханического метода описания химической связи, который получил название метода молекулярных орбиталей (ММО). Основные принципы данного метода были заложены Ленардом-Джонсом, Гундом и Малликеном. В его основе лежит представление о многоатомной частице как о единой системе ядер и электронов. Каждый электрон в такой системе испытывает притяжение со стороны всех ядер и отталкивание со стороны всех других электронов. Такую систему удобно описывать при помощи молекулярных орбиталей, которые являются формальными аналогами атомных орбиталей. Отличие атомных и молекулярных орбиталей заключается в том, что одни описывают состояние электрона, находящегося в поле единственного ядра, а другие состояние электрона в поле нескольких ядер. Учитывая аналогичность подхода к описанию атомных и молекулярных систем, можно сделать вывод, что орбитали n-атомной молекулы должны обладать следующими свойствами:
а) состояние каждого электрона в молекуле описывается волновой функцией ψ, а величина ψ2 выражает вероятность нахождения электрона в любом единичном объёме многоатомной системы; указанные волновые функции называют молекулярными орбиталями (МО) и они, по определению, являются многоцентровыми, т.е. описывают движение электрона в поле всех ядер (вероятность нахождения в любой точке пространства);
б) каждая молекулярная орбиталь характеризуется определённой энергией;
в) каждый электрон в молекуле имеет определённое значение спинового квантового числа, принцип Паули в молекуле выполняется;
г) молекулярные орбитали конструируются из атомных, путём линейной комбинации последних: ∑сnψn ( если общее число использованных при суммировании фолновых функций равно k, то n принимает значения от 1 до k), сn – коэффициенты;
д)минимум энергии МО достигают при максимальном перекрывании АО;
е) чем ближе по энергии исходные АО, тем ниже энергия МО, сформированных на их основе.
Из последнего положения можно сделать вывод, что внутренние орбитали атомов, имеющие очень низкую энергию, практически не будут принимать участия в образовании МО и их вкладом в энергию этих орбиталей можно пренебречь.
С учётом описанных выше свойств МО рассмотрим их построение для двухатомной молекулы простого вещества, например для молекулы Н2. Каждый из атомов, составляющих молекулу (НА и НВ) имеют по одному электрону на 1s орбитале, тогда МО можно представить в виде:
ΨМО = сАψА(1s) + сВ ψВ(1s)
Так как в рассматриваемом случае атомы, образующие молекулу идентичны, нормирующие множители (с), показывающие долю участия АО при конструировании МО, равны по абсолютному значению и, следовательно возможны два варианта ΨМО при сА = сВ и сА = - сВ:
ΨМО(1) = сАψА(1s) + сВ ψВ(1s) и
ΨМО(2) = сАψА(1s) - сВ ψВ(1s)
Молекулярная орбиталь ΨМО(1) соответствует состоянию с более высокой электронной плотностью между атомами по сравнению с изолированными атомными орбиталями, а электроны располагающиеся на ней и имеющие противоположные значения спинов в соответствии с принципом Паули – более низкую энергию по сравнению с их энергией в атоме. Такая орбиталь в ММО ЛКАО называется связывающей.
В то же время молекулярная орбиталь ΨМО(2) представляет собой разность волновых функций исходных АО, т.е. характеризует состояние системы с пониженной электронной плотностью в межъядерном пространстве. Энергия такой орбитали выше, чем исходных АО и нахождения на ней электронов приводит к росту энергии системы. Такие орбитали носят название разрыхляющих. На рисунке 29.3 показано формирование связывающей и разрыхляющей орбиталей в молекуле водорода.
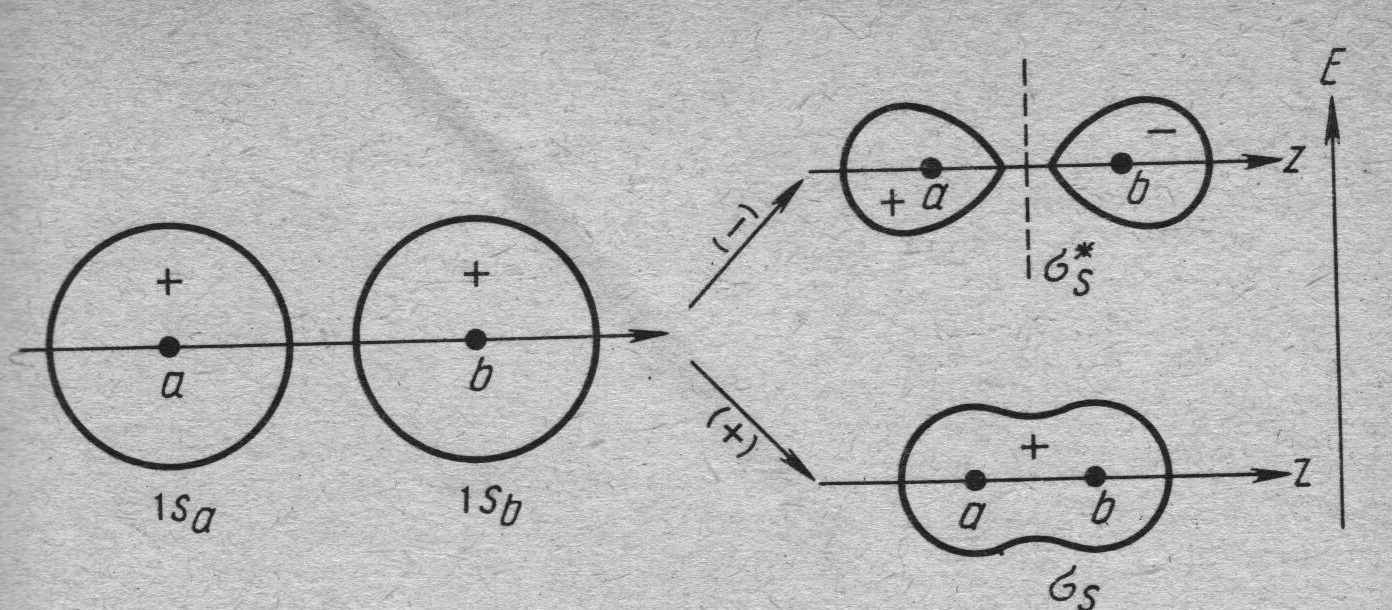
Рис.29.3. Образование σ - связывающей и σ-разрыхляющей орбиталей в молекуле водорода.
ΨМО(1) и ΨМО(2) имеют цилиндрическую симметрию относительно оси, проходящей через центры ядер. Орбитали такого типа называются σ – симметричными и записываются: связывающая – σ1s, разрыхляющая - σ٭1s . Таким образом молекуле водорода в основном состоянии отвечает конфигурация σ1s2, а конфигурации иона Не2+, который образуется в электрическом разряде, в основном состоянии может быть записана в виде σ1s2 σ٭1s (рис. 30.3).
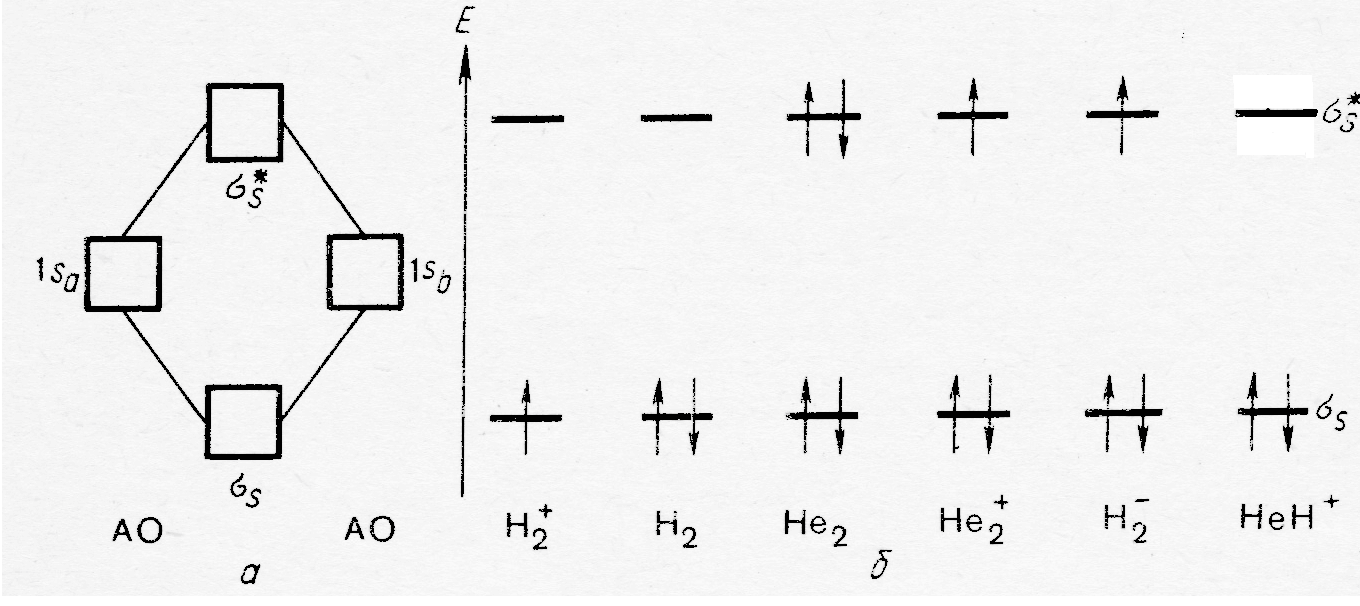
Рис. 30.3. Энергетическая диаграмма образования связующей и разрыхляющей орбиталей и электронное строение молекул и ионов элементов первого периода.
В молекуле Н2 оба электрона занимают связывающую орбиталь, что приводит к снижению энергии системы по сравнению с исходной (два изолированных атома водорода). Как уже отмечалось энергия связи в этой молекуле 435 кДж/моль, а длина связи равна 74 пм. Удаление электрона со связывающей орбитали повышает энергию системы (понижает стабильность продукта реакции по сравнению с прекурсором): энергия связи в Н2+ составляет 256 кДж/моль, а длина связи увеличивается до 106 пм. В частице Н2- число электронов увеличивается до трёх, поэтому один из них располагается на разрыхляющей орбитали, что приводит к дестабилизации системы по сравнению с ранее описанными: Е(Н2-) = 14,5 кДж/моль. Следовательно, появление электрона на разрыхляющей орбитали в большей степени влияет на энергию химической связи, чем удаление электрона со связывающей орбитали. Приведённые выше данные свидетельствуют о том, что суммарная энергия связи определяется разностью между числом электронов на связывающих и разрыхляющих орбиталях. Для бинарных частиц эта разность, делённая пополам называется порядком связи:
ПС = (ēсв – ēнесв.)/2
Если ПС равен нулю, то химическая связь не образуется (молекула Не2 рис 30.3). Если в нескольких системах число электронов на разрыхляющих орбиталях одинаково, то наибольшую стабильность имеет частица с максимальным значением ПС. В то же время при одинаковом значении ПС более стабильна частица с меньшим числом электронов на разрыхляющих орбиталях ( например, ионы Н2+ и Н2-). Из рисунка 30.3 следует и ещё один вывод: атом гелия может образовывать химическую связь с ионом Н+. Несмотря на то, что энергия 1s орбитали Не очень низка (- 2373 кДж/моль), её линейная комбинация с 1s орбиталью атома водорода (Е =-1312 кДж/моль) приводит к образованию связывающей орбитали, энергия которой ниже АО гелия. Так как на разрыхляющих орбиталях частицы НеН+ нет электронов, она более стабильна, по сравнению с системой образованной атомами гелия и ионами водорода.
Аналогичные рассуждения применимы и к линейным комбинациям атомных р-орбиталей. Если ось z совпадает с осью, проходящей через центры ядер, как показано на рисунке 31.3, то связывающая и разрыхляющая орбитали описываются уравнениями:
ΨМО(1) = сАψА(2рz) + сВ ψВ(2рz) и ΨМО(2) = сАψА(2рz) - сВ ψВ(2рz)
Когда МО конструируются из р-орбиталей, оси которых перпендикулярны линии соединяющей атомные ядра, то происходит образование π-связывающих и π-разрыхляющих молекулярных орбиталей рис.32.3. Молекулярные πу2р и πу٭ 2р- орбитали аналогичны представленным на рис. 32.3, но повёрнуты относительно первых на 90о. Таким образом π2р и π٭ 2р- орбитали дважды вырождены.
Следует отметить, что линейную комбинацию можно строить не из любых АО, а только из тех, которые обладают достаточно близкой энергией и перекрывание которых возможно с геометрической точки зрения. Парами таких орбиталей пригодными для образования σ-связывающих σ-разрыхляющих орбиталей могут s – s, s – pz, s – dz2 , pz – pz, pz – dz2 , dz2 - dz2, тогда как при линейной комбинации px – px, py – py, px – dxz, py – dyz, образуются молекулярные π-связывающие и π-разрыхляющие молекулярных орбитали.
Если же строить МО из АО типа dx2-y2 - dx2-y2 или dxy - dxyто образуются δ-МО. Таким образом, как отмечалось выше, деление МО на σ,π и δ предопределяется их симметрией относительно линии соединяющей атомные ядра. Таким образом, для σ-МО число узловых плоскостей равно нулю, π-МО имеет одну такую плоскость, а δ-МО – две.
Для описания в рамках ММО ЛКАО гомоатомных молекул второго периода необходимо учесть, что линейная комбинация атомных орбиталей возможна только в том случае, когда АО орбитали близки по энергии и обладают одинаковой симметрией.
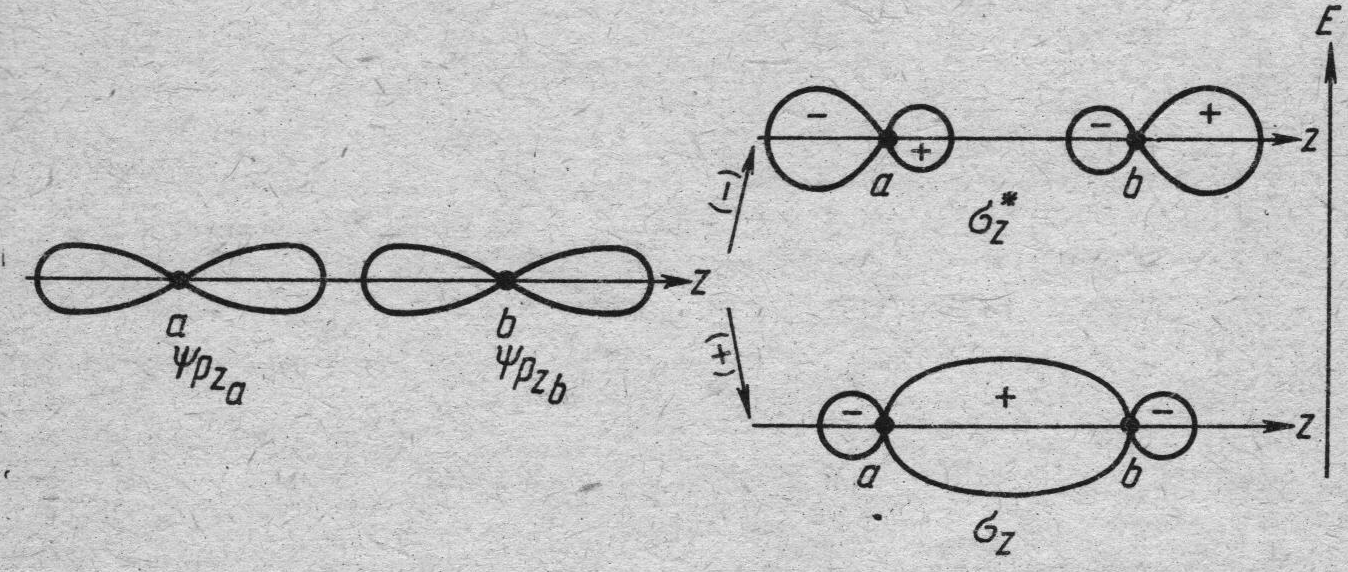
Рис.31.3. Образование σ-связывающих σ-разрыхляющих орбиталей из атомных р-орбиталей
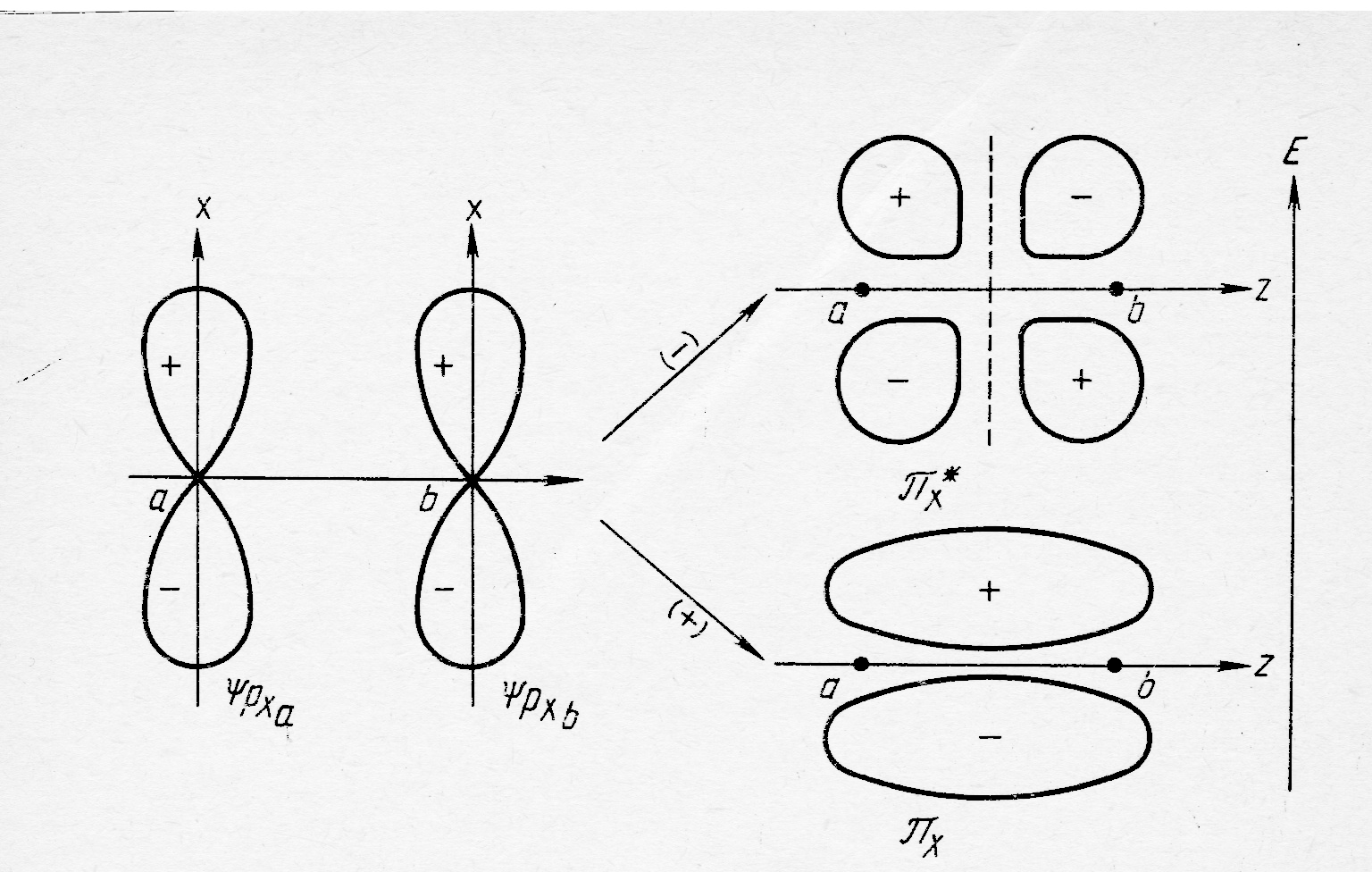
Рис.32.3.Образование π-связывающих и π-разрыхляющих молекулярных орбиталей из атомных р-орбиталей.
Из орбиталей второго периода одинаковой симмерией относительно оси z обладают орбитали 2s и 2pz. Различие в их энергиях для атомов Li, Be, B и C относительно невелико, поэтому волновые функции 2s и 2p в данном случае могут смешиваться. Для атомов O и F различия в энергии 2s и 2p значительно больше, поэтому их смешение не происходит (таблица 4.3)
Таблица 4.3.
∆Е энергии между 2s и 2p орбиталями различных элементов
-
атом
∆Е в эВ
атом
∆Е в эВ
Li
1,85
N
10,9
Be
2,73
O
15,6
B
3,37
F
20,8
C
4,18
Согласно данными таблицы 4.3, а также проведённых расчётов показано, что относительная энергия МО различна для молекул Li2 – N2 c одной стороны и для молекул О2 – F2 c другой. Для молекул первой группы порядок возрастания энергии МО можно представить в виде ряда:
σ2sσ٭2sπ2px π2py σ2pzπ٭2px π٭2py σ٭2pz, а для молекул О2 и F2 в виде:
σ2sσ٭2sσ2pzπ2px π2py π٭2px π٭2py σ٭2pz ( рис 33.3).
Орбитали типа 1s имеющих очень низкую энергию по сравнения с орбиталями второго энергетического уровня, переходят в молекулу в неизменном виде, т.е остаются атомными и на энергетической диаграмме молекулы не указываются.
На основе энергетических диаграмм молекул и молекулярных ионов можно сделать выводы о стабильности частиц и их магнитных свойствах. Так о стабильности молекул, МО которых конструируются из одинаковых АО, ориентировочно можно судить по значению порядка связи, а о магнитных свойствах – по числу неспаренных электронов на МО (рис.34.3).
Необходимо отметить , что АО орбитали не валентных, внутренних уровней с точки зрения ММО ЛКАО не принимают участия в образовании МО, но оказывают заметное влияние на энергию связи. Так, например, при переходе от Н2 к Li2 энергия связи понижается более чем в четыре раза ( с 432 кДж/моль до 99 кДж/моль).
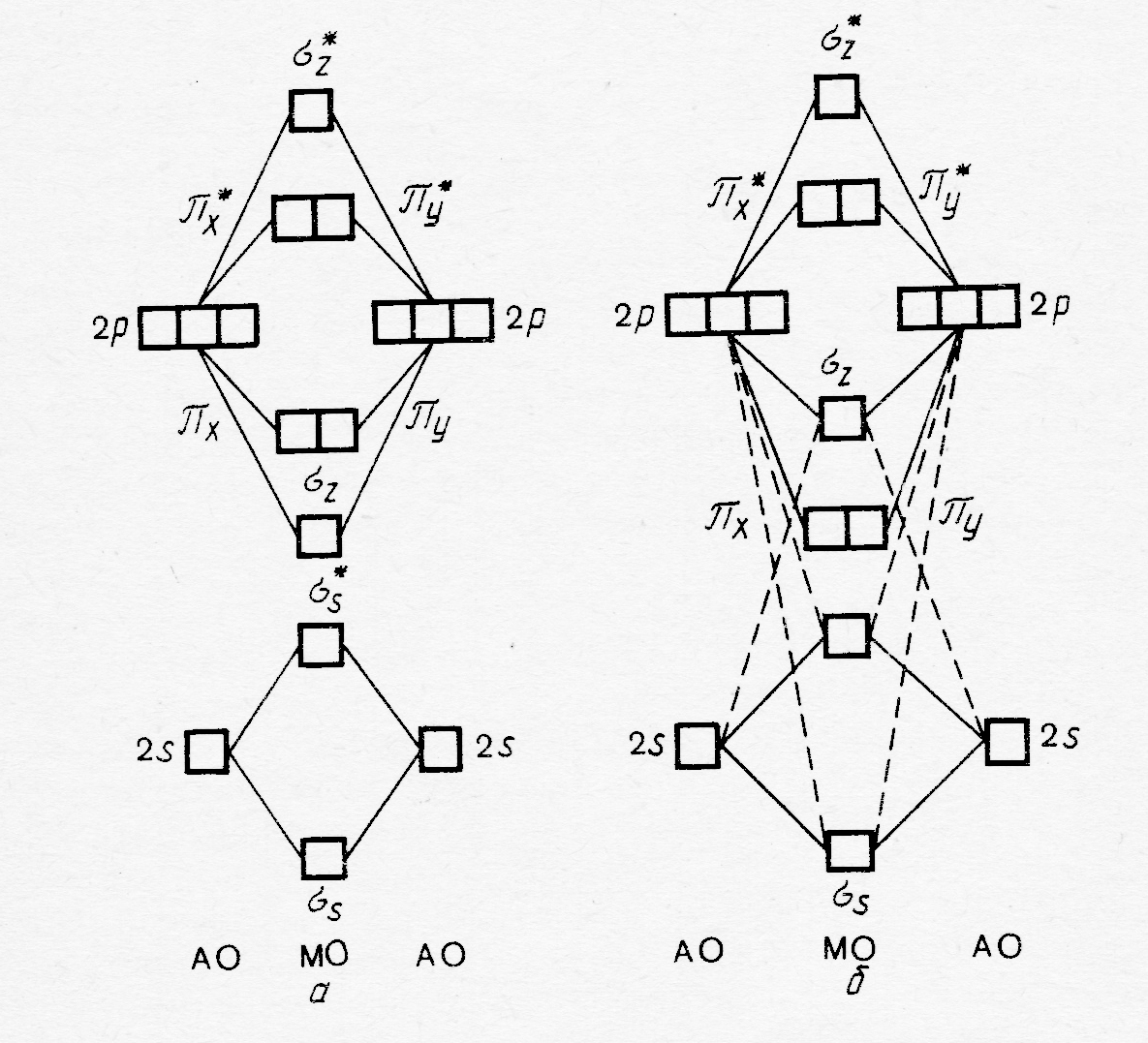
Рис.33.3 Распределение МО по энергии в молекулах (а) О2 и F2 и (б) Li2 – N2.

Рис.34.3 Энергетические диаграммы бинарных молекул элементов второго периода.
Отрыв электрона от молекулы Н2 снижает энергию связи в системе до 256 кДж/моль, что вызвано уменьшением числа электронов на связывающей орбитали и снижением ПС с 1 до 0,5. В случае же отрыва электрона от молекулы Li2 энергия связи возрастает со 100 до 135,1 кДж/моль, хотя как видно из рисунка 6.9, электрон, также как в предыдущем случае удаляется со связывающей орбитали и ПС снижается до 0,5. Причина этого заключается в том, что при удалении электрона из молекулы Li2 снижается отталкивание между электронами, находящимися на связывающей МО и электронами занимающими внутреннюю 1s орбиталь. Эта закономерность наблюдается для молекул всех элементов главной подгруппы первой группы Периодической системы.
По мере увеличения заряда ядра влияние электронов 1s орбиталь на энергию МО снижается, потому в молекулах В2, С2 и N2 отрыв электрона будет повышать энергию системы (снижение значения ПС, уменьшение суммарной энергии связей) из за того, что электрон удаляется со связывающей орбитали. В случае же молекул O2, F2 и Ne2 удаление электрона происходит с разрыхляющей орбитали, что ведёт к росту ПС и суммарной энергии связи в системе, например, энергия связи в молекуле F2 равна 154,8 кДж/моль, а в ионе F2+ практически в два раза выше (322,1 кДж/моль). Приведённые рассуждения справедливы для любых молекул, независимо от их качественного и количественного состава. Рекомендуем читателю провести сравнительный анализ стабильности бинарных молекул и их отрицательно заряженных молекулярных ионов, т.е. оценить изменение энергии системы в процессе А2 + ē = А2-.
Из рисунка 34.3 также следует, что только молекулы В2 и О2 , имеющие неспаренные электроны, парамагнитны, тогда как остальные бинарные молекулы элементов второго периода относятся к диомагнитным частицам.
Доказательством справедливости ММО, т.е. свидетельством реального существования уровней энергии в молекулах, служит различие в значениях потенциалов ионизации атомоа и образованных из них молекул (таблица 5.3).
Таблица 5.3.
Потенциалы ионизации атомов и молекул
|
атом |
первый потенциал ионизации кДж/моль |
молекула |
первый потенциал ионизации кДж/моль |
|
H |
1312 |
H2 |
1488 |
|
N |
1402 |
N2 |
1503 |
|
O |
1314 |
O2 |
1165 |
|
C |
1086 |
C2 |
1148 |
|
F |
1581 |
F2 |
1513 |
Представленные в таблице данные свидетельствуют о том, что у одних молекул потенциалы ионизации больше, чем у атомов из которых они образованы, у других – меньше. Данный факт необъясним с точки зрения МВС. Анализ данных рисунка 34.3 приводит к выводу, что потенциал молекулы больше чем у атома в том случае, когда электрон удаляется со связывающей орбитали (молекулы Н2, N2, С2). Если же электрон удаляется с разрыхляющей МО (молекулы О2 и F2), то этот потенциал будет меньше, по сравнению с атомным.
Переходя к рассмотрению гетероатомных бинарных молекул в рамках ММО ЛКАО, необходимо напомнить, что орбитали атомов различных элементов, имеющие одинаковые значения главного и побочного квантовых чисел отличаются по своей энергии. Чем выше эффективный заряд ядра атома по отношению к рассматриваемым орбиталям, тем ниже их энергия. На рисунке 35.3 приведена энергетическая диаграмма МО гетероатомных молекул типа АВ, в которой атом В более электроотрицателен. Орбитали этого атома по энергии ниже аналогичных орбиталей атома А. В связи с этим вклад орбиталей атома В в связывающие МО будет больше, чем в разрыхляющие. Наоборот, основной вклад в разрыхляющие МО будут вносить АО атома А. Энергия внутренних орбиталей обоих атомов при образовании молекулы практически не изменяется, например, в молекуле фтороводорода орбитали 1s и 2s атома фтора сосредоточены вблизи его ядра, что, в частности, обуславливает полярность данной молекулы (µ = 5,8 ∙ 10-30). Рассмотрим с использованием рисунка 34 описание молекулы NO. Энергия АО кислорода ниже АО азота, вклад первых выше в связывающие орбитали, вторых – в разрыхляющие. Орбитали 1s и 2s обоих атомов не изменяют свою энергию (σ2s и σ٭2s заняты электронными парами, σ1s и σ٭1s на рисунке не показаны). На 2р орбиталях атомов, соответственно, кислорода и азота находятся четыре и три электрона. Общее число этих электронов 7, а связующих орбиталей образованных за счёт 2р орбиталей три. После их заполнения шестью электронами становится очевидным, что седьмой электрон в молекуле расположен на одной из разрыхляющих π-орбиталей и, следовательно локализован вблизи атома азота. ПС в молекуле: (8 – 3)/2 = 2,5 т.е. суммарная энергия связи в молекуле высокая. Однако электрон расположенный на разрыхляющей орбитали имеет большую энергию и его удаление из системы приведёт к её стабилизации. Указанный вывод позволяет прогнозировать, что энергия активации процессов окисления NO будет низкой, т.е. эти процессы могут протекать даже при с.у..
В то же время, термическая стабильность этих молекул будет высокой, ион NO+ по суммарной энергии связи будет близок к молекулам азота и СО, при низких температурах NO будет димеризоваться.
Анализ молекулы NO в рамках данного метода приводит к ещё одному важному выводу – наиболее стабильными будут бинарные гетероатомные молекулы, в состав которых входят атомы с суммарным числом электронов на валентных s и р-орбиталях, равных 10. В этом случае ПС = 3. Увеличение или уменьшение этого числа приведёт к уменьшению значения ПС, т.е. к дестабилизации частицы.
Многоатомные молекулы в ММО ЛКАО рассматриваются исходя из тех же принципов, которые описаны выше для духатомных частиц. Молекулярные орбитали в данном случае формируют путём линейной комбинации АО всех атомов, входящих в состав молекулы. Следовательно, МО в таких частицах многоцентровые, делокализованные и описывают химическую связь в системе как единое целое. Равновесные расстояния между центрами атомов в молекуле, отвечают минимуму потенциальной энергии системы.
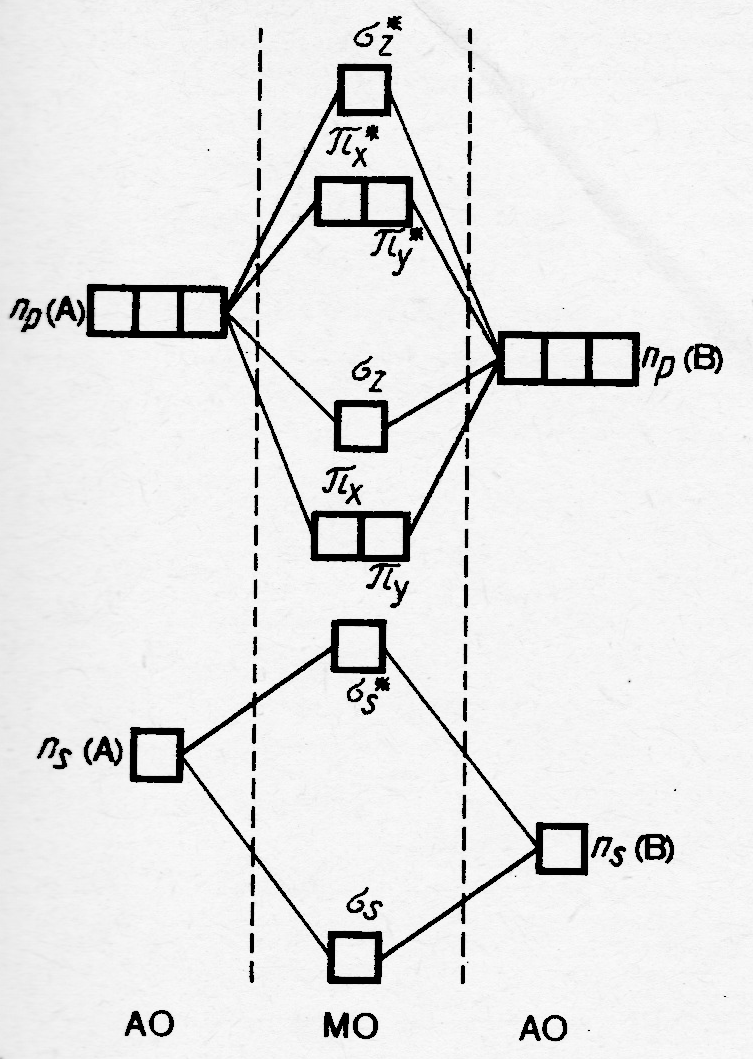
Рис.35.3. Энергетическая диаграмма МО бинарных гетероатомных молекул
(атом В имеет большую электроотрицательность).
Рис.36.3.Энергетические диаграммы молекул различных типов в
рамках ММО. (ось рх орбитали совпадает с осью связей)
На рисунке 36.3 представлены МО молекул различных типов. Принцип их построения рассмотрим на примере молекулы ВеН2 (рис.37.3). В образовании трёхцентровых МО в данной частице принимают участие 1s орбитали двух атомов водорода, а также 2s и 2р орбитали атома Ве (1s орбиталь этого атома в образовании МО участия не принимает и локализована вблизи его ядра). Примем, что ось рz-орбитали Ве совпадает с линией связи в рассматриваемой частице. Линейная комбинация s орбиталей атомов водорода и бериллия приводит к образованию σs и σs٭ , а такая же операция с участием s орбиталей атомов водорода и рz-орбитали Ве к образованию связывающей и разрыхляющей МО σz и σz٭, соответсвенно.
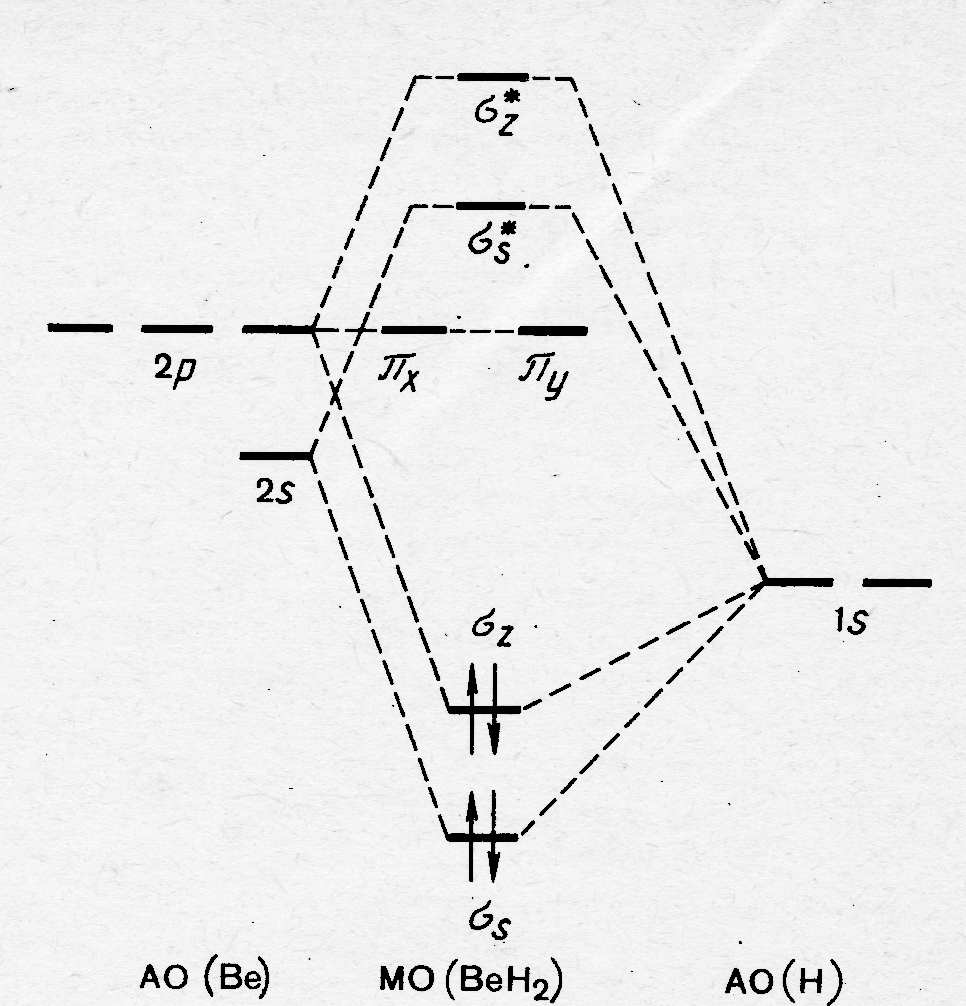
Рис.37.3. МО в молекуле ВеН2
Валентные электроны располагаются в молекуле на связывающих орбиталях, т.е. её электронная формула может быть представлена в виде (σs) 2 (σz) 2. Энергия этих связывающих орбиталей ниже энергии орбиталей атома Н, что обеспечивает относительную стабильность рассматриваемой молекулы.
В том случае, когда все системы атомы имеют подходящие для линейной комбинации р-орбитали, наряду с σ-МО, образуются многоцентровые связывающие, несвязывающие и разрыхляющие π-МО. Рассмотрим такие частицы на примере молекулы СО2 (рис.38.3 и 39.3).
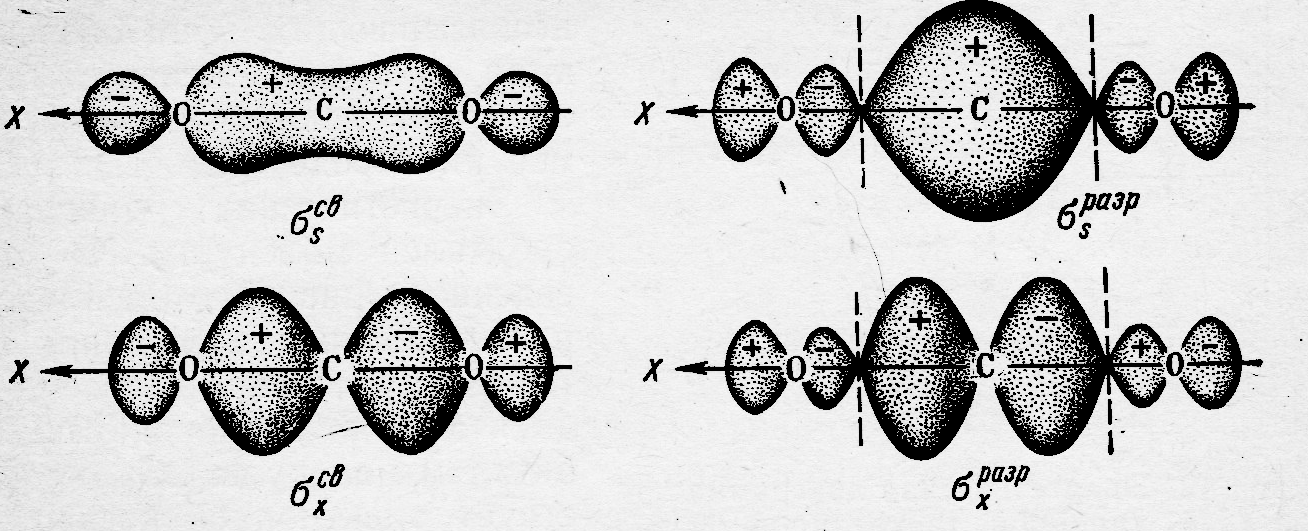
Рис.38.3 Связывающие и разрыхляющие σ-МО молекулы СО2
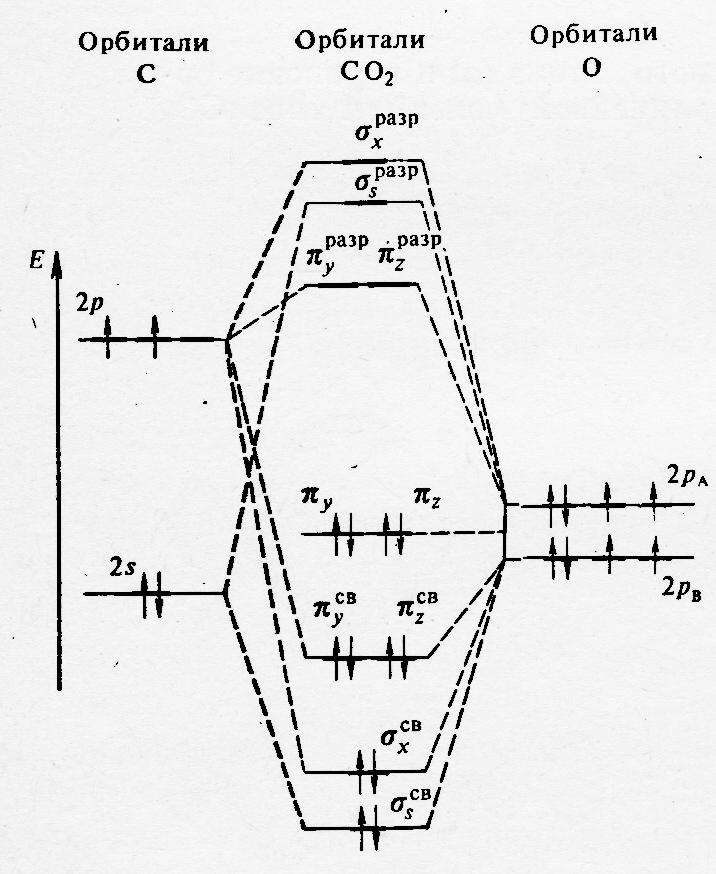
Рис.39.3. Энергетическая диаграмма МО в молекуле СО2.
В этой молекуле σ-МО образуются при комбинации 2s и 2рх орбиталей атома углерода с 2рх орбиталями атомов кислорода. Делокализованные π-МО формируются за счёт линейной комбинации py и pz орбиталей всех атомов,
входящих в состав молекулы. В результате этого образуется три пары π-МО с различной энергией: связывающие - πycвπzсв, несвязывающие - πyπz (по энергии соответствующие р-орбиталям атомов кислорода), и разрыхляющие - πyразрπzразр.
При рассмотрении молекул в рамках ММО ЛКАО часто используют сокращённые схемы описания частиц (рис.40.3). При формировании МО, например, в молекуле BCI3 достаточно указать только те АО, которые принимают реальное участие в линейной комбинации ( на рисунке не указаны одна из АО р-орбиталей бора и 6 из 9 р-орбиталей атомов хлора, линейная комбинация которых даёт несвязывающие МО)
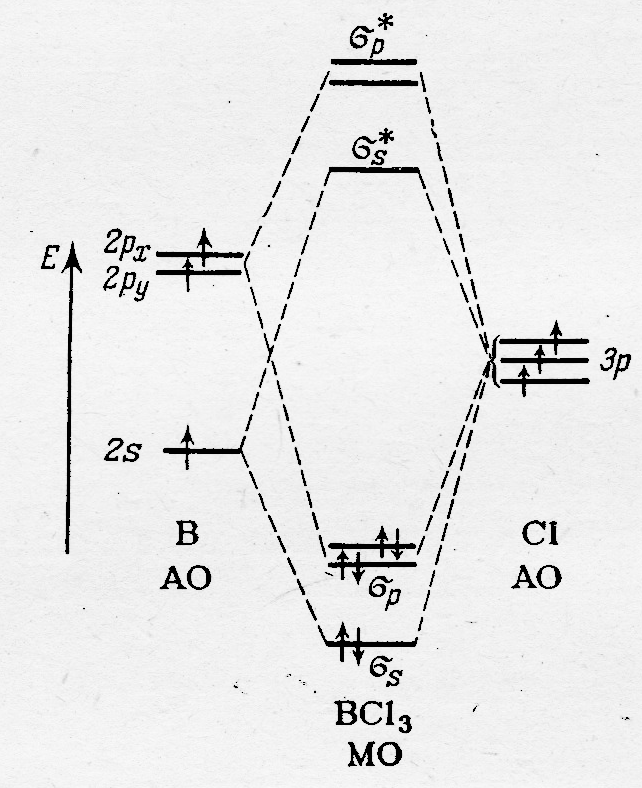
Рис.40.3. МО в молекуле BCI3
Энергетическая диаграмма МО в молекуле СН4 представлена на рис.41.3.. Анализ электронного строения атома углерода показывает, что в связи с разнонаправленностью его 2р орбиталей образование в молекуле СН4 пятицентровых МО с участием этих АО невозможно по геометрически соображениям. В то же время, 2s орбиталь углерода в равной степени способна перекрываться с 1s орбиталями атомов водорода, в результате чего образуется пятицентровые σs и σs٭ МО. В случае комбинаций 2р и 1s орбиталей, число атомных функций в линейной комбинации равно только трём, т.е. энергия σ-МО в данном случае будет выше, чем у соответствующих σs и σs٭.
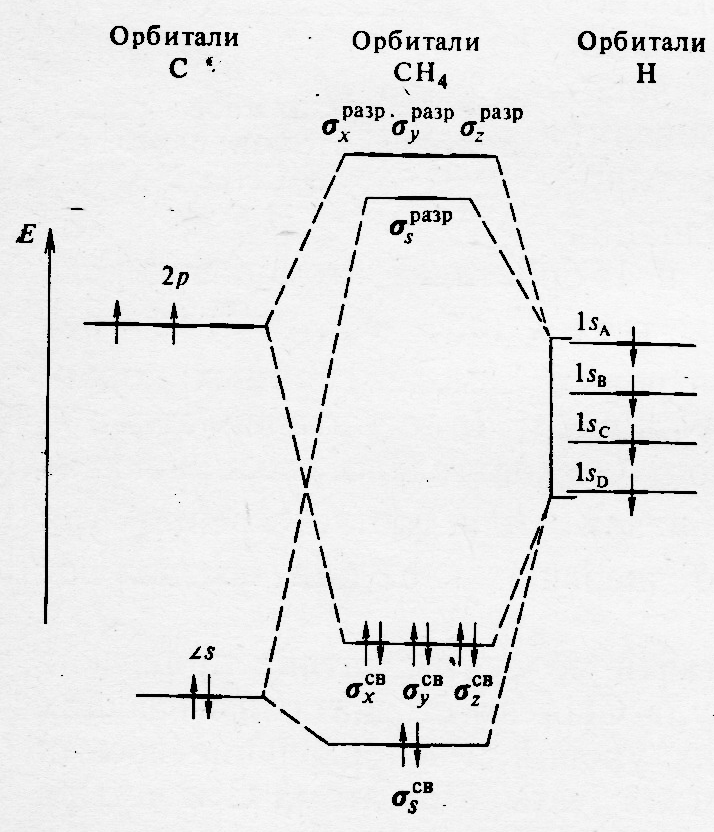
Рис.41.3.. Энергетическая диаграмма МО молекулы СН4.
Различную энергию пятицентровой и трёхцентровых связывающих орбиталей подтверждают экспериментальные данные по потенциалам ионизации, которые различны для электронов удаляющихся с σs и с σx(σy. σz).
