
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
3.2.5. Дипольный момент и полярность связей
При образовании химической связи между атомами различных элементов электронная плотность химической связи смещается в сторону более электроотрицательного атома, например, в молекуле HCI в сторону атома хлора. В этом случае электрические центры положительного и отрицательного зарядов в системе не совпадают, т.е. она может быть представлена в виде фигуры произвольной формы, на которой показаны центры этих зарядов ( + - ) – такие частицы называются диполями. Расстояние между этими центрами называется длиной диполя (L), а абсолютную величину зарядов этих центров приято обозначать символом q. Произведение L ∙ q = µ называется дипольным моментом и измеряется в Кл∙м. Химическая связь, обладающая дипольным моментом, называется полярной. Чем больше значение µ, тем выше полярность рассматриваемой связи ( интервал значений µ для различных связей лежит в пределах от 0,3 ∙ 10-30 до 30 ∙ 10-30 Кл∙м).
Дипольный момент связи – величина векторная. Направление вектора условно принято изображать стрелкой от (+) к (-). Дипольный момент многоатомной частицы равен векторной сумме всех дипольных моментов химических связей. В соответствии с правилами сложения векторов дипольный момент молекулы будет зависеть от направления осей симметрии связей в пространстве, т.е. геометрией многоатомной частицы (рис.19.8).
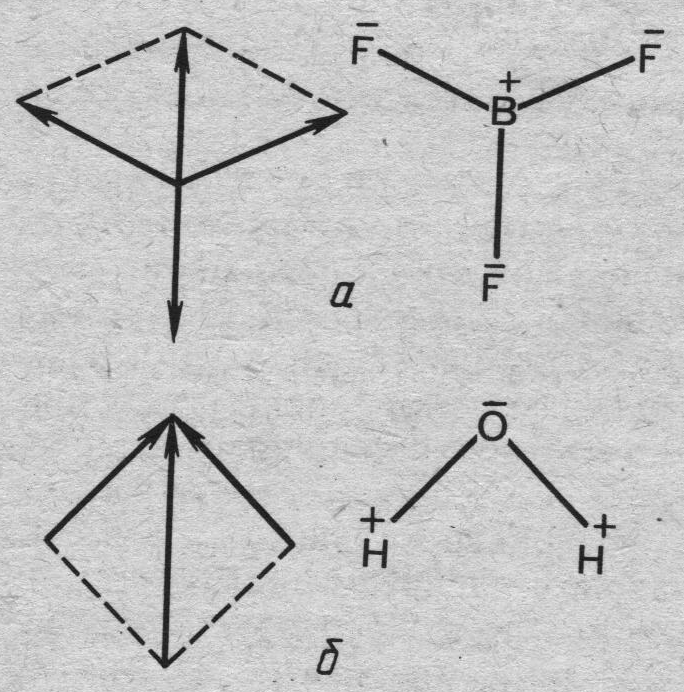
Рис. 25.3 Зависимость дипольных моментов молекул BF3 (а) и Н2О (б) от их симметрии.
Как видно из рисунка 25.3, моменты связей направлены от атома бора к атомам фтора, которые располагаются в вершинах равностороннего треугольника. Сумма моментов связей в данном случае равно нулю и, следовательно, данная молекула неполярна. В молекуле воды дипольные моменты связей направлены от атомов водорода к атому кислорода под углом 104,5о, из векторная сумма равна 6,15 ∙ 10-30 Кл∙м, т.е. данная молекула высокополярна. Как отмечалось в разделе «межмолекулярное взаимодействие» значение дипольного момента молекул предопределяет величину энергии ориентационного и индукционного взаимодействия между ними и оказывает влияние на значение температур плавления и кипения молекулярных веществ. Помимо этого указанная характеристика молекул предопределяет и другие химические и физические свойства указанных веществ: растворимость и способность растворять другие вещества, способность к сорбции, спектральные характеристики и т.д..
Для описания молекул известного состава в рамках МВС необходимо:
1.Познакомиться с электронным строением центрального и периферийных атомов.
2.Определить число σ-связей центрального атома, учитывая, что оно равно его координационному числу.
3. По электронной формуле определить число неподелённых пар центрального атома.
4. Найти число гибридных орбиталей, как сумму числа σ-связей и неподелённых электронных пар.
5.С учётом строения центрального атома и числа необходимых гибридных орбиталей найти тип гибридизации и по нему расположение гибридных орбиталей в пространстве.
6. Определить возможность образования между атомами π-связей, за счёт орбиталей не принимавших участия в гибридизации.
7.Оценить эффективность гибридизации, учитывая значения главных квантовых чисел атомных орбиталей, принимающих участие в образовании гибридных орбиталей.
Используя предложенную схему, рассмотрим строение некоторых молекул.
а) молекула С2Н2
Атом водорода, согласно МВС может образовать только одну σ-связь, так как имеет только одну валентную орбиталь. По указанной причине этот атом не может быть центральным. Тогда атом углерода в рассматриваемой молекуле имеет к.ч. = 2. С учётом строения валентного уровня углерода в возбуждённом состоянии (1s22s12p3) и низкого значения главного квантового числа валентных орбиталей можно сделать вывод, что σ-связи в молекуле С2Н2 образованы а)за счёт перекрывания sp- гибридных орбиталей атома углерода с 1s орбиталями атомов водорода и б) sp- гибридных орбиталей атома углерода между собой. При этом угол между связями составляет 180о, т.е. молекула линейна (рис.26.3 а). В гибридизации не принимают участия по две р-орбитали атома углерода, на каждой из которых находится по одному электрону. Эти орбитали будут перекрываться в двух взаимно перпендикулярных плоскостях, образуя две π-связи (рис.26.3 а).
б) молекула СО2.
Центральный атом углерода в этой молекуле имеет по кислороду к.ч.=2. С учётом рассуждений представленных в первом примере, можно предположить, что тип гибридизации орбиталей углерода в этой молекуле, так же как в молекуле С2Н2, sp. Т.е молекула имеет линейное строение. У атома углерода не принимали участия в гибридизации две одноэлектронные р-орбитали, направленные в пространстве перпендикулярно друг другу. У атомов кислорода после образования σ-связей осталось по одной одноэлектронной р-орбитали. При перекрывании р-орбиталей углерода с р-орбиталями кислорода (орбитали имеют одинаковые значения магнитных квантовых чисел) образуются две связи типа π, располагающиеся в двух взаимно перпендикулярных плоскостях справа и слева от атома углерода (рис. 26.3б).
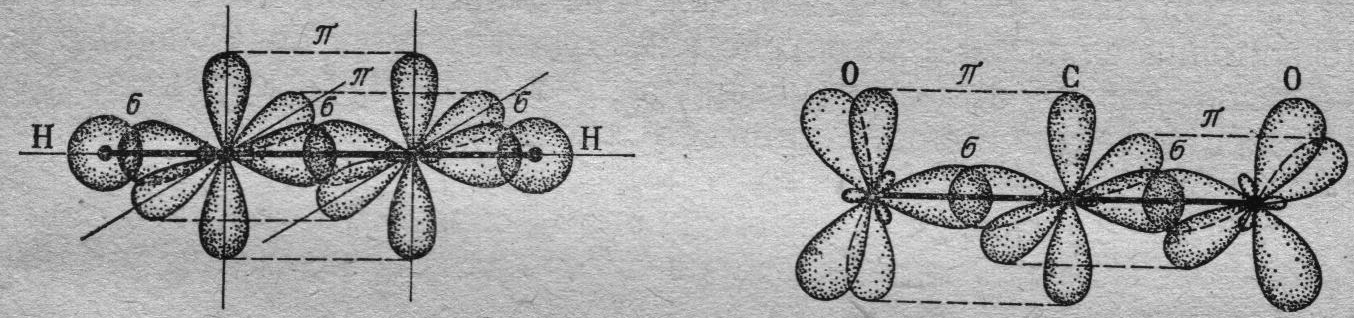
(а) (б)
Рис.26.3. Строение молекул (а) С2Н2 и (б) СО2.
в) молекула С6Н6
По соотношению атомов, входящих в состав молекулы, С6Н6 аналогична С2Н2. Существует несколько возможных вариантов соединения атомов в данной молекуле (например, чередование одинарных и двойных связей между атомами углерода, образующих шестичленный цикл). Однако квантовомеханические расчёты показывают, что минимальную энергию система достигает в случае, когда все атомы углерода в молекулы равноценны как с точки зрения энергии, так и с точки зрения пространственного расположения.
При любом подходе к рассмотрению данной молекулы единственно возможный вариант существования системы, обеспечивающий участие всех валентных орбиталей углерода в образовании связи, а, следовательно, минимум энергии молекулы – образование замкнутого цикла из атомов углерода, т.е. к.ч.этих атомов в молекуле равно трём.
С учётом электронного строения атома углерода находим, что его орбитали находятся в состоянии sp2 гибридизации – молекула представляет собой правильный шестиугольник (угол между связями 120о). Каждый атом углерода после формирования системы σ-связей имеет по одной одноэлектронной орбитали типа р, ось которой располагается перпендикулярно плоскости молекулы. Выполнение условия равноценности всех химических связей в рассматриваемой молекуле может бать реализовано только в результате одновременного перекрывания всех указанных р орбиталей в двух областях молекулы: над и под плоскостью кольца (рис.27.3.). В результате указанного перекрывания образуется шестицентровая шестиэлектронная делокализованная химическая связь, одновременно принадлежащая всем атомам углерода данной молекулы.
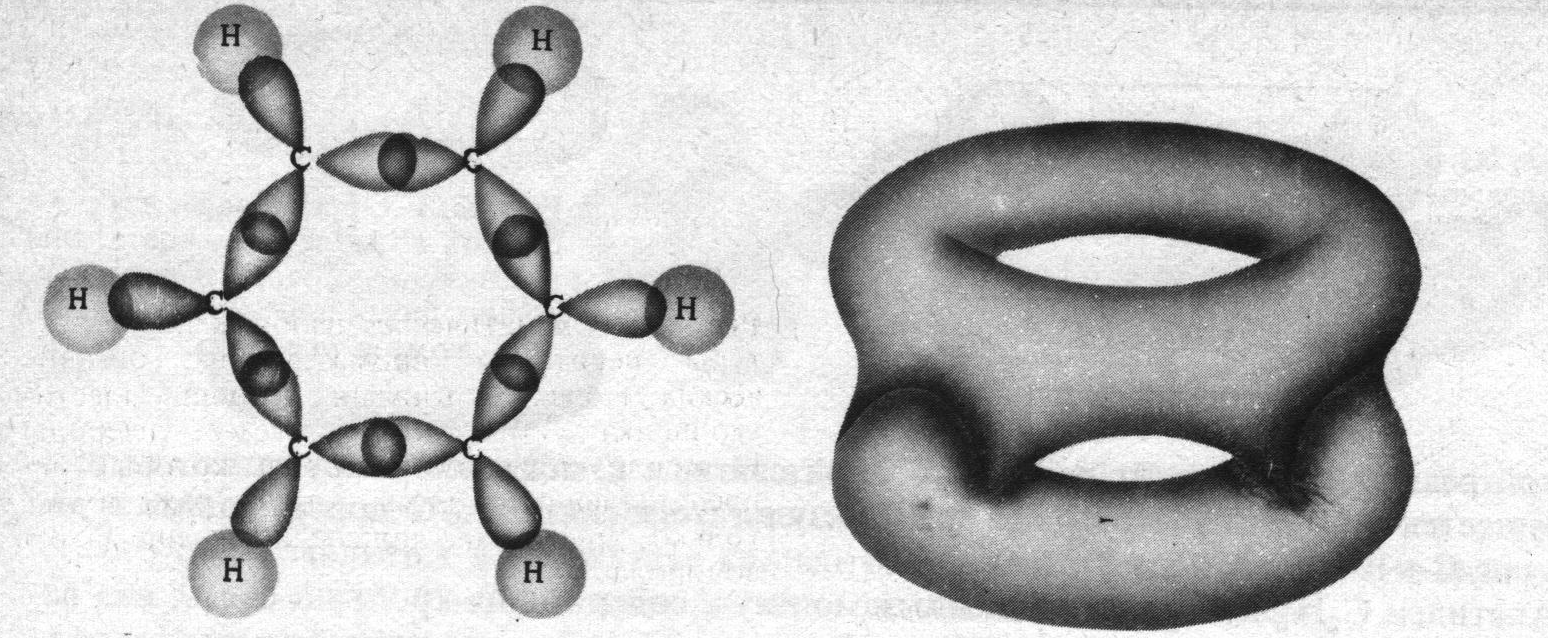
а) б)
Рис.27.3. Система σ (а) и (б)π-связей в молекуле бензола.
г) Молекулы O3 и SO2
В данных молекулах центральные атомы имеют к.ч.= 2 и по две неподелённые электронные пары. С учётом строения атома в этом случае можно предположить, что тип гибридизации электронных орбиталей этих атомов sp3, однако данный вариант не оптимален с энергетической точки зрения в связи со значительной энергией отталкивания большого числа неподелённых пар валентного уровня. В то же время при sp2 гибридизации угол между связями может быть значительно увеличен, а одна из двухэлектронных р-орбиталей центрального атома получает возможность принять участие в образовании трёхцентровой четырёхэлектронной химической связи (рис.24.3 и 28.3). На первый взгляд может показаться, что имеющая меньшую длину связи молекула O3 термодинамически более стабильная система по сравнению с SO2, однако экспериментальные данные говорят об обратном: ∆G образования O3 при любых параметрах системы положительно, тогда как эта величина для SO2 в широком интервале параметров состояния системы отрицательна и велика по абсолютному значению.
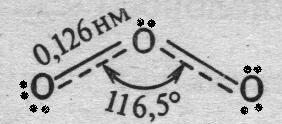
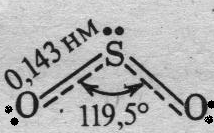
а) б)
Рис.28.3. Строение молекул а) O3 и б) SO2
Данное противоречие легко разрешимо, если учесть, что атом кислорода не имеет свободных орбиталей валентного уровня и отталкивание неподелённых электронных пар в системе приводит к росту её внутренней энергии. У атома же серы имеются свободные d-орбитали валентного уровня, в связи с чем как минимум одна двухэлектронная орбиталь у каждого атома кислорода способна принимать участие в образовании связей по донорно-акцепторному механизму, что не только уменьшает энергию отталкивания в системе, но и снижает её суммарную энергию за счёт образования самих связей. Эксперимент и расчеты показывают, что связи в молекуле SO2 близки к тройным.
