
- •1.1 Особенности ферментативного катализа. Регуляция активности ферментов. Применение ферментов и их модуляторов в медицине
- •Ферменты. Номенклатура. Классификация ферментов.
- •Уровни организации ферментов.
- •Механизм действия ферментов. Понятие об активном центре фермента, этапы ферментативного катализа.
- •Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике ферментов.
- •Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
- •Энзимодиагностика. Энзимотерапия. Примеры.
- •1.2. Введение в обмен веществ. Биологическое окисление
- •Важнейшие признаки живой материи. Особенности живых организмов, как открытых термодинамических систем.
- •Представление о биологическом окислении. Сопряжение экзергонических и эндергонических процессов в организме (на примере фосфорилирования глюкозы).
- •Пути утилизации кислорода. Характеристика высокоэнергетических субстратов, цикл атф-адф, использование атф, как универсального источника энергии.
- •Субстратное фосфорилирование: сущность, биологическое значение процесса, примеры.
- •Окислительное фосфорилирование: сущность, биологическое значение процесса.
- •Цепь переноса электронов (цпэ), сопряжение дыхания и синтеза атф в митохондриях, коэффициент окислительного фосфорилирования. Ингибиторы и разобщители цпэ.
- •Окислительное декарбоксилирование пировиноградной кислоты: схема процесса, связь с синтезом атф. Строение пируватдегидрогеназного комплекса: ферменты, коферменты, регуляция процесса.
- •Цикл трикарбоновых кислот (цтк). Биологическая роль.
- •Регуляция и анаболическая функция цтк.
- •1.3. Обмен углеводов
- •Пищевые углеводы. Схема переваривания углеводов в жкт. Причины непереносимости молока.
- •Синтез гликогена в печени и скелетных мышцах. Регуляция этих процесса.
- •Распад гликогена в печени и скелетных мышцах. Регуляция этих процессов.
- •Анаэробный распад глюкозы (анаэробный гликолиз). Судьба продуктов гликолиза в анаэробных условиях. Биологическое значение анаэробного распада глюкозы.
- •Биосинтез глюкозы (глюконеогенез). Субстраты, энергетические затраты, регулируемые ферменты. Цикл Кори.
- •Пентозо-фосфатный путь (пфп) окисления глюкозы. Биологическое значение.
- •1.4. Обмен аминокислот, белков и нуклеотидов
- •Питательная ценность различных белков. Азотистый баланс. Клинические проявления недостатка белков в пище.
- •Переваривание белков в желудочно-кишечном тракте. Биологическое значение переваривания. Схема процесса. Характеристика пищеварительных ферментов.
- •Окислительное дезаминирование (прямое, непрямое) аминокислот. Схема процесса, стадии, ферменты, биологическое значение процесса.
- •Декарбоксилирование аминокислот. Биологическое значение. Продукты и их судьба.
- •Механизмы токсичности аммиака, симптомы аммиачного отравления. Пути образования аммиака в организме.
- •Пути обезвреживания аммиака. Механизмы транспорта аммиака в организме: глутаминовый и глюкозо-аланиновый циклы.
- •Синтез мочевины: схема реакций, суммарное уравнение. Взаимосвязь с цтк. Клиническое значение определения концентрации мочевины в крови и моче, причины повышения и понижения концентрации мочевины.
- •Синтез креатина, креатинфосфата, креатинина. Функции этих соединений в организме.
- •Катаболизм пуриновых нуклеотидов. Содержание мочевой кислоты в сыворотке крови в норме и причины его повышения. Подагра.
- •Обмен метионина и его роль в обмене веществ.
- •1.5. Обмен липидов и липопротеидов
- •Этапы катаболизма жирных кислот: реакции, ферменты. Энергетический эффект полного окисления с16:0. Регуляция процесса β-окисления вжк.
- •Этапы биосинтеза жирных кислот: реакции, ферменты. Регуляция процесса биосинтеза вжк.
- •Мобилизация таг в жировой ткани. Регуляция процесса и судьба продуктов липолиза.
- •7. Структура и функции холестерина в организме человека. Фонд, пути использования в организме и выведения холестерина. Метаболическая и гормональная регуляция биосинтеза.
- •8. Функции жёлчных кислот и его регуляция. Энтерогепатическая циркуляция жёлчных кислот, биологическое значение.
- •9. Биологическое значение и структуры кетоновых тел. Синтез кетоновых тел в печени; регуляция синтеза. Представление о кетонемии, кетонурии и кетоацидозе.
- •10. Классификация лп. Структура и состав плазменных липопротеидных частиц. Апобелки и их функции. Ферменты, участвующие в метаболизме лп. Катализируемые реакции, их роль в метаболизме лп.
- •11. Хиломикроны (хм): функции, формирование и метаболизм хм.
- •12.Липопротеины очень низкой и низкой плотности: формирование, функции и метаболизм.
- •13.Липопротеины высокой плотности: формирование, функции и метаболизм.
- •14.Химическая модификация липидов и белков лпнп и рецепторов лпнп. Молекулярные механизмы развития атеросклероза. Коэффициент атерогенности.
- •1.6. Биологические мембраны. Перекисное окисление липидов
- •Основные мембраны клетки и их функции.
- •Строение и состав мембран: структура и свойства липидов, белков, углеводов мембран. Общие свойства мембран и их функции.
- •Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц.
- •Механизмы трансмембранной передачи гормонального сигнала в клетку.
- •Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •Роль пероксидного окисления при гипоксии (ишемии). Факторы гипоксии, инициирующие пол. Понятие о «кислородном» и «кальциевом» парадоксах.
- •Простагландины и лейкотриены: схема синтеза и их биологические функции.
- •1.7. Гормоны. Гормональная регуляция метаболических процессов. Биохимия выделительной системы. Минеральный обмен
- •1. Гормоны. Классификации гормонов. Иерархический принцип управления в эндокринной системе.
- •3. Глюкагон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •5. Кортизол: химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •6. Представление о гормональных механизмах реализации стресса.
- •7. Биохимические причины возникновения сахарного диабета I типа (изсд) и II типа (инсд), биохимические механизмы их возникновения. Лабораторная диагностика сахарного диабета и осложнений.
- •8. Биохимические механизмы адаптации к голоданию, типы голодания. Фазы полного голодания. Изменение гормонального статуса и метаболизма при голодании.
- •9. Гормоны щитовидной железы: химическая природа и структура, этапы биосинтеза.
- •10. Гормоны щитовидной железы: механизм действия, органы-мишени, биологические эффекты: влияние на обмен веществ. Понятие о гипер- и гипотиреозе.
- •11. Функции почек в организме человека. Процесс образования мочи: клубочковая фильтрация, канальцевые реабсорбция и секреция. Особенности процессов метаболизма в почечной ткани.
- •12. Почечные механизмы поддержания кислотно-основного состояния плазмы крови.
- •14. Антидиуретический гормон (вазопрессин): химическая природа, механизм действия, органы-мишени, биологические эффекты. Несахарный диабет.
- •15. Альдостерон: химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •16. Влияние на солевой обмен гипо- и гиперпродукции альдостерона. Система ренин-ангиотензин-альдостерон. Биологические эффекты ангиотензина II.
- •17. Предсердный натрийуретический фактор (пнф): химическая природа, механизм действия, органы-мишени, биологические эффекты.
- •18. Паратиреоидный гормон: химическая природа, органы-мишени, биологические эффекты. Влияние на обмен кальция и фосфора гипо- и гиперпродукции птг.
- •19. Кальцитриол: химическая природа, этапы синтеза, механизм действия, органы-мишени, биологические эффекты. Представление о заболевании «рахит».
- •20. Кальцитонин: химическая природа, механизм действия и биологические эффекты
- •1.8. Биохимия питания и печени. Нервная, мышечная и соединительная ткани. Биохимия крови
- •1. Коллаген: этапы синтеза и созревания. Регуляция синтеза. Роль ферментов в катаболизме коллагена.
- •2. Эластин: особенности состава, строения и свойств. Катаболизм эластина.
- •3. Гликозаминогликаны и протеогликаны: особенности структуры и функции в организме. Фибронектин: особенности строения и функции.
- •4. Особенности метаболизма углеводов и энергетического обмена в нервной ткани.
- •5. Классификация витаминов и их биологическая роль. Примеры.
- •6. Типы переваривания: полостное, пристеночное, внутриклеточное (субстраты, ферменты, продукты). Функции жкт как пищеварительно-транспортного конвейера. Функции слюны.
- •7. Нарушение процессов переваривания и всасывания. Понятие о мальабсорбции. Стеаторея.
- •8. Ожирение. Причины первичного алиментарного ожирения. Функции лептина и его роль в регуляции массы жировой ткани. Типы ожирения.
- •9. Белоксинтезирующая функция печени. Источники и пути использования аминокислот в печени. Роль печени в поддержании азотистого баланса.
- •10. Биологическая роль печени в регуляции углеводного обмена.
- •11. Роль печени в метаболизме липидов и кетоновых тел. Жировая дегенерация печени.
- •12. Роль печени в гомеостазе холестерина. Внешнесекреторная функция печени: состав желчи, основные органические компоненты желчи и их происхождение, аномальная желчь.
- •13. Виды желтух и причины их возникновения. Физиологическая желтуха новорожденных.
- •14. Клинико-лабораторные синдромы при заболеваниях печени (синдром цитолиза, холестаза, печеночно-клеточной недостаточности, воспалительный), биохимические показатели.
- •15. Особенности метаболизма и энергетического обмена в клетках поперечно-полосатой мускулатуры и миокарда.
- •17. Представления о метаболических нарушениях при инфаркте миокарда. Лабораторная диагностика инфаркта миокарда.
- •19. Форменные элементы крови. Особенности метаболизма в эритроцитах и лейкоцитах.
- •20. Дыхательная функция крови. Молекулярные механизмы газообмена в лёгких и тканях (эффект Бора).
- •23. Гемоглобин, структура и функции. Типы гемоглобина человека, смена типов в онтогенезе. Кооперативные свойства гемоглобина. Гемоглобинопатии. Железодефицитные анемии.
- •24. Гемостаз, определение, компоненты, стадии.
- •25. Функции сосудистого эндотелия, субэндотелия и тромбоцитов. Сосудисто-тромбоцитарный гемостаз (первичный). Участие тромбоксана и простациклина в регуляции первичного гемостаза.
- •27. Противосвёртывающая и фибринолитическая системы.
- •Семестр 4
- •1. Биосинтез и распад коллагена. Схемы процессов.
- •2. Представление о протеогликанах.
- •3. Биосинтез эластина.
- •4. Синтез пуриновых нуклеотидов.
- •5. Катаболизм пуриновых нуклеотидов. Метаболические нарушения при подагре и синдроме Леша-Найхана.
- •6. Репликация: схема процесса, ферменты.
- •7. Транскрипция: схема процесса, ферменты. Процессинг.
- •8. Трансляция: схема процесса, регуляция.
- •9. Теломеры. Строение теломеразного комплекса.
- •10. Механизмы индукции и репрессии теломеразной активности.
- •11. Танкираза: роль в образовании активной теломеразы.
- •12. Понятие о рекомбинантных днк.
- •13. Использование рекомбинантных днк в медицине.
- •14. Моноклональные антитела, лекарственные средства на их основе для лечения опухолей.
- •15. Вектор иммуноконъюгата. Вещества, используемые в качестве векторов адресной доставки.
- •16. Состав и функции семейства клеточных рецепторов.
- •17. Эпидермальный фактор роста и α-фетопротеин: их использование в качестве векторов.
- •18. Функции лектиновых рецепторов и механизмы адгезии микроорганизмов.
- •19. Роль нейраминидазы и гемаглютининов в вирусной репликации.
- •20. Молекулярные механизмы малигнизации клеток.
- •21. Биохимические отличия злокачественных клеток от здоровых. Митогены.
- •22. Рецепторы эндотелиального фактора роста. Их характеристика
- •23. Пцр: биомедицинское значение.
- •24. Метаболизм этанола.
- •25. Механизмы действия наркотических веществ. Роль дофаминовой системы.
- •26. Метаболические механизмы алкоголизма.
- •27. Понятие о моногенных заболеваний. Примеры моногенных заболеваний.
- •28. Концепция «двууглеродного голода».
- •29. Сущность молекулярной адаптации к хроническому действию наркотических веществ.
- •30. Эндотелиальная дисфункция и развитие ибс. Роль no•.
- •31. Патобиохимия инфаркта миокарда.
- •32. Мутации митохондриальных генов. Примеры.
- •33. Полиморфизм гена апобелка е, клиническое значение.
- •34. Биохимические основы синдрома дыхательных расстройств. Строение сурфактанта.
- •35. Лабораторная диагностика панкреатитов.
- •36. Молекулярные механизмы патогенеза острого панкреатита.
- •37. Патогенетические особенности нейродегенеративных заболеваний нервной системы.
- •38. Маркеры заболеваний бронхолёгочной системы. Механизмы повреждающего действия полимеров α1-антитрипсина.
- •Задачи.
Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике ферментов.
Кинетика ферментативных реакций – наука о скоростях ферментативных реакций, их зависимости от различных факторов.
Зависимость скорости ферментативной реакции моет проявляться от таких факторов как:
Природа фермента
Чем выше активность фермента, тем выше скорость реакции. Активность фермента определяют по скорости реакции, катализируемой ферментом
Температура
Повышение температуры сверх оптимальной приводит к уменьшению, а затем прекращению действия фермента, что связанно с денатурацией.
При переходе от оптимальной к низким температурам скорость ферментативной реакции падает в 2-2,5 раза на каждые 10 ˚С, достигая минимальной величины при 0 °С и приостанавливается при отрицательных её значениях
рН
Отклонение в любую сторону от этого значения сопровождается снижением скорости ферментативной реакции.
Концентрация
При низких концентрациях субстрата скорость прямо пропорциональна его концентрации, далее с ростом концентрации скорость реакции увеличивается медленнее, а при очень высоких концентрациях субстрата скорость практически не зависит от его концентрации и достигает своего максимального значения
График зависимости активности фермента от концентрации субстрата описывается уравнением Михаэлиса – Ментен
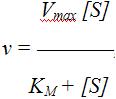
где v – скорость ферментативной реакции; [S] – концентрация субстрата; KM – константа Михаэлиса.
Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции.
Различают:
Необратимые ингибиторы
При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.
Обратимое ингибирование
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается.
Выделяют:
Конкурентное ингибирование
Соперничает с субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа.
Неконкурентное ингибирование
Связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Но при этом меняется структура активного центра и связь с субстратом становится невозможной
Бесконкурентное ингибирование
Связывается в активном центре с фермент-субстратным комплексом. Повышение концентрации субстрата, увеличивая количество фермент-субстратного комплекса, усиливает и связывание ингибитора с ним
Смешанное ингибирование
Способен присоединяться везде – не только в активном центре, но и в других частях молекулы. Но после этого фермент еще способен частично сохранять свою активность.
Механизмы регуляции активности ферментов. Примеры.
В клетке имеется несколько способов регуляции активности ферментов – одни способы подходят для любых ферментов, другие более специфичны.
Доступность субстрата или кофермента
Здесь работает закон действия масс: скорость, с которой вещества реагируют друг с другом, зависит от их концентрации
Пример: цикл трикарбоновых кислот
Комплементализация
Это сосредоточение ферментов и их субстратов в одной органелле
Пример: цикл трикарбоновых кислот
Генетическая регуляция
Может происходить в результате увеличения или снижения его синтеза.
Ограниченный (частичный) протеолиз проферментов
Подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов
Пример: активация протеолитических ферментов ЖКТ
Аллостерическая регуляция
Ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и активность каталитической субъединицы.
Белок-белковое взаимодействие
обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки
Ковалентная (химическая) модификация
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента.
Аллостерические ферменты. Регуляция их активности. Примеры.
Аллостерические ферменты — регуляторные ферменты, для которых характерно изменение каталитической активности в процессе нековалентного связывания метаболита в участке, не являющемся каталитическим центром
АФ регулируются молекулами, которые называют эффекторами. Они связываются с ферментом в аллостерическом центре и изменяют свойства ферментов: сродство к субстрату и максимальная скорость катализа.
Эффекторы могут быть положительными и отрицательными. Положительные эффекторы — активаторы — повышают активность ферментов. Отрицательные эффекторы — ингибиторы — снижают её. Кроме того, эффекторы классифицируют на:
Гомотропные эффекторы — это молекулы самого субстрата фермента. Чаще всего регуляция происходит по позитивному механизму
Гетеротропные эффекторы — это молекулы, отличные от субстрата — т.е. какие-либо другие соединения. Регуляция может быть как позитивной, так и негативной, но чаще всего она негативная
Пример: карбамоилфосфатсинтетаза II
