
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
Хімічні властивості піридину
1. Хлорування у присутності каталізатора з утворенням орто-похідної:
|
PdCl2 |
+ Cl2 |
+ HCl |
N |
N Cl |
2. Нітрування нітроген(V) оксидом у мета- положенні:
|
NO2 |
+ N2 O5 |
+ HNO3 |
N |
N |
Застосовують піридин і його похідні у синтезі барвників і лікарських речовин.
Для людини піридин токсичний, подразнює нервову систему та шкіру.
пірол
Пірол є п’ятичленною гетероциклічною сполукою, що містить у циклі один атом Нітрогену. Так само, як і піридин, виявляє ароматичні властивості, проте пірол менш стабільний, ніж піридин. Добувають пірол і його похідні під час сухої перегонки кам’яновугільної смоли.
Пірол у звичайних умовах — безбарвна рідина із запахом, що нагадує запах хлороформу.
амінОкислОти й Білки
номенклатура та ізомерія амінокислот
Амінокарбонові кислоти, або амінокислоти — це клас органічних сполук, які містять одночасно дві функціональні групи: аміногруппу NH2 − та карбоксильну групу −COOH.
O
|
|
|
C |
|
O |
||
H |
H2C |
OH |
|
||||
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
N |
N |
|
H3C |
C |
|||
|
|
|
OH |
||||
H |
H H |
H |
|
|
|||
амоніак |
амінооцтова кислота |
оцтова кислота |
|||||
Назви амінокислот походять від назв відповідних карбонових кислот із зазначенням положення аміногрупи. У сполуках, в яких присутні дві різні функціональні групи, їхнє взаємне розташування зазначають грецькими літерами. Так, залежно від того, до якого атома вуглецю
приєднана аміногрупа, амінокислоти поділяють на α , β , γ тощо.
ε δ γ β α
CH3 CH2 CH2 CH2 CH2 COOH
CH |
|
CH |
|
|
CH |
|
COOH |
CH |
|
|
|
CH |
|
CH2 |
COOH |
3 |
2 |
|
|
3 |
|
||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
NH2 |
|
|
|
|
NH2 |
|||||
|
|
|
|
|
|
|
|
||||||||
|
α амінобутано |
|
β амінобутанова |
||||||||||||
|
ва кислота |
|
|
|
|
кислота |
|||||||||
CH2 CH2 CH2 COOH
NH2
γ амінобутанова кислота
Фізичні властивості амінокислот
Амінокислоти являють собою тверді кристалічні речовини, добре розчинні у воді й мало розчинні в органічних розчинниках. Розчинність амінокислот може бути пояснена присутністю карбоксильної групи, що обумовлює розчинність карбонових кислот, і залишку молекули амоніаку (аміногрупи). Багато амінокислот солодкі на смак.
хімічні властивості амінокислот
Оскільки до складу амінокислот входять дві функціональні групи, то амінокислоти проявляють властивості двох класів сполук: карбонових кислот та органічних амінів.
1. Кислотноосновні взаємодії. У нейтраль-
них водних розчинах амінокислот карбоксильна група відщеплює йон Гідрогену, що може приєднатися до аміногрупи. При цьому утворюється так звана внутрішня сіль, яка існує у вигляді біполярних йонів (цвітеріонів). Вони поводяться як амфотерні сполуки, тобто проявляють властивості
і кислот, і основ: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
+H N |
|
|
CH |
|
|
COO– |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
нейтральне |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
середовище |
|||||||
|
|
|
|
|
H2N |
|
|
|
|
CH |
|
|
COOH |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
||
+H N |
|
CH |
|
COOH |
|
|
|
|
|
|
H N |
|
|
CH |
|
COO– |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
R |
|
|
|
|
|
|
|
|
|
R |
||||||||
|
кисле |
|
|
|
|
|
|
|
|
лужне |
||||||||||
середовище |
|
|
|
|
|
|
середовище |
|||||||||||||
204
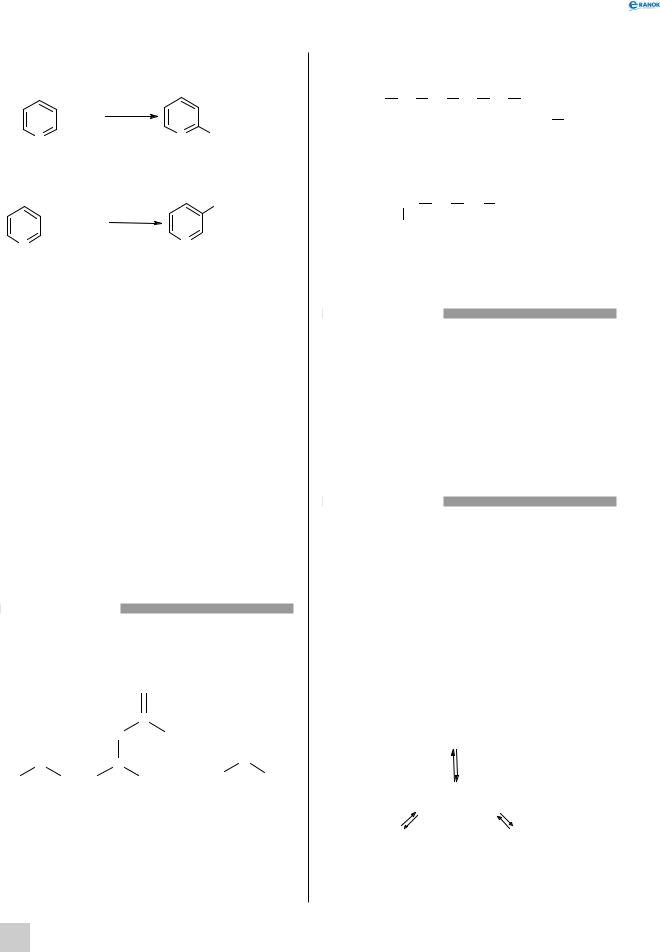
Кожна амінокислота характеризується певним значенням pН, при якому вона існує в нейтральній цвітеріонній формі у вигляді чітко вираженого диполя. Якщо при цьому значенні pН помістити амінокислоту в електричне поле, то вона не буде переміщатися ні до катода, ні до анода. Значення pН, що відповідає цьому електрично нейтральному стану, називається ізоелектричною точкою даної амінокислоти. Отже, для кожної амінокислоти характерна своя особлива ізоелектрична точка.
Амфотерна природа амінокислот важлива в біологічному сенсі, оскільки вона означає, що амінокислоти здатні утворювати буферні системи в розчинах — перешкоджати змінам pН. Це досягається завдяки тому, що при підвищенні pН вони виступають у ролі донорів H+-йонів, а при зниженні — у ролі акцепторів цих йонів. На схемі показано, що відбувається тоді, коли до амінокислоти при значенні pН, яке дорівнює її ізоелектричній точці, додають яку-небудь кислоту або яку-небудь основу:
|
|
|
|
|
+H N |
|
CH |
|
COO– |
||||||
|
|
|
|
|
|
|
|||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|||||
+ |
|
|
|
|
|
|
|
|
|
||||||
|
R |
+ |
|
|
|
|
|||||||||
|
|
|
|
+Н |
|
|
|
–Н |
|||||||
+H3N |
|
|
CH |
|
COOH |
|
|
|
H2N |
|
|
CH |
|
COO |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
R |
|
|
|
|
|
R |
|||||||
Водні розчини амінокислот мають нейтральне, лужне або кисле середовище залежно від кількості функціональних груп. Так, глутамінова кислота утворює кислий розчин (дві групи −COOH, одна NH2), лізин — лужний (одна група — COOH,
дві — NH2).
Амінокарбонові кислоти, як уже згадувалося раніше, мають амфотерні властивості через наявність основних аміногруп та кислотних карбоксильних груп, це позначається й на їхніх хімічних властивостях. При взаємодії з кислотами й лугами утворюють солі:
|
+ |
Cl |
− |
H2N −CH2 −COOH +HCl → H3N −CH2 |
−COOH |
|
|
H2N −CH2 −COOH +NaOH → |
|
|
|
→H2N −CH2 −COONa +H2O.
2.Утворення пептидного зв’язку. Карбок-
сильна група є донором протона й проявляє, відповідно, кислотні властивості. Властивості аміногрупи аналогічні до властивостей амоніаку, зокрема, вона є акцептором протонів і проявляє, відповідно, основні властивості. Отже, амінокислоти — це амфотерні сполуки, й їхня особливість полягає в тому, що кислотні й основні властивості проявляють різні групи атомів у молекулі, причому просторово розділені.
Саме цим обумовлена властивість молекул амінокислот реагувати одна з одною:
|
|
|
H |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
O |
|
|
||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH + H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
N |
|
|
|
CH2 |
C |
|
|
N |
|
CH2 |
C |
|
OH |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
H2O |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
O |
H |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
N |
|
CH2 |
C |
|
N |
|
CH2 |
C |
|
OH . |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
пептидний зв’язок
Пептидний зв’язок утворюється в результаті відщеплення молекули води при взаємодії аміногрупи однієї амінокислоти з карбоксильною групою іншої. Утворений ковалентний нітро- ген-карбоновий зв’язок називають пептидним зв’язком. Сполука, яка утворюється в результаті конденсації двох амінокислот, називається дипептид. На одному кінці його молекули перебуває вільна аміногрупа, а на іншому — карбоксильна група. Завдяки цьому дипептид може також приєднувати до себе наступні молекули амінокислот.
3. Взаємодія з нітритною кислотою (деза мінування). Подібно до первинних амінів, амінокислоти реагують із нітритною кислотою, при цьому аміногрупа перетворюється в гідроксогрупу, а амінокислота — у гідроксикислоту:
H2N −CH(R) −COOH +HNO2 →
→ HO −CH(R) −COOH +N2 +H2O.
Вимірювання об’єму виділеного азоту дозволяє визначити кількість амінокислоти (метод Ван-Слайка).
4. Взаємодія зі спиртами (естерифікація).
Амінокислоти можуть реагувати зі спиртами в присутності хлороводню, перетворюючись у естер (точніше, у хлороводневу сіль естеру):
H2N −CH(R) −COOH +R1OH HCl→
HCl→H2N −CH(R) −COOR1 +H2O.
Естери амінокислот не мають біполярної структури і є леткими сполуками.
5. Якісні реакції.
1) Усі амінокислоти окиснюються нінгідрином
O
OH
OH
O
з утворенням продуктів, забарвлених у синьофіолетовий колір. Амінокислота пролін утворює з нінгідрином жовтий колір. Ця реакція може бути використана для кількісного визначення амінокислот спектрофотометричним методом:
205
O
|
OH |
R |
|
H2N CH COOH |
|
|
|
|
|
OH |
C2O RCHO |
|
|
|
O |
O |
O |
|
||
|
|
N |
OO
2)Принагріванніароматичнихамінокислотіз сумішшю концентрованої сульфатної та нітратної кислот відбувається нітрування бензенового кільця
йутворюються сполуки, забарвлені в жовтий колір. Цю реакцію називають ксантопротеїновою (від грец. ксантос — жовтий).
добування амінокислот
Основний спосіб добування амінокислот — заміщення атома галогену на аміногрупу в галогенозамінених кислотах. Цей спосіб аналогічний до добування амінів з алкілгалогенів та аміаку. Галогеноводень, який виділяється при заміщенні, зв’язують надлишком аміаку:
Cl −CH(R) −COOH +2NH3 →
→ H2N −CH(R) −COOH +NH4Cl.
Білки
Білки (білкові речовини) — макромолекулярні природні сполуки (біополімери), структурну основу яких становлять поліпептидні ланцюги, побудовані із залишків α -амінокарбонових кислот. Білки неодмінно містять елементи C, H, N та O, майже завжди S, часто P, рідше Fe, Cu, Zn тощо.
За складом білки поділяють на:
—протеїни — прості білки, що складаються із залишків амінокислот;
—протеїди — складні білки, що складаються із залишків амінокислот та різних небілкових речовин.
Олігопептиди включають до 10 залишків амі-
нокислот (дипептиди, трипептиди тощо), а поліпептиди — більше 10 залишків. Поліпептиди зі ступенем конденсації 100 й вище — це і є білки. Молекулярна маса білків коливається від кількох тисяч до кількох мільйонів. У природних білках зустрічається двадцять різних амінокислот. Потенційна розмаїтість білків безмежна, оскільки кожному білку властива своя особлива амінокислотна послідовність, генетично контрольована, тобто закодована в ДНК клітини, яка виробляє даний білок.
Будова білків
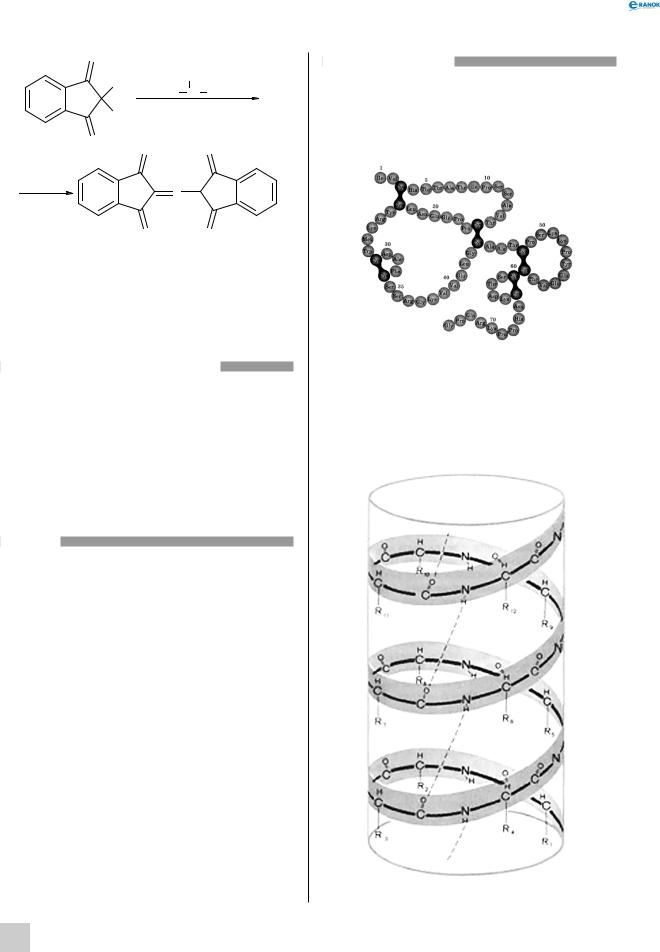
У складі білків зустрічаються залишки 20 амінокислот. Властивості білків залежать не тільки від того, які амінокислотні залишки утворюють їх, але і від того, в якій послідовності вони з’єднуються одна з одною. Таку послідовність називають первинною структурою білка:
Встановлення первинної структури білків — важливе наукове завдання. Інформація про первинну структуру всіх білків організму міститься в молекулі дезоксирибонуклеїнової кислоти
(ДНК).
Поліпептидний ланцюг зазвичай згорнутий
успіраль, що має певну просторову структуру —
α-спіраль:
206

Зазвичай білкова молекула нагадує пружину, що розтягнута. Існування спіральної будови обумовлюється можливістю утворення водневих зв’язків між різними частинами сусідніх амінокислотних залишків. Спіральну будову білків вперше встановив великий американський учений Лайнус Полінг.
Спіраль у свою чергу може приймати певну просторову будову, що є власною для кожного білка: спіраль згортається в клубок (глобулу). Таку будову називають третинною структурою білка:
Для деяких білків характерно об’єднання декількох клубків (субодиниць) в одну частинку, що обумовлює четвертинну структуру білків:
До складу таких об’єднань можуть входити йони металів або інші речовини небілкової природи. Так, молекула білка гемоглобіну складається з чотирьох субодиниць, з’єднаних з йоном Феруму, що дозволяє такій молекулі переносити кисень і вуглекислий газ у тваринному організмі.
хімічні властивості білків
1. Денатурація білків.
Унаслідок дії деяких факторів відбувається руйнування тривимірної конформації білка — денатурація, пов’язане зі зміною вторинної, третинної та четвертинної структур; ця зміна може мати тимчасовий або постійний характер, але й у тому, і в іншому
випадку амінокислотна послідовність білка (первинна структура) залишається незмінною.
Денатурація білків відбувається під впливом нагрівання або впливом яких-небудь випромінювань, наприклад інфрачервоного або ультрафіолетового. Кінетична енергія, яка передається білку, спричинює сильну вібрацію його атомів, унаслідок чого водневі й іонні зв’язки рвуться, білок згортається (коагулює). Сильні кислоти, сильні луги й концентровані розчини солей також спричинюють розрив зв’язків (при тривалому впливі й пептидних).
Катіони важких металів утворюють міцні зв’язки з карбоксильними групами, сприяють розриву іонних зв’язків. Вони також знижують електричну поляризацію білка, зменшуючи його розчинність; білок, що перебуває в розчині, випадає в осад.
Органічні розчинники й детергенти.
Ці реагенти спричинюють розрив внутрішньомолекулярних водневих зв’язків. Використання спирту як засобу для дезінфекції засноване якраз на тому, що він здатний спричинювати денатурацію білка будь-яких присутніх бактерій.
2. Ренатурація.
Іноді денатурований білок за сприятливих умов знову спонтанно набуває своєї нативної (природної) структури. Цей процес називають ренатурацією.
3. Гідроліз.
Найважливішою хімічною властивістю білків є їхня здатність до гідролізу, який може протікати при нагріванні із сильними кислотами або з лугами (кислотно-основний гідроліз) і під дією ферментів (ферментативний гідроліз). Гідроліз призводить до розпаду поліпептидних зв’язків з утворенням вільних амінокислот. Ферменти, які руйнують пептидні зв’язки (протеази), зазвичай мають селективну дію — руйнують зв’язки тільки між залишками певних амінокислот, тож при гідролізі за участю одного з ферментів можуть утворитися замість окремих амінокислот високомолекулярні продукти.
4. Якісні кольорові реакції білків.
а) біуретова реакція на пептидні зв’язки — дія розведеного розчину купрум(ІІ) сульфату на лужний розчин білка, яка супроводжується появою фіолетово-синього забарвлення розчину, що обумовлено комплексоутворенням між йонами Купруму та поліпептидами;
б) ксантопротеїнова реакція на ароматичні й гетероядерні цикли — дія концентрованої нітратної кислоти з появою жовтого забарвлення; забарвлення пояснюється нітруванням циклів й утворенням нітросполук залишками амінокислот;
в) реакція Міллона — дія на білок реактиву
Міллона — розчину Hg(NO3 )2 та Hg2 (NO3 )2 у розведеній HNO3, що містить домішку HNO2,— з появою червоно-коричневого забарвлення, яке обумовлене утворенням пептидних солей Меркурію.
207
