
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
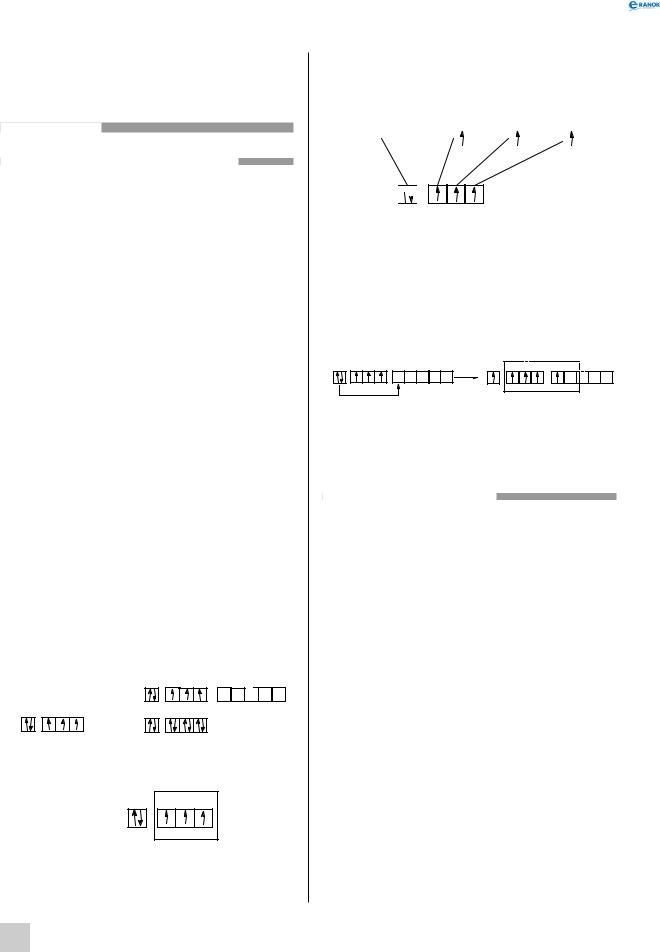
нітрОген. ФОсФОр
характеристика хімічних елементів
властивості хімічних елементів
властивість |
нітроген |
Фосфор |
|
|
|
|
|
Хімічний символ |
N |
P |
|
Порядковий номер |
7 |
15 |
|
Атомна маса |
14,007 |
30,974 |
|
Місце в ПС |
2 період; |
3 період; |
|
|
V група |
V група |
|
Число електронів |
|
|
|
на енергетичних |
2; 5 |
2; 8; 5 |
|
рівнях |
|
|
|
Радіус атома, нм |
0,070 |
0,110 |
|
Потенціал йоніза- |
|
|
|
ції, еВ |
14,53 |
10,484 |
|
|
|||
|
|
|
|
Спорідненість |
0,21 |
0,7 |
|
з електроном, еВ |
|||
|
|
||
Відносна електро- |
3,07 |
2,10 |
|
негативність |
|||
|
|
||
Електронна конфі- |
2s22p3 |
3s23p3 |
|
гурація валентно- |
|||
го рівня |
|
|
|
Можливі валент- |
II, III, IV |
III, V |
|
ності |
|||
|
|
||
Можливі ступені |
–3, –2, –1, 0, |
–3, –2, 0, |
|
окиснення |
+1, +2, +3, |
+1, +3, |
|
|
+4, +5 |
+4, +5 |
|
Ізотопний склад |
14N — 99,635% |
31 |
|
|
15N — 0,355% |
P — 100% |
|
Вміст у земній |
0,025% |
0,05% |
|
корі, мол.% |
|||
|
|
Елементи V групи головної підгрупи (Нітроген N, Фосфор P, Арсен As, Стибій Sb та Вісмут
Bi) називають також пніктогенами. |
|
|||||
|
|
|
|
s |
p |
d |
7 |
N |
s |
p |
15P 3 |
p |
|
|
s |
|
||||
|
|
|
||||
2 |
|
|
2 |
|
|
|
Нітроген виявляє валентність, яка дорівнює
ІІІ, за рахунок утворення зв’язків із трьома неспареними електронами p-підрівня:
|
s |
p |
N |
2 |
|
Валентність IV проявляється за рахунок утворення зв’язку за участю електронної пари атома Нітрогену та вільної орбіталі іншого атома. При цьому утворюється звичайний ковалентний
зв’язок. Такий механізм називають донорно-ак- цепторним механізмом утворення ковалентного
зв’язку. Розгляньмо утворення такого зв’язку на |
|||||||||||
прикладі утворення йона амонію NH+ : |
|
|
|
|
|
||||||
|
|
|
|
4 |
|
|
|
|
|
||
|
s |
|
s |
|
s |
|
|
s |
|
||
1 |
|
1 |
|
1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
H |
|
H |
|
H |
||||
sp
2




N
Отже, Нітроген може утворювати 3 ковалентні зв’язки за обмінним механізмом та 1 зв’язок за донорно-акцепторним механізмом. Загальна кількість можливих зв’язків дорівнює 4, але максимальний ступінь окиснення Нітрогену дорівнює
+5.
П’ятивалентний стан Фосфору реалізується в такий спосіб:
s |
p |
d |
s |
p |
d |
3 |
|
|
3 |
|
|
Нітроген може виявляти будь-який ступінь окиснення від –3 до +5.
Фосфор набагато легше утворює сполуки з позитивним ступенем окиснення, аніж з негативним.
поширеність хімічних елементів нітрогену й Фосфору
Нітроген — це досить поширений елемент у природі. На його частку припадає близько 0,02% маси Землі. Атоми Нітрогену утворюють просту речовину N2, яка у великій кількості міститься в атмосфері нашої планети: 75,6% за масою, або 78,1% за об’ємом. Нітроген входить до складу деяких мінералів, наприклад таких, як індійська селітра KNO3 та чилійська селітра NaNO3. Поклади натрієвої солі тягнуться на три тисячі кілометрів уздовж узбережжя Чилі, звідси походить і назва цього мінералу. Нітроген — це життєво важливий елемент. Він входить до складу білків, нуклеїнових кислот, АТФ та багатьох інших важливих сполук. Організм людини приблизно на 2% складається з Нітрогену. Нітроген у великих кількостях виявлений на 4 планетах Сонячної системи.
Фосфор є більш розповсюдженим елементом на Землі, аніж азот. Вміст Фосфору в нашій планеті дорівнює 0,088% за масою. Фосфор утворює деякі важливі мінерали, такі як фторапатит Ca5 (PO4 )3 F і гідроксиапатит Ca5 (PO4 )3 OH. Ці самі речовини входять до складу кісткової тканини. Значна кількість сполук Фосфору міститься в головному мозку. Фосфор необхідний для існування людини. За добу в організм дорослої людини з їжею надходить близько 1,6 г Фосфору.
124
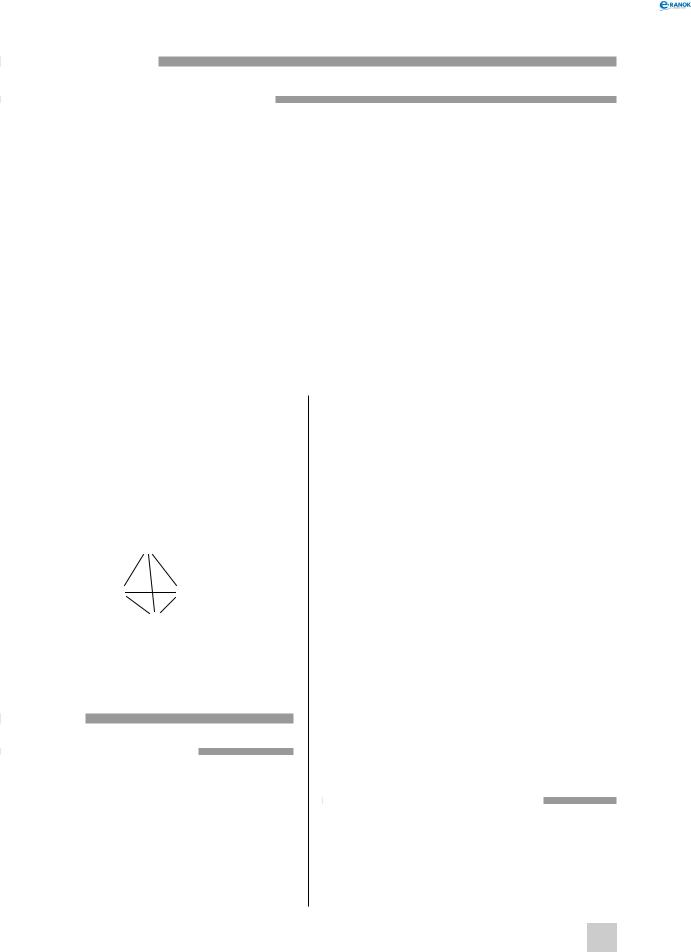
прості речовини
Фізичні властивості простих речовин
властивості |
нітроген |
Фосфор білий |
Фосфор червоний |
|
|
|
|
Формула сполуки |
N2 |
P4 |
P∞ |
Зовнішній вигляд |
Газ |
Воскоподібна твер- |
Порошкоподібна тверда речовина |
у звичайних умовах |
|
да речовина |
|
Колір |
Безбарвний |
Білий |
Залежно від умов одержання змі- |
|
|
|
нюється від темно-коричневого до чер- |
|
|
|
воно-фіолетового |
Температура плав- |
–209 °С |
+44 °С |
+585÷600 °C (при підвищеному тис- |
лення |
|
|
ку); |
|
|
|
+429 °С — сублімація |
Температура кипін- |
–196 °С |
+275 °С |
+800÷850 °C |
ня |
|
|
|
Густина за н. у. |
1,2506 г/л |
1,8 г/см3 |
2÷2,4 г/см3 |
Розчинність у воді |
2 об’єми азоту |
Не розчиняється |
Не розчиняється |
|
в 100 об’ємах води |
|
|
Фосфор утворює кілька алотропних модифікацій. У таблиці наведені властивості білого та червоного фосфору, але існує ще й чорний фосфор, який добувають при високому тиску й температурі близько +200 °С із червоного; він неактивний, проявляє напівпровідникові властивості.
Молекула білого фосфору P4 являє собою правильний тетраедр (трикутну піраміду), у вершинах якої перебувають атоми Фосфору.
P
PP
P
Червоний і чорний фосфор являють собою порізному впорядковані шаруваті структури.
хімічні властивості простих речовин
хімічні властивості азоту
Азот являє собою дуже стійку інертну сполуку. Атоми Нітрогену зв’язані в молекулу потрійним зв’язком: одним σ -зв’язком і двома π -зв’язками. Дляруйнуваннятакоїмолекулинаатоминеобхідно затратити величезну кількість енергії. Наприклад, при 3000 °С дисоціація молекули на атоми відбувається не більш ніж на 0,5%. За рахунок високої стійкості молекули проста речовина поводиться досить пасивно. За звичайних умов азот вступає в реакцію тільки з металічним літієм:
6Li +N2 →2Li3N.
При нагріванні азот взаємодіє з деякими металами та неметалами, при цьому утворюються нітриди, сполуки, в яких Нітроген проявляє ступінь окиснення –3:
3Mg +N2 t→Mg3N2 ,
2Al +N2 t→2AlN,
3H2 +N2 Fe, 400°C→2NH3 ,
2B +N2 t→2BN,
3Cl2 +N2 t→2NCl3 .
В електричному розряді азот реагує з киснем, при цьому утворюються оксиди Нітрогену II та IV. За рахунок цього під час грози повітря, а згодом і ґрунт, збагачується складними сполуками Нітрогену:
N2 +O2 електророзряд→2NO,
N2 +2O2 електророзряд→2NO2 .
Реакції зі складними сполуками для азоту не характерні, однак у ХІХ столітті при виробництві амоніаку скористалися такою реакцією з кальцій карбідом при нагріванні:
CaC2 +N2 t→CaCN2 +C.
хімічні властивості фосфору
Хімічні властивості всіх алотропних модифікацій фосфору однакові, за винятком того, що білий фосфор активніший, ніж червоний, а червоний активніший, ніж чорний. Таким чином, речовину фосфор при складанні хімічних реакцій будемо записувати просто як P. Червоний
125
і чорний фосфор реагують із киснем повітря при підвищеній температурі, а білий — навіть при кімнатній температурі:
4P +5O2 t→2P2O5.
Білий фосфор при повільному окисненні киснем повітря випромінює світло. Це відбувається внаслідок того, що в процесі окиснення енергія, яка виділяється, витрачається на випромінювання світла. Це явище називають хемілюмінесценцією.
Фосфор реагує з деякими неметаламиокисниками, при цьому можуть утворюватися похідні Фосфору з різним ступенем окиснення. Це залежить від кількості речовини-окисника. При надлишку окисника утворюються сполуки Фосфору(V), а при нестачі — Фосфору(III):
2P +3S → P2S3 ,
2P +5S → P2S5 ,
2P +3Cl2 →2PCl3 ,
2P +5Cl2 →2PCl5 .
Фосфор вступає у взаємодію з багатьма активними металами. При цьому утворюються фосфіди металів. Фосфіди — це сполуки, в яких атом Фосфору виявляє ступінь окиснення –3:
3Ca +2P t→Ca3P2 .
З воднем пряма реакція не проходить, тому
фосфін (PH3 ) добувають непрямими методами з фосфідів:
Mg3P2 +6HCl →3MgCl2 +2PH3.
Фосфін — це дуже нестійка сполука, на повітрі вона самозаймається:
2PH3 +4O2 → P2O5 +3H2O.
Фосфін утворюється при гнитті на болотах та цвинтарях, саме тому багато людей вважають процес самозаймання фосфіну виходом душі людини з тіла.
Оскільки білий фосфор може самозайматися на повітрі, його залишки необхідно утилізувати, задля того аби уникнути пожежі. Відходи фосфору знищують за допомогою розчину купрум(ІІ) сульфату:
2P +5CuSO4 +8H2O →2H3PO4 +5Cu +5H2SO4 .
У результаті цієї реакції шматочки білого фосфору покриваються плівкою металічної міді, й окиснення фосфору стає неможливим.
методи добування простих речовин
У промислових масштабах азот добувають фракційною перегонкою рідкого повітря. Оскільки температура кипіння азоту є найнижчою серед газів, які входять до складу повітря, то він випаровується в першу чергу.
Існує багато різних лабораторних методів добування азоту. Найчастіше користаються методом термічного розкладу амоній нітриту, у результаті якого утворюється вода й азот:
NH4NO2 t→2H2O +N2 ↑.
Рідше використовують метод розкладу амоній дихромату та окиснення амоніаку:
(NH4 )2 Cr2O7 t→2N2 ↑ +Cr2O3 +4H2O,
2NH3 +3CuO t→N2 ↑ +3Cu +3H2O.
Однак за допомогою цих методів можна добути тільки «мокрий» азот, тобто з водяною парою. У деяких випадках домішки води є небажаними, тоді азот добувають розкладанням гідразину
(N2H4):
3N2H4 →N2 ↑ + 4NH3 ↑.
Фосфор у великих кількостях добувають з апатиту, внаслідок сплавки його з піском та деревним вугіллям при температурі близько +1500 °С. При цьому утворюються пари фосфору, які згодом кристалізуються на холодній поверхні у вигляді білого фосфору:
2Ca3 (PO4 )2 +10C +6SiO2 1500°C→
1500°C→6CaSiO3 +10CO +4P ↑.
застосування простих речовин
Більшу частину добутого в промисловості азоту використовують для виробництва амоніаку. Багато азоту йде для виробництва нітратних добрив, які добувають із повітря при електричному розряді. За рахунок своєї інертності азот часто застосовують для створення інертної атмосфери в різних промислових процесах, для заповнення ламп розжарювання, для заповнення вільного місця в термометрах та барометрах. У металургії азот використовують при загартовуванні сталі, тому що на поверхні розпеченого металевого лиття утворюється тугоплавкий і стійкий ферум нітрид.
Фосфор використовують у піротехнічній промисловості, а також при виготовленні сірників (у намазці на коробці міститься близько 31% червоного фосфору). Велику кількість фосфору використовують для добування дуже важливої хімічної сполуки — ортофосфатної кислоти H3PO4. Виготовлення різних добрив (суперфосфату, амофосу тощо) також відбувається з використаннням фосфору. Упродовж останніх 50 років інтенсивно розвивається фосфорорганічна хімія. Серед органічних сполук, які містять атоми Фосфору, перебувають найважливіші інсектициди, бойові отруйні речовини (зарин, зоман тощо), деякі ліки, стимулятори росту рослин та інші сполуки, для яких характерні важливі хімічні та біологічні ознаки.
амоніак
Молекула амоніаку (NH3 ) являє собою трикутну піраміду, в одній вершині якої перебуває
126
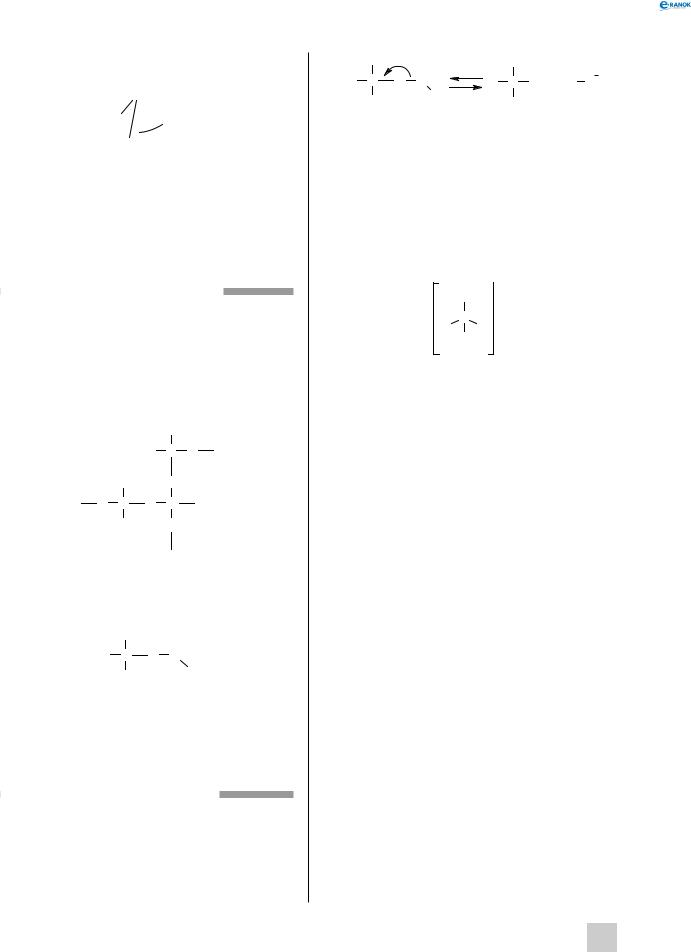
атом Нітрогену, а в інших — атоми Гідрогену. Кут між зв’язками NH дорівнює 107,8°.
N
H  H
H 107,8o H
107,8o H
Атом Нітрогену в даній сполуці виявляє ступінь окиснення –3.
Атоми зв’язані в молекулу ковалентними полярними зв’язками. Атом Нітрогену в даному разі є акцептором електронів, а атоми Гідрогену — донорами. За рахунок цього на атомах Гідрогену концентрується позитивний заряд, а на атомі Нітрогену — негативний.
Фізичні властивості амоніаку
Амоніак являє собою безбарвний газ, із дуже різким характерним запахом. Саме амоніак надає запаху медичному препарату, який називають «нашатирний спирт». Температури його фазових
переходів дорівнюють: Тпл = –78 °С і Ткип = –33 °С. У рідкому стані між молекулами амоніаку утворю-
ються стійкі водневі зв’язки, чим пояснюються високі температури кипіння та плавлення:
H
H N H
HH H N H N
HH
Амоніак дуже добре розчиняється у воді: при +20 °С в 1 літрі води розчиняється 700 літрів амоніаку, а при 0 °С — 1180 літрів. Така добра розчинність у воді пояснюється утворенням водневих зв’язків між молекулами амоніаку та води:
H
H N H O
HH
Рідкий амоніак є гарним полярним розчинником. У ньому розчиняються багато йонних сполук, наприклад такі, як NH4I (369 г солі на 100 г
амоніаку), NH4Cl (103), AgCl (207).
Окрім води, амоніак розчиняється в спирті, хлороформі, ацетоні та деяких інших розчинниках.
хімічні властивості амоніаку
реакції приєднання
Процес утворення водневого зв’язку між атомом Гідрогену молекули води та атомом Нітрогену амоніаку зазвичай на цій стадії не зупиняється, а проходить із утворенням йонів амонію та гідроксид-іонів. Зсув електронної густини зазначений на схемі стрілочкою:
HH
H N H O |
H N+ H + H O |
H H H
Або в молекулярному вигляді:
NH3 +H2O NH3 H2O NH4+ +OH−.
Четвертий зв’язок між Нітрогеном та Гідрогеном в йоні амонію утворюється за донорно-акцеп- торним механізмом. Йон амонію має форму правильної трикутної піраміди (тетраедра), у вершинах якої перебувають атоми Гідрогену, а в її центрі — атом Нітрогену. При цьому заряд не зосереджений на якому-небудь атомі в молекулі, а рівномірно розподілений між всіма п’ятьма атомами:

 + H
+ H
H NH H
Із наведених вище рівнянь реакцій видно, що розчин амоніаку у воді є основою, тобто генерує гідроксид-іони. Однак записувати цю основу як гідроксид амонію NH4OH не слід, оскільки така сполука не виявлена ані в розчині, ані в кристалічному стані. Її слід записувати як NH3 H2O, тому що такі частинки виявлені у водних розчинах.
Константа дисоціації NH3 H2O на йон амонію та гідроксид-іон у водному розчині дорівнює
1,77 10-5.
Основні властивості амоніаку проявляються в реакціях з кислотами. При цьому утворюються солі амонію:
NH3 +HCl → NH4Cl,
NH3 +H2SO4 → NH4HSO4 ,
2NH3 +H2SO4 →(NH4 )2 SO4.
Йон амонію в розчині поводиться так, як йон лужного металу Калію, що можна пояснити подібними розмірами цих йонів.
Солі амонію в сильному лужному середовищі розпадаються, тому що більш сильні основи витісняють із розчину більш слабкі основи:
NaOH +NH4Cl →NH3 ↑ +NaCl +H2O.
реакції з металами
Рідкий амоніак за деякими хімічними властивостями схожий на воду. Наприклад, при реакції активного металу з водою виділяється водень і утворюється гідроксид. З іншого боку, при взаємодії того ж активного металу з рідким амоніаком так само виділяється водень й утворюється амід металу:
2Na +2H2O → H2 +2NaOH,
2Na +2NH3 → H2 +2NaNH2.
127
Такі аналогії проявляються й в інших реакціях, наприклад реакції нейтралізації у воді та амоніаку мають такий вигляд:
NaOH +HCl → NaCl +H2O,
OH− +H+ → H2O,
NaNH2 +NH4Cl → NaCl +2NH3 ,
NH2− +NH4+ →2NH3 .
Таким чином, аналогами основ у водних розчинах є аміди металів, а аналогами кислот — солі амонію. Наприклад, сильними кислотами в амоніаку є хлорид і нітрат амонію (NH4Cl та NH4NO3), а сильними основами — аміди Натрію й Калію (NaNH2 та KNH2).
При надлишку металу в рідкому амоніаку утворюються іміди, сполуки, в яких 2 атоми Гідрогену з амоніаку замінені атомами металів:
2Na +NH3 → H2 +Na2NH.
Граничним випадком такого заміщення є нітриди Na3N.
При гідролізі всіх сполук такого типу утворюється луг та амоніак:
Na2NH +2H2O →2NaOH +NH3 .
реакції зі зміною ступеня окиснення
Атом Нітрогену в молекулі амоніаку здатний тільки окиснюватися й при цьому виступати в ролі відновника. При високій температурі амоніак згорає в кисні повітря, унаслідок чого утворюється молекулярний азот і вода:
4NH3 +3O2 →2N2 +6H2O.
У присутності каталізатора (Pt, Cr2O3) окиснення Нітрогену продовжується, при цьому утворюється нітроген(II) оксид:
4NH3 +5O2 Pt,Cr2O3→4NO ↑ +6H2O.
У водних розчинах відновлює бром: 8NH3 +3Br2 →6NH4Br +N2 ↑.
солі амонію
За рахунок гідролізу розчини солей амонію проявляють слабокислу реакцію:
NH4NO3 +H2O → NH3 H2O +HNO3 .
При дії розчинів лугів на солі амонію виділяється амоніак:
NH4Cl +NaOH →NH3 ↑ +NaCl +H2O.
Солі амонію при нагріванні розкладаються за різними механізмами:
NH4Cl t→NH3 ↑ + HCl ↑
(NH4 )2 CO3 t→2NH3 ↑ + CO2 ↑ + H2O NH4NO2 t→N2 ↑ +2H2O
NH4NO3 t→N2O ↑ +2H2O.
Солі амонію використовують у багатьох галузях народного господарства. Це показано в таблиці.
назва |
Формула |
|
сфера застосування |
|||||||
сполуки |
сполуки |
|
|
|
|
|
|
|||
|
|
|
|
|||||||
Амоній |
NH4NO3 |
|
Добре нітратне добри- |
|||||||
нітрат |
|
|
|
|
во в сільському гос- |
|||||
або аміачна |
|
|
|
|
подарстві, |
а |
також |
|||
селітра |
|
|
|
|
при виготовленні різ- |
|||||
|
|
|
|
|
них піротехнічних ви- |
|||||
|
|
|
|
|
робів, наприклад без- |
|||||
|
|
|
|
|
димного пороху |
|
||||
|
|
|
|
|
|
|
|
|
||
Амоній |
(NH |
4 |
) SO |
4 |
Добриво |
|
|
|
||
сульфат |
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
Карбонат |
(NH4 )2 SO3 |
У медицині, |
в |
текс- |
||||||
та гідроген- |
тильній та |
харчовій |
||||||||
та |
|
|
|
|||||||
карбонат |
NH4HCO3 |
|
промисловості |
|
|
|||||
амонію |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
Амоній |
NH4Cl |
|
При |
виробництві де- |
||||||
хлорид |
|
|
|
|
яких видів гальваніч- |
|||||
|
|
|
|
|
них |
елементів, |
при |
|||
|
|
|
|
|
паянні, у текстиль- |
|||||
|
|
|
|
|
ній |
промисловості, |
||||
|
|
|
|
|
у медицині, а також |
|||||
|
|
|
|
|
як добриво |
|
|
|
||
застосування амоніаку
Амоніак переважно використовують як реагент для виробництва більш складних хімічних сполук, таких як нітратна кислота, сода, різні солі амонію. Багато амоніаку використовують для виробництва різних органічних сполук, що містять атоми Нітрогену. Сьогодні амоніак широко використовують у холодильних установках. Іноді амоніак використовують як рідке добриво.
якісна реакція на йон амонію
Оскільки майже всі солі амонію добре розчиняються у воді, то для виявлення амоніаку вивчають запах досліджуваного розчину, в який попередньо додають луг. У разі присутності в розчині йонів амонію, при підлуговуванні виділяється амоніак, запах якого легко виявити:
NH4Cl +NaOH → NH3 ↑ +NaCl +H2O.
добування амоніаку
У промисловості амоніак добувають із простих речовин у присутності каталізатора губчатого заліза, платини або вольфрам оксиду W2O5 з добавкою деяких сполук, таких як оксиди Калію K2O, Феруму(III) Fe2O3, Кальцію CaО та Силіцію SiО2. Для цього каталізатора отрутами є сполуки Сульфуру та оксиди Карбону, тому сировину заздалегідь очищають від таких домішок. Реакція синтезу амоніаку є екзотермічною, тобто в ході реакції виділяється теплота:
3H2 +N2 2NH3, ∆H = −92 кДж/моль.
Об’єм суміші в результаті реакції зменшується (реагентів — 4 об’єми, а продуктів — тільки 2). Тоді, за принципом Ле Шательє, для кращого виходу продукту необхідно дотримуватися низької температури та високого тиску. З огляду на це, за-
128
