
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
У промисловості добувають волокна і тим, і іншимспособом.Волокна,добутіпереробкоюприродних полімерних матеріалів, називають штучними, а добуті із синтезованих полімерів — синтетич ними. Штучні й синтетичні волокна об’єднують в одну групу хімічних волокон, тому що при добуванні і тих, і інших, на відміну від природних волокон, використовують хімічні методи.
добування штучних волокон
У ролі вихідного природного полімеру для добування штучних волокон беруть целюлозу, виділену з деревини, або бавовняний пух, що залишається на насінні бавовнику після того, як з нього знімуть волокна бавовни.
Для того щоб розташувати лінійні молекули полімеру вздовж осі утвореного волокна, насамперед їх слід відокремити одне від одного, зробити рухливими, здатними до переміщення. Цього можна досягти розплавлюванням полімеру або його розчиненням. Розплавити целюлозу неможливо: при нагріванні вона руйнується. Отже, треба шукати можливість розчинення целюлози.
Цього можна досягти шляхом її хімічної обробки. Целюлозу обробляють оцтовим ангідридом
уприсутності сульфатної кислоти (оцтовий ангідрид — більш сильний естерифікаційний засіб, аніж оцтова кислота).
Продукт естерифікації — триацетат целюлози
розчиняють у суміші дихлорметану CH2Cl2 та етилового спирту. Утворюється в’язкий розчин, в якому молекули полімеру вже можуть переміщатися й набувати того чи іншого потрібного порядку.
Зметою добування волокон розчин полімеру продавлюють через фільєри, які являють собою металеві ковпачки із численними отворами. Утворювані тонкі струмені розчину опускаються у вертикальну шахту заввишки приблизно 3м, через яку проходить нагріте повітря.
Під дією теплоти розчинник випаровується, і триацетат целюлози утворює тонкі довгі волоконця, які потім скручують у нитки для подальшої переробки. При проходженні через отвори фільєри макромолекули, як колоди при сплаві по вузькій річці, починають вишиковуватися вздовж струменя розчину. У процесі подальшої обробки розташування макромолекул у них стає ще більш упорядкованим. Це призводить до великої міцності волоконець й утворених ними ниток.
Незрідка штучні волокна використовують не
увигляді довгих ниток (шовку), а у вигляді штапелю — різаних некручених волокон завдовжки в кілька сантиметрів. Штапель можна використовувати для спільного прядіння з іншими волокнами, наприклад з вовною.
Ацетатне волокно менше втрачає міцність
увологому стані, ніж штучне віскозне волокно. Унаслідок більш низької теплопровідності воно краще зберігає тепло. Крім того, це волокно від-
значається м’якістю, не дуже мнеться, менше сідає при пранні, має приємний блиск. Усе це робить його цінним текстильним матеріалом.
нітрОгенОвмісні спОлуки
аміни
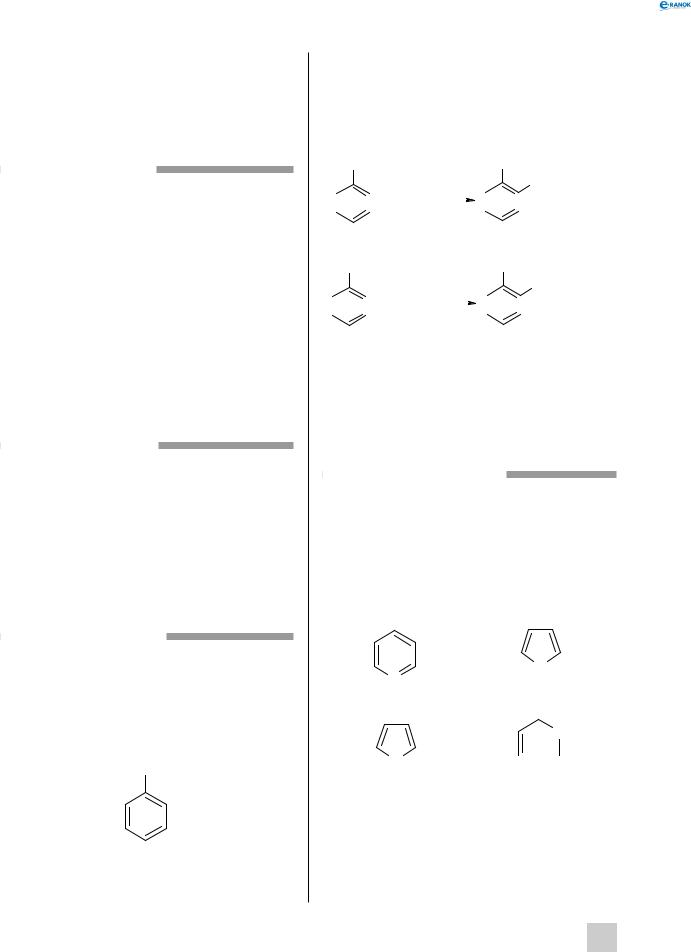
Аміни — це клас органічних сполук, які містять у своєму складі аміногрупу (NH2 ).
Аміногрупа є функціональною для цього класу сполук. Простий представник цього класу — метиламін (CH3 NH2 ). Загальна формула насичених амінів: CnH2n+1 −NH2 або CnH2n+3N.
номенклатура амінів
Необхідно розрізняти поняття «аммін» і «амін». Поняття «аммін» відповідає сполукам аміаку, а поняття «амін» характеризує клас органічних сполук амінів.
Правила побудови назви амінів аналогічні таким самим правилам для спиртів. Назва амінів походить від назви відповідного вуглеводню, при цьому перед назвою вуглеводню ставиться номер атома Карбону, з яким сполучена аміногрупа, і префікс «аміно». Наприклад, сполука
CH3 |
|
CH |
|
CH3 |
|
||||
|
|
|||
|
|
|
|
|
|
NH2 |
називатиметься 2-амінопропан. |
||
Залежно від кількості атомів Гідрогену і від кількості замісників, безпосередньо сполучених з атомом Нітрогену, аміни класифікують на первинні, вторинні, третинні та четвертинні:
|
|
|
|
|
|
кількість |
кількість |
|
тип |
приклад |
атомів |
||||||
замісників |
||||||||
|
|
|
|
|
|
гідрогену |
||
|
|
|
|
|
|
|
||
|
|
|
|
|||||
Первинний |
CH3NH2 |
2 |
1 |
|||||
Вторинний |
(CH3)2NH |
1 |
2 |
|||||
Третинний |
(CH3)3N |
0 |
3 |
|||||
Четвертин- |
(CH |
|
) |
|
N+ |
0 |
4 (сольова |
|
ний |
|
3 |
|
4 |
|
|
будова) |
|
Фізичні властивості
За нормальних умов усі аміни є рідинами або твердими речовинами, окрім метиламіну (CH3NH2, tкип = –6,9 оС). Зі збільшенням кількості атомів Карбону температури фазових переходів збільшуються. Якщо розташувати температури плавлення і кипіння третинних, вторинних і первинних амінів у ряд, то можна простежити таку
закономірність: Ттрет < Твтор < Тперв. Це пояснюється утворенням міжмолекулярних водневих зв’язків
202
між атомом Нітрогену й атомами Гідрогену аміногрупи: у третинних амінах такого водню немає, і відповідно міжмолекулярні взаємодії слабші.
Нижчі аміни добре розчиняються у воді, а гомологи з великою кількістю атомів Карбону — погано.
Аміни мають запах амоніаку, а у разі сильного розбавлення запах подібний до запаху риби.
методи добування
1. Реакція Гофмана (алкілування амоніаку галогеналканами):
RI +NH3 →[RNH3 ]+ I− →RNH2 +HI. Перебіг реакції продовжується, при цьому
відбувається алкілування аміну RNH2 й утворення вторинної похідної R2NH, і так далі, аж до утворення четвертинної амонійної солі.
RI +RNH2 →[R2NH2 ]+ I− →R2NH +HI,
RI +R2NH →[R3NH]+ I− →R3N +HI,
RI +R3N →[R4N]+ I− .
2. Взаємодія амоніаку з оксосполуками (альдегідами та кетонами):
R1COR2 +NH3 +H2 →R1CH(NH2 ) R2 +H2O.
3. Взаємодія амідів карбонових кислот з натрій гіпохлоритом (розщеплення за Гофманом):
R −CONH2 +NaOCl →RNH2 +NaCl +CO2 .
хімічні властивості
1. Кислотно-основні властивості амінів: Водні розчини амінів показують луж-
ну реакцію, аналогічно амоніаку, за рахунок гідролізу:
RNH2 +H2O →[RNH3 ]+ +OH− .
2.Алкілування амінів відбувається аналогічно алкілуванню амоніаку (див. метод добування амінів №1).
3.Взаємодія з нітритною кислотою (HNO2) — якісна реакція на аміни:
R −NH2 +NHO2 →R −OH +N2••+H2O.
застосування амінів
Головним чином аміни та їхні похідні використовуються в лакофарбовій промисловості для добування барвників різноманітних відтінків, для добування штучних волокон, а також як високоефективні розчинники.
анілін
Існують також ароматичні аміни. Формула простого аніліну — амінобензен:
NH2
Добування аніліну в промислових масштабах проводять за реакцією, відкритою великим російським ученим Зініним. При цьому нітробензен відновлюється до аніліну під дією відновників:
C6H5 −NO2 +6[H] →C6H5 −NH2 +2H2O. Атомарний водень, який є відновником у цій
реакції, добувають безпосередньо в реакційній суміші взаємодією цинку з хлоридною кислотою.
Хімічні властивості аніліну:
1. Хлорування в орто- або пара-положенні:
|
|
|
NH2 |
|
|
|
|
NH2 |
|||
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
+ Cl2 |
|
|
|
|
|
+ HCl |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
2. Сульфурування в орто- або пара- |
||||||||
положенні: |
|
|
|
|
|
|
|||||
|
|
|
NH2 |
|
|
|
|
NH2 |
|||
|
|
|
|
|
+ H2SO4 |
|
|
|
|
|
SO3H |
|
|
|
|
|
|
|
|
|
|
+ H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Окиснення до нітробензену:
C6H5NH2 +3[O] →C6H5NO2 +H2O.
У даний час анілін переважно застосовується для синтезу поліуретанових матеріалів, а також як напівпродукт у виробництві барвників, вибухових речовин і лікарських засобів (сульфаніламідні препарати).
гетероциклічні сполуки
Гетероциклічні сполуки — це органічні сполуки, які містять циклічні угруповання атомів, серед яких поряд з атомами Карбону присутні й атоми інших елементів (Нітрогену, Оксигену, Сульфуру). Деякі гетероциклічні сполуки виявляють ароматичні властивості, на зразок бензену, що пояснює стійкість таких систем.
Формули деяких гетероциклічних сполук та їхні назви наводяться у таблиці.
N
NH
піридин пірол
 N
N
O N
N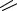
фуран піримідин
піридин
Піридин є шестичленною ароматичною гетероциклічною сполукою, що містить один атом Нітрогену. Добувають його як побічний продукт під час переробки кам’яновугільної смоли.
За звичайних умов піридин — це безбарвна рідина, що має специфічний неприємний запах.
203
