
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
OH |
|
|
|
|
OH |
|||
|
|
|
|
O2N |
|
|
|
NO2 |
|
|
|
|
|
|
|||
|
|
+3HNO |
H2SO4 |
|
|
|
+3H O |
|
|
|
|
|
|
|
|
||
|
|
3 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
NO2
4. Бромування фенолу також відбувається значно легше, ніж для бензолу. Реакція протікає так легко, що фенол реагує навіть із бромною водою(розчиномбромууводі) зутвореннямтрибромфенолу, що випадає в осад:
OH OH
Br Br
+3Br2 |
+ 3HBr |
Br
5. Якісна реакція на феноли. Якісною ре-
акцією на фенол є його кольорова реакція із ферум(ІІІ) хлоридом: безбарвний розчин фенолу реагує зі світло-жовтим ферум(ІІІ) хлоридом з утворенням темно-синього ферум феноляту:
OH
|
O |
|
+ FeCl3 |
Fe O |
+HCl |
|
O |
|
застосування фенолу
Колисьфенолуважалиоднимзнайважливіших антисептиків і широко використовували для дезінфекції приміщень, меблів, хірургічних інструментів. Дотепер збереглася тривіальна назва фенолу — карболова кислота. Зараз фенол рідко виступає в ролі антисептика, його замінили інші речовини. Натомість усе більше й більше зростає роль фенолу в синтетичній промисловості. З фенолу добувають капролактам, який застосовують для виробництва пластмас та синтетичного капронового волокна, разом з формаліном із нього добувають феноло-формальдегідні смоли:
OH O
 O
O
Салол
На основі фенолу добувають вибухові речовини, наприклад пікринову кислоту:
OH
O2N  NO2
NO2
NO2
Окрім того, деякі феноли — гідрохінон, пірокатехін та пірогалол — застосовують у виробництві хімреактивів для фотографічних процесів.
альдегіди
поняття про альдегіди
До альдегідів належать сполуки, які у своєму складі містять альдегідну групу. Альдегідна група є функціональною групою альдегідів:
O
C
H
Скорочено альдегідну групу записують: −CHO. Найпростішим альдегідом є мурашиний альдегід, у молекулі якого до альдегідної групи приєднаний атом Гідрогену, його молекулярна формула — CH2O.
Зв’язки атома Карбону в альдегідній групі аналогічні до зв’язків у ненасичених вуглеводнях: три його валентні електронні хмари в стані sp2-гібри- дизації утворюють зв’язки із двома атомами Гідрогену (в інших альдегідах — з атомами Гідрогену й Карбону) і з атомом Оксигену. Усі ці зв’язки лежать в одній площині. Хмара четвертого валентного електрона розташована перпендикулярно до цієї площини й має форму об’ємної вісімки. Хмари двох неспарених валентних електронів атома Оксигену також мають форму об’ємних вісімок, вони розташовані перпендикулярно один до одного. Одна із цих електронних хмар бере участь в утворенні
σ-зв’язку з атомом Карбону, інша перекривається
вперпендикулярній площині з електронною хмарою атома Карбону, утворюючи π -зв’язок.
З’єднані подвійним зв’язком атоми Оксигену й Карбону мають різну електронегативність. Унаслідок цього область перекривання електронів (область найбільшої електронної густини) зміще-
на до атома Оксигену. Таким чином, подвійний зв’язок C = O поляризований:
δ−
 O
O
δ+C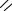
H
186

гомологічний ряд і номенклатура альдегідів
Правила складання назв альдегідів аналогічні до правил для вуглеводнів та спиртів. Відмінність полягає тільки в тому, що назва альдегідів за номенклатурою IUPAC утворюється додаванням суфікса -аль до назв відповідних алканів. Однак деякі альдегіди мають свої історично сформовані тривіальні назви, які зустрічаються в літературі значно частіше, ніж назви за міжнародною номенклатурою.
Назви альдегідів
Формула |
назва IUPAC |
тривіальна назва |
|
|
|
|
|
HCHO |
Метаналь |
Формальдегід, |
|
мурашиний альдегід |
|||
|
|
||
|
|
|
|
CH3CHO |
Етаналь |
Ацетальдегід, |
|
оцтовий альдегід |
|||
|
|
|
|
C2H5CHO |
Пропаналь |
Пропіоновий |
|
альдегід |
|||
|
|
|
|
C3H7CHO |
Бутаналь |
Масляний альдегід |
|
C4H9CHO |
Пентаналь |
Валеріановий |
|
альдегід |
|||
|
|
|
Загальна формула насичених альдегідів CnH2nO. Зверніть увагу на відмінність загальних формул альдегідів і насичених спиртів
(CnH2n+2O) — вони відрізняються за складом на два атоми Гідрогену. Таким чином, альдегіди є дегідрованими спиртами.
Фізичні властивості альдегідів
Альдегіди — безбарвні речовини, з характерним запахом. Перший член гомологічного ряду альдегідів — формальдегід — при звичайних умовах є газоподібною речовиною (на відміну від спиртів).
Формула |
назва |
т , °с |
т , °с |
розчинність |
||||
|
|
|
|
|
IUPAC |
пл |
кип |
у воді |
HCHO |
Мета- |
–92 |
–21 |
Добре, |
||||
|
|
|
|
|
наль |
|
|
макс. 44% |
CH CHO |
Етаналь |
–123 |
20,2 |
Необмеже- |
||||
|
|
3 |
|
|
|
|
|
на |
C |
|
H |
|
CHO |
Пропа- |
–103,3 |
50,3 |
Добре, |
|
2 |
|
5 |
|
наль |
|
|
макс. 31% |
C3H7CHO |
Бута- |
–97,1 |
74,8 |
Добре, |
||||
наль |
макс.7,1% |
|||||||
C4H9CHO |
Пента- |
–91,5 |
103,4 |
Добре, |
||||
наль |
макс. 2% |
|||||||
Для утворення водневого зв’язку атом Гідрогену повиненматипозитивнийзаряд.Уцьомуразізв’язок C −H у функціональній групі альдегідів слабко поляризований, частковий заряд на атомі Гідрогену недостатній для утворення водневого зв’язку з атомами Оксигену іншої молекули. Але, на відміну від вуглеводнів, перші члени ряду розчинні у воді. Це відбу-
вається за рахунок атомів Гідрогену молекул води, які утворюють водневі зв’язки з атомами Оксигену карбонільної групи, оскільки позитивний заряд на них більший унаслідок більшої електронегативності Оксигену порівняно з Карбоном. У зв’язку із цим міжмолекулярна взаємодія між молекулами альдегідів менша порівняно зі спиртами, за рахунок чого в альдегідів температура плавлення й кипіння менша, ніж у відповідних альдегідів. Однак можливість утворення водневих зв’язків з молекулами води зберігається (але меншою мірою, ніж у спиртів), за рахунок чого в альдегідів зберігається добра розчинність у воді, але менша, ніж у відповідних спиртів.
хімічні властивості альдегідів
1. Горіння. Як і більшість органічних сполук, альдегіди добре горять на повітрі з утворенням вуглекислого газу й води. Причому зі збільшенням вуглеводневого радикала збільшується кількість молекул альдегідів, які горять із утворенням вуглецю (сажі) та води.
CH2O +O2 → CO2 +H2O ,
C10H20O +O2 → C +H2O.
2. Гідрування. Гідрування альдегідів проходить у присутності каталізаторів (Ni, Pt, Pd тощо).
HH
H |
|
C |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
H |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
або CH3 |
CH2 |
OH |
|
|
|
C |
|
|
+ |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
CH |
|||||||||||||
H |
O |
H |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
O |
|
H |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Більш важливо розглянути цю властивість із погляду окисно-відновних реакцій. Оскільки в органічних сполуках атоми Карбону можуть виявляти різні ступені окиснення, то слід виходити з того, що в атомів Гідрогену ступінь окиснення завжди +1, а в Оксигену — –2:
C−3H3+1C+1H+1O−2 +2H+ +2e → C−3H3+1C−1H2+1O−2H+1.
Атом Карбону, який входив до альдегідної групи, змінює ступінь окиснення за рахунок прийому двох електронів, отже, він відновився. Із цього можна зробити висновок, що спирт — це відновлений альдегід і навпаки: альдегід — це окиснений спирт. Отже, процес приєднання молекули водню альдегідами — це окисно-відновний процес, у ході якого альдегіди відновлюються до спиртів.
3. Окиснення альдегідів (реакція срібного дзеркала). Унаслідок наявності надлишкового позитивного заряду на карбоновому атомі електронна густина, що зв’язує його з атомом Гідрогену, трохи зміститься до Карбону й атом набуде більшої реакційної здатності (цей зсув, однак, не такий значний, аби міг встановлюватися міцний водневий зв’язок між молекулами альдегіду).
187
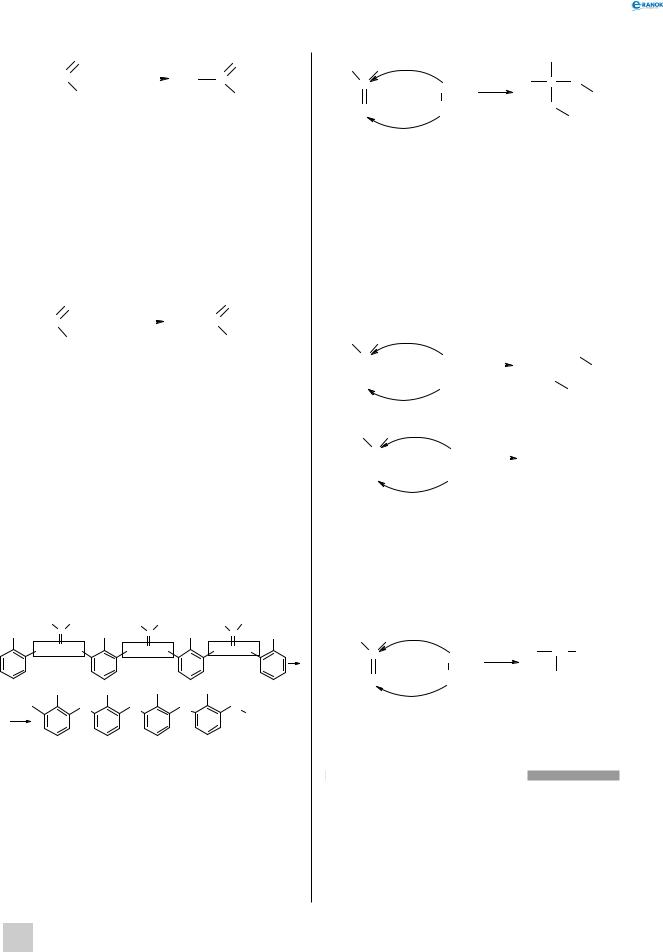
|
|
O |
|
|
|
O |
+1 |
|
|
|
+3C + 2Ag |
||
H3C |
|
C + Ag |
O |
|
H C |
|
|
||||||
|
|
|||||
2 |
|
3 |
|
|||
|
|
H |
|
|
|
OH |
У цій реакції атом Карбону альдегідної групи віддає два електрони, отже, реакція з аргентум оксидом також є окисно-відновною, однак у цьому разі альдегід уже підлягає окисненню. І якщо результатом відновлення альдегідів є спирти, то внаслідок окиснення утворюються карбонові кислоти.
Окиснення альдегідів купрум(ІІ) гідроксидом.
Аналогічно до аргентум оксиду купрум(ІІ) гідроксид здатний окиснювати альдегіди. При цьому утворюється жовтий осад одновалентного
купрум(І) гідроксиду: |
|
|
|
|
|||
|
|
O |
|
|
|
|
O |
H C |
|
C + |
Cu(OH) |
|
H3C |
|
C + Cu(OH) |
|
|
|
|||||
3 |
|
|
2 |
|
|
|
|
|
|
H |
|
|
|
|
OH |
При подальшому нагріванні відбувається розклад купрум(І) гідроксиду й утворення червоного осаду одновалентного купрум(І) оксиду:
2CuOH → Cu2O +H2O.
4. Поліконденсація. Ненасичені вуглеводні вступають у реакцію полімеризації, унаслідок якої велика кількість молекул ненасичених сполук здатні з’єднуватися один з одним і утворювати досить довгі ланцюги, як, наприклад, у результаті полімеризації етилену утворюється поліетилен. Аналогічним способом можуть з’єднуватися молекули формальдегіду з молекулами фенолу, утворюючи в такий спосіб молекулу полімеру. У результаті цієї реакції, крім високомолекулярної сполуки (смоли), утворюється також низькомолекулярна (вода). Цим реакція поліконденсації відрізняється від полімеризації.
H |
H |
H |
H |
H |
H |
|
OH |
C |
OH |
C |
OH |
C |
OH |
H |
O H |
H |
O H |
H O H |
|
|
OH |
OH |
OH |
OH |
|
|
|
|
CH2 |
CH2 |
CH2 |
CH2 |
|
|
–H2O
5. Гідратація. При вивченні хімічних властивостей ненасичених вуглеводнів розглядалися реакції приєднання за кратним зв’язком складних сполук з полярними ковалентними зв’язками в молекулі (HCl, H2O). Природно припустити, що подібні реакції можливі і в альдегідів, тим більше, що хімічний зв’язок у карбонільній групі вже поляризований і ніби готовий до приєднання речовин з полярними зв’язками, тому у водних розчинах відбувається така реакція:
H δ+ H |
|
|
H |
δ− |
H |
C O |
|
C |
OH |
||
Oδ− + |
|
H |
|
Hδ+ |
|
||
|
O |
||
|
|
|
H |
У випадку формальдегіду ця оборотна реакція суттєво зміщена вправо, унаслідок чого він існує в розчині переважно в гідратній формі (99,9%). У цьому разі до позитивно зарядженого атома Карбону карбонільної групи приєднується гідроксильна група за допомогою вільної електронної пари атома Оксигену; електрони π -зв’язку повністю переходять до атома Оксигену й за допомогою них до нього приєднується протон.
6. Утворення напівацеталей та ацеталей зі спиртами. Подібним чином альдегіди реагують з одноатомними спиртами, адже спирти за типом своєї будови схожі на воду:
H δ+ H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|||||||
|
|
δ− |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
H |
|
|
C |
|
|
|
O |
|||||||||
C |
|
OH |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Oδ− |
|
|
|
|
|
|
|
|
O |
CH |
||||||||||
|
|
|
|
|
|
|
δ+ |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
напівацеталь |
|||||||||
R δ+ H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
||||||
|
|
|
δ− |
|
|
|
R |
|
|
|
|
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
C |
|
|
|
||||||||||
|
|
C |
+ |
|
OH |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Oδ− |
|
|
R1 |
|
|
|
|
|
|
|
|
OR1 |
||||||
|
|
|
|
|
|
|
|
δ+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
Подібна реакція може відбуватися у винах при довгому зберіганні, й утворюваний напівацеталь (а потім і ацеталь) надає додаткового аромату винам, оскільки ацеталі найчастіше являють собою речовини з приємним запахом (на відміну від альдегідів).
7. Приєднання синильної кислоти. Оскільки молекула синильної кислоти розпадається на йони, то приєднання проходить у такий спосіб:
R δ+ H |
δ− |
R |
CH CN |
C |
CN |
||
Oδ− + |
|
|
|
H |
|
OH |
|
|
δ+ |
|
|
У результаті реакції утворюються нітрили спиртів.
добування альдегідів
1. Окиснення спиртів.
Загальним способом добування альдегідів є реакція окиснення спиртів купрум(ІІ) оксидом:
CH3 −CH2 −OH +CuO → CH3 −CHO +H2O +Cu.
Іноді відзначають, що в реакції окиснення спиртів мідь є каталізатором унаслідок того, що отримана мідь потім окиснюється киснем повітря й знову вступає в реакцію окиснення.
188
