
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
хімічна рівновага
Оборотні реакції
Часто напрям реакції залежить від умов її проведення. Наприклад, за звичайних умов переважно відбувається реакція:
CaO +CO2 →CaCO3.
Однак при нагріванні до високої температури, майже до тисячі градусів, починає переважати зворотна реакція розкладання кальцій карбонату:
CaCO3 →CaO +CO2.
Проте часто трапляється, що перебіг прямої
ізворотної реакцій можливий за однакових умов. Зокрема, і наведена реакція при проміжних значеннях температури може відбуватися в обох напрямках.
Реакції, які при заданих умовах відбуваються як у прямому, так і у зворотному напрямках, на зивають оборотними.
При записі рівнянь таких реакцій замість знаку рівності використовують протилежно спрямо-
вані стрілки:
CaCO3 Ca +CO2 .
Воборотних реакціях співвідношення кількостей реагентів і продуктів залежить від швидкостей прямої і зворотної реакцій. Якщо швидкість прямої реакції перевищує швидкість зворотної, то в одиницю часу утвориться більше продуктів,
іреакція в основному йде зліва направо; якщо ж більша швидкість зворотної реакції, то утворяться головним чином вихідні речовини, і реакція протікає справа наліво.
Оборотні процеси дуже поширені. До них відносяться дисоціація води і слабких кислот, взаємодія водню із бромом, йодом і азотом.
хімічна рівновага
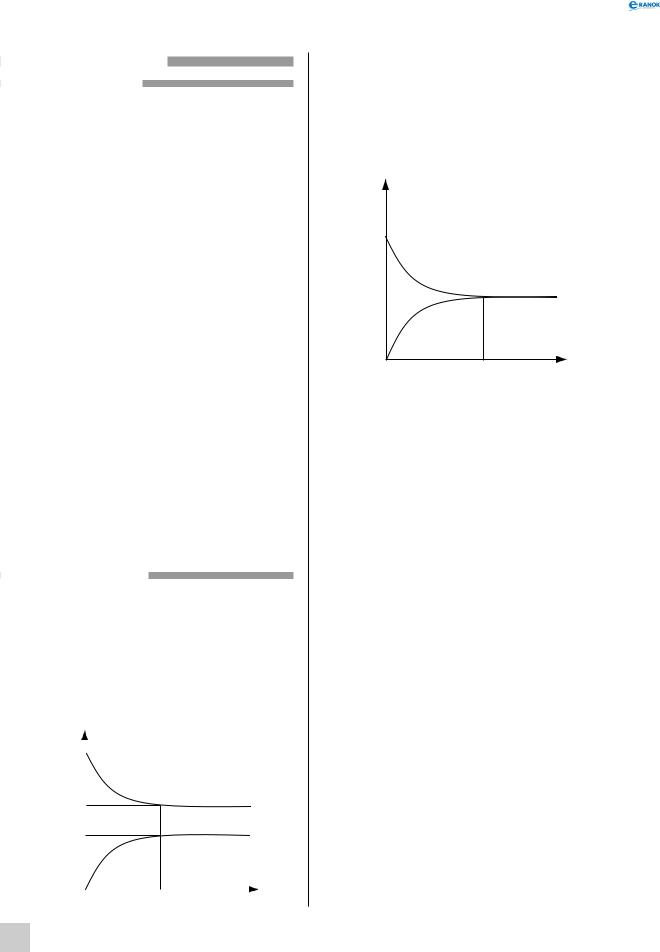
Оборотні реакції ніколи не відбуваються до кінця. Розглянемо взаємодію водню з йодом з утворенням йодоводню. Нехай у початковий момент часу в посудині перебувають лише реагенти — водень та йод — і концентрації їх максимальні. Молекули H2 і I2 починають взаємодіяти одна з одною — відбувається пряма реакція. Швидкість цієї реакції в початковий момент часу є максимальною і зменшується в міру того, як вихідні речовини витрачаються:
Концентрація |
C0(H2) |
|
Cрівн (H2) |
|
|
||||
|
|
|
|
|
|
|
|
Cрівн (HІ) |
|
|
C0(HI)0 |
|
|
|
|
t |
Час |
||
|
|
рівн |
|
|
І навпаки, зворотна реакція в початковий момент часу взагалі не відбувається, а зі зростанням концентрації продукту реакції — йодоводню — її швидкість збільшується. Нарешті, в якийсь момент часу швидкості прямої і зворотної реакцій стають рівними, а концентрації реагентів і продукту реакції перестають змінюватися із часом (такі концентрації називають рівноважними). Наступає хімічна рівновага.
реакції |
|
2 |
|
|
|
|
→ |
НІ |
|
Швидкість |
Н |
|
|
|
|
+ |
|
|
|
|
2 |
|
|
|
|
І |
|
|
|
|
2 |
|
|
|
|
|
|
→ |
2НІ |
|
|
|
Н2+ І ← |
|
|
|
|
І2 |
|
|
|
|
+ |
|
|
|
Н |
|
|
|
|
|
2 |
|
|
НІ |
→ |
|
|
|
|
|
|
|
|
2 |
|
|
|
0tрівн Час
Хімічна рівновага — стан, при якому кіль кості всіх речовин, що беруть участь в оборотній реакції, не змінюються з часом.
У стані рівноваги виникає помилкове враження, начебто в системі нічого не відбувається. Насправді і пряма і зворотна реакції відбуваються одночасно і з однаковими швидкостями: скільки продуктів утворюється в одиницю часу в результаті прямої реакції, стільки ж і витрачається
узворотній. Хімічна рівновага має динамічний характер.
Динамічний характер рівноваги вам може проілюструвати простий приклад. Уявіть собі ріку, по якій проти течії пливе човен. Якщо швидкість човна дорівнює швидкості течії, виникає оманне відчуття, що човен не рухається — його положення щодо берегів буде незмінним.
Склад рівноважної суміші може бути різним залежно від умов. Якщо в суміші більше продуктів, ніж реагентів, то говорять, що рівновага зсунута вправо, у бік продуктів реакції. Якщо ж
усуміші переважають реагенти, то вважають, що рівновага зсунута вліво.
Положення рівноваги не залежить від того, з якого боку до нього наближатися: з боку реагентів чи з боку продуктів реакції. Наприклад,
рівноважнасуміш,отримананагріваннямйодоводню до 450 °С, містить 76% йодоводню за об’ємом. Якщо ж до цієї температури нагріти суміш рівних кількостей водню і йоду, то в рівноважній суміші знову буде 76% йодоводню. Про це свідчить за кон діючиx мас, згідно з яким відношення добутку рівноважних концентрацій продуктів реакцій до добутку концентрацій реагентів у ступені їх стехіометричних коефіцієнтів є постійним і не за-
лежить від концентрації речовин. Це відношення
74

називають константою хімічної рівноваги. Так, наприклад, для рівноваги синтезу йодоводню математичний вираз для константи рівноваги виявляється наступним:
[HI]2
K = [H2 ][I2 ] ,
де квадратними дужками позначаються рівноважні концентрації відповідних речовин.
вплив концентрації речовин на хімічну рівновагу
Багато промислово важливих реакцій є оборотними. Щоб домагатися високого виходу продуктів, потрібно навчитися управляти рівновагою, зсуваючи її в ту або іншу сторону. Оскільки положення рівноваги визначається швидкостями прямої і зворотної реакцій, то воно залежить від тих самих факторів, що і швидкість, тобто від концентрації речовин і температури. Також на положення рівноваги в реакціях з участю газуватих речовин може впливати і тиск.
Розглянемо суміш, отриману при нагріванні водню і парів йоду до певної температури. За певних умов між воднем, йодом і йодоводнем встановлюється рівновага:
H2 (г) +І2 (г) 2НІ(г) −52 кДж.
У стані рівноваги швидкості прямої і зворотної реакцій рівні. Якщо в рівноважну суміш додати водень, то швидкість прямої реакції збільшиться, рівновага порушиться і зсунеться вправо. При цьому кількість йодоводню буде зростати доти, доки швидкість його розкладання знову не стане дорівнювати швидкості його утворення, тобто поки не буде досягнуто нового стану рівноваги. Іншими словами, додавання вихідної речовини до рівноважної суміші зсуває рівновагу вправо, тобто у бік продуктів реакції. Навпаки, додавання продукту прискорює зворотну реакцію і зсуває хімічну рівновагу вліво, тобто у бік реагентів.
Вірним є також і зворотне твердження: видалення одного з продуктів реакції зі сфери реакції зсуває рівновагу у бік продуктів, що в підсумку робить процес необоротним. Caме тому виділення речовин з розчину у вигляді осаду або газу є умовою необоротності реакцій йонного обміну.
Цей висновок є окремим випадком загального принципу зсуву рівноваги, що був сформульований французьким фізикохіміком Анрі Ле Шательє:
Якщо на рівноважну систему зробити зов нішній вплив, то рівновага зсувається у бік ослаб лення цього впливу.
вплив температури середовища на хімічну рівновагу
Відповідно до принципу Ле Шательє, збільшення температури зсуває рівновагу у бік охолодження, тобто підсилює ту реакцію, при якій
теплота поглинається. Якщо пряма реакція екзотермічна (Q >0), то при нагріванні рівновага зсувається вліво (у бік реагентів), а якщо пряма реакція ендотермічна (Q <0), то рівновага зсувається вправо (у бік продуктів). Зменшення температури зсуває рівновагу у бік нагрівання, тобто в напрямку екзотермічної реакції.
Реакція розкладання кальцій карбонату є ендотермічною реакцією:
СаСО3 (тв) СаО(тв) +СО2 (г) −Q. Добування кальцій оксиду (негашеного вапна)
звапняку є поширеною реакцією в промисловості, оскільки негашене вапно є важливою сировиною для виготовлення будівельних матеріалів. Оскільки теплота в результаті цієї реакції поглинається, то для зсуву рівноваги у бік продуктів необхідно температуру підвищувати. Тому розкладання вапняку проводять за високої температури.
Зверніть увагу на те, що вираз «зсув рівноваги у бік тієї або іншої реакції» означає збільшення концентрації продуктів цієї реакції в порівнянні
зпопереднім станом рівноваги.
вплив тиску на хімічну рівновагу
Тиск викликає зсув рівноваги тільки в реакціях за участю газуватих речовин і в результаті яких змінюється загальне число молекул газуватих речовин. Збільшення тиску зсуває рівновагу у бік зменшення числа молекул газів, тобто для зменшення тиску в рівноважній системі, а зменшення тиску зсуває рівновагу у бік збільшення числа молекул газів.
Наприклад, в рівнянні реакції синтезу амоніаку число молекул газуватих речовин зменшується (з 4 до 2), тобто в прямій реакції зменшується і тиск в системі:
N (г) +3Н (г) 2NH (г) .
2 2 3
4 молекули газів |
2 молекули газів |
Збільшення тиску зсуває рівновагу у бік зменшення числа молекул газів, тому при підвищенні тиску рівновага зсувається у бік продукту реакції — амоніаку, тому синтез цієї речовини проводять під дуже високим тиском.
Розкладання карбонатної кислоти, навпаки, відбувається зі збільшенням числа молекул газуватих речовин:
Н СО (розч) Н О(р) +СО (г).
2 3 2 2
0 молекул газу |
1 молекула газу |
Caме тому при відкриванні пляшки з газованою водою (розчином карбонатної кислоти) тиск всередині пляшки зменшується і це сприяє прямій реакції, в ході якої тиск має збільшитися завдяки виділенню вуглекислого газу. Для приготування газованої води, тобто для отримання розчину карбонатної кислоти, необхідно спрямувати реакцію у зворотний бік. У цій реакції зсув рівноваги у бік карбонатної кислоти відбувається за підвищеного тиску.
75
