
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
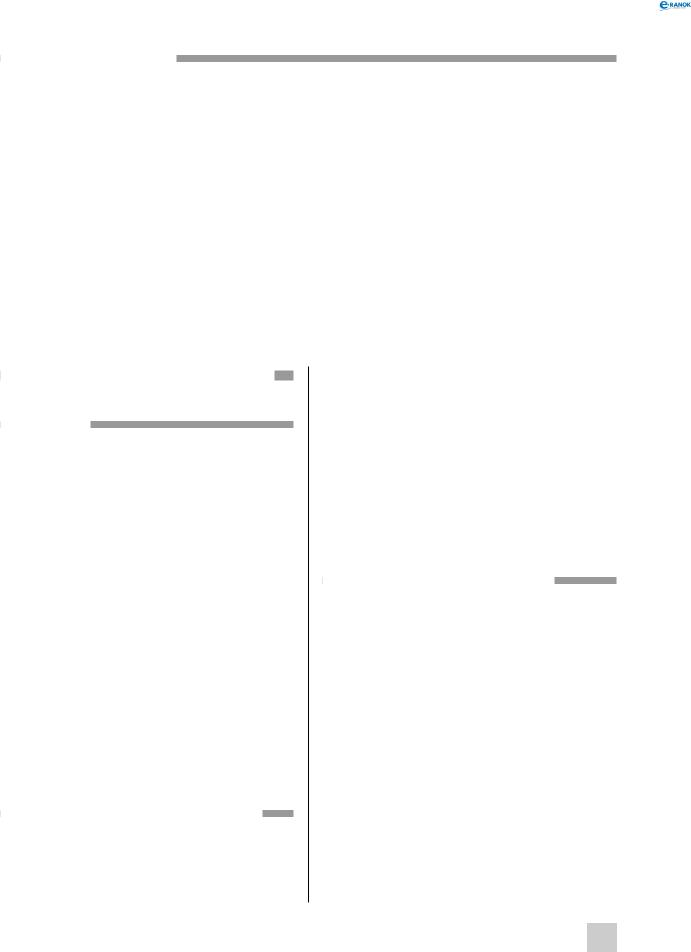
класифікація солей
солі |
кислі |
середні |
Основні |
|
|
|
|
|
|
Ознака |
|
Продукт неповного заміщен- |
Складаються тільки з ато- |
Продукт неповного заміщен- |
|
|
ня атомів Гідрогену в кислоті |
мів металічного елемента |
ня гідроксигруп основ на кис- |
|
|
атомом металічного елемента |
та кислотних залишків |
лотний залишок |
Якими речо- |
Утворюються тільки багатоос- |
Утворюються будь-якими |
Утворюються тільки багато- |
|
винами |
ут- |
новними кислотами |
кислотою та основою |
кислотними основами, не ут- |
ворюються |
|
|
ворюються лугами |
|
Приклади |
Натрій гідрогенсульфат |
Натрій сульфат Na2SO4 ; |
Купрум(ІІ) гідроксохлорид |
|
й назви |
|
NaHSO4 ; |
Калій фосфат K3PO4 |
Cu(OH)Cl; |
|
|
Калій дигідрогенфосфат |
Кальцій гідроксофосфат |
|
|
|
KH2PO4 |
|
Ca5 (PO4 )3 (OH) |
Основні спо- |
Взаємодія основ з кислотами: |
Взаємодія основ з кисло- |
Взаємодія основ з кислотами: |
|
соби |
добу- |
KOH +H3PO4 → KH2PO4 +H2O |
тами: |
Cu(OH)2 +HCl → |
вання |
|
Взаємодія солей з кислотами: |
3КОН + Н3РО4 → К3РО4 + |
→ Cu(OH)Cl +H2O |
|
|
Na2SO4 +H2SO4 →2NaHSO4 |
+ 3Н2О |
Взаємодія солей з лугами: |
|
|
|
|
Fe2 (SO4 )3 +2KOH → |
|
|
|
|
→2Fe(OH)SO4 +K2SO4 |
|
|
|
|
|
витискувальний ряд металів
поняття про витискувальний ряд металів
У багатьох хімічних реакціях беруть участь прості речовини, зокрема метали. Однак різні метали проявляють різну активність у хімічних взаємодіях, і від цього залежить, буде протікати реакція чи ні.
Чим більша активність металу, тим енергійніше він реагує з іншими речовинами. За активністю всі метали можна розташувати в ряд, який називають
рядом активності металів, або витискувальним ря дом металів, або рядом напруг металів, а також електрохімічним рядом напруг металів. Цей ряд уперше дослідив видатний український учений М.М. Бекетов, тому цей ряд називають також рядом Бекетова.
Ряд активності металів Бекетова має такий вигляд (наведені найбільш уживані метали):
K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb >
>H2 > Cu > Hg > Ag > Au.
У цьому ряді метали розташовані за зменшенням їхньої активності. Серед наведених металів найбільш активний калій, а найменш активний — золото. За допомогою цього ряду можна визначити, який метал активніший від іншого. Також у цьому ряді присутній водень. Звісно ж, водень не є металом, але в цьому ряді його активність прийнята за точку відліку (своєрідний нуль).
взаємодія металів з кислотами
Чимало металів доволі активно реагують із кислотами. У багатьох випадках атоми металічних елементів заміщають атоми Гідрогену з кислот. При цьому утворюються водень та сіль відповідної кислоти:
Mg +2HCl → MgCl2 +H2 ;
Zn +H2SO4 →ZnSO4 +H2 .
Чим лівіше розташований метал у ряді активності, тим активніше він взаємодіє з кислотами. Найбільш інтенсивно витісняють водень ті метали, які розташовані на самому початку ряду. Приміром, магній взаємодіє дуже бурхливо (рідина начебто закипає), залізо взаємодіє значно спокійніше, свинець реагує зовсім повільно (пухирці водню ледь утворюються), а мідь зовсім не реагує з кислотою. Якщо метал стоїть у ряді активності після водню, то він не здатний витісняти водень із розчинів кислот і тому з ними не реагує.
взаємодія металів з водою
Метали здатні витісняти водень не тільки з розчинів кислот, але й з води. Так само, як і з кислотами, активність взаємодії металів з водою збільшується зліва направо.
Метали, які стоять у ряді активності до магнію, здатні реагувати з водою за звичайних умов. При взаємодії цих металів утворюються луги й водень, наприклад:
2Na +2H2O →2NaOH +H2 ;
Ca +2H2O → Ca(OH)2 +H2 .
Інші метали, які стоять до водню в ряді активностей, також можуть взаємодіяти з водою, але це відбувається в більш жорстких умовах. Для взаємодії через розжарені металічні ошурки пропускають перегріту водяну пару. У таких умовах гідроксиди вже існувати не можуть, тому продуктами реакції є оксид відповідного металічного елемента й водень:
2Fe +3H2O t→Fe2O3 +3H2 ; Pb +H2O t→PbO +H2 .
101
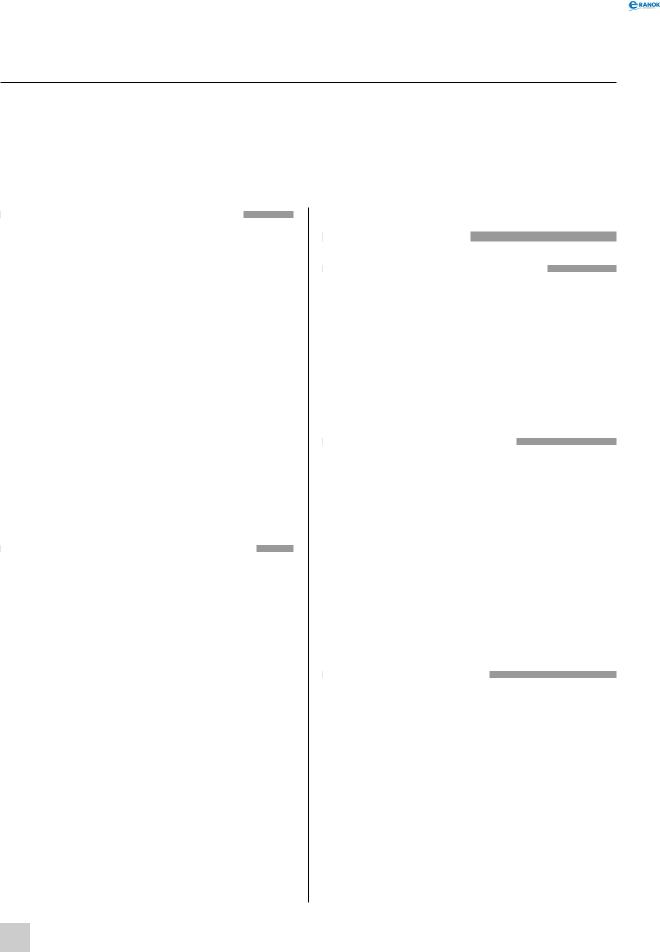
Залежність хімічних властивостей металів від місця в ряді активності
K |
|
Ca |
Na |
|
Mg |
Al |
|
Zn |
|
Fe |
|
Ni |
Sn |
Pb |
|
H2 |
Cu |
Hg |
Ag |
Au |
|
|
|
|
|
|
|
← активність металів збільшується |
|
|
|
|
|
||||||||
|
|
|
|
Витісняють водень із кислот |
|
|
|
|
Не витісняють водень із |
|||||||||||
|
|
|
|
|
|
|
|
|
кислот |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Витісняють водень із |
Витісняють водень із води при високій |
|
|
З водою не взаємодіють |
|||||||||||||||
|
води, утворюють луги |
|
температурі, утворюють оксиди |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
Із водного розчину солі |
|
|
|
Можна одержати витісненням більш активним металом |
|
|||||||||||||||
|
витіснити неможливо |
|
|
|
|
|
із розчину солі або з розплаву оксиду |
|
|
|||||||||||
взаємодія металів із солями
Якщо сіль розчинна у воді, то атом металічного елемента в ній може бути заміщений атомом більш активного елемента. Якщо занурити в розчин купрум(ІІ) сульфату залізну пластинку, то за якийсь час на ній виділиться мідь у вигляді червоного нальоту:
CuSO4 +Fe → FeSO4 +Cu ↓.
Але якщо в розчин купрум(ІІ) сульфату занурити срібну пластину, то ніякої реакції відбуватися не буде:
CuSO4 + Ag ≠.
Купрум можна витіснити будь-яким металом, який стоїть лівіше від нього в ряді активності металів. Однак метали, які стоять на самому початку ряду,— натрій, калій тощо — для цього не придатні, тому що вони настільки активні, що будуть взаємодіяти не із сіллю, а з водою, у якій ця сіль розчинена.
Витіснення металів із солей більш активними металами дуже широко використовують у промисловості для добування металів.
взаємодія металів з оксидами
Оксиди металічних елементів також здатні взаємодіяти з металами. Більш активні метали витісняють менш активні з оксидів:
CuO +Pb t→Cu +PbO;
Fe2O3 + Al t→Fe + Al2O3.
Але, на відміну від взаємодії металів із солями, у цьому разі оксиди необхідно розплавити, щоб реакція відбулася. Для добування металу з оксиду можна використовувати будь-який метал, що розташований у ряді активності лівіше, навіть найбільш активний натрій і калій, адже в розплавленому оксиді вода не міститься.
Взаємодію металів з оксидами використовують у промисловості для добування інших металів. Найбільш практичний для цього методу метал — алюміній. Він досить широко розповсюджений у природі й дешевий у виробництві. Можна також використовувати й більш активні метали (кальцій, натрій, калій), але вони, по-перше, дорожчі від алюмінію, а по-друге, через надвисоку хімічну активність їх дуже складно зберігати на заводах. Такий спосіб добування металів з використанням алюмінію називають алюмінотермією.
амфотерні оксиди та гідроксиди
поняття про амфотерність
Іноді трапляються сполуки, які можуть проявляти і кислотні, і основні властивості.
Речовини, які можуть виявляти кислотні й основні властивості залежно від сполуки, з якою вони взаємодіють, називають амфотерними.
Амфотерність виявляють оксиди й гідроксиди деяких хімічних елементів з валентностями ІІ,
ІІІ й ІV. Найважливіші серед них — Берилій(ІІ), Цинк(ІІ), Станум(ІІ), Плюмбум(ІІ), Алюміній(ІІІ), Хром(ІІІ), Титан(ІV).
амфотерні гідроксиди
Гідроксиди елементів, які можуть утворювати амфотерні сполуки, вступають у звичайні хімічні реакції, що характерні для нерозчинних основ. Єдиною відмінністю є взаємодія з лугами, тобто реакції, в яких вони виявляють кислотні властивості.
Амфотерні гідроксиди з лугами поводяться як кислоти, тобто вступають у реакцію нейтралізації з утворенням солі та води. Для того щоб правильно записати рівняння реакції за участю амфотерних гідроксидів, слід розглядати їх як кислоти. Так, цинк гідроксид Zn(OH)2 можна записати як кислоту H2ZnО2. Ця кислота буде мати назву цинкатна, вона має двовалентний кис лотний залишок ZnО2, її солі — цинкати.
амфотерні оксиди
Так само, як і амфотерні гідроксиди, амфотерні оксиди виявляють ті ж властивості, що й звичайні основні оксиди при взаємодії з кислотними речовинами. При взаємодії з основними речовинами вони вступаютьуреакціїяккислотніоксиди,тобтовзаємодіють із основними оксидами й основами з утворенням солей. Амфотерні оксиди взаємодіють із основами та основними оксидами при сплавці, без участі води, і утворюють солі, які містять звичайний кислотний залишок, що відповідає цьому оксиду.
При сплавці цинк оксиду з натрій гідроксидом або натрій оксидом утворюється натрій цинкат, тільки в першому випадку ще утворюється вода:
ZnO +2NaOH → Na2ZnO2 +H2O;
ZnO +Na2O → Na2ZnO2 .
102
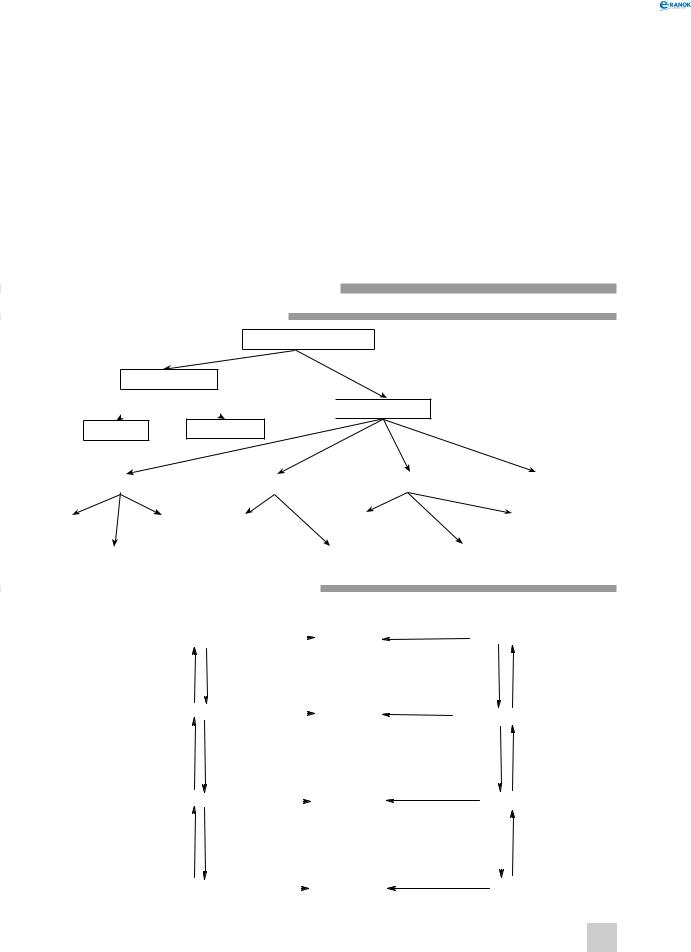
Амфотерні гідроксиди та відповідні їм кислоти й солі
амфотерний |
амфотерний гідроксид |
відповідна йому кислота |
кислотний залишок |
||||
|
|
|
|
Формула |
|
||
оксид |
Формула |
назва |
Формула |
назва |
назва |
||
й валентність |
|||||||
|
|
|
|
|
|
||
ZnО |
Zn(OH)2 |
цинк гідроксид |
H2ZnО2 |
Цинкатна |
II |
цинкат |
|
ZnO2 |
|||||||
|
|
|
|
|
|
||
SnО |
Sn(OH)2 |
станум(ІІ) гідроксид |
H2SnО2 |
Станатна |
II |
станат |
|
SnO2 |
|||||||
|
|
|
|
|
|
||
PbО |
Pb(OH)2 |
плюмбум(ІІ) гідроксид |
H2PbО2 |
Плюмбатна |
II |
плюмбат |
|
PbO2 |
|||||||
|
|
|
|
|
|
||
Al2O3 |
Al(OH)3 |
алюміній гідроксид |
H3AlО3 |
Алюмінатна |
III |
алюмінат |
|
AlO3 |
|||||||
|
|
|
|
|
|
||
генетичний зв’язок між класами неорганічних сполук
класифікація неорганічних речовин
Неорганічні речовини
Прості
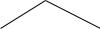
 Складні Метали Неметали
Складні Метали Неметали
|
|
|
Оксиди |
|
|
|
|
|
|
|
|
|
Кислоти |
|
|
|
|
Основи |
|
|
|
|
Солі |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Кислотні |
|
|
Основні |
|
Оксигеновмісні |
|
|
|
|
|
|
Розчинні (луги) |
|
|
|
Нерозчинні |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Амфотерні |
|
|
|
|
|
|
|
|
Безоксигенові |
|
|
Амфотерні |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
генетичний зв’язок між класами сполук |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Хімічні елементи |
|
|
|
Металічні |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Неметалічні |
||||||||||||||
Прості речовини |
|
|
|
Метали |
|
|
|
|
|
|
|
|
|
|
|
Солі |
|
|
|
|
Неметали |
|||||||||||||
|
|
|
|
+Неметал |
|
|
+Метал |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(бінарні сполуки) |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
+H2 |
+O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ O2 |
t° |
|||||||
Бінарні сполуки–- |
Основні оксиди |
|
|
|
|
|
|
|
|
Солі |
Основний Кислотні оксиди |
|||||||||||||||||||||||
|
|
- оксиди |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
Кислотний |
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
оксид |
|
|
|
|
+оксид |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
t° |
+H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
t° |
|||||||||
Гідрати оксидів |
|
|
|
Основи |
|
|
|
|
|
|
|
|
|
|
Солі |
Основний |
|
Кислоти |
||||||||||||||||
|
|
|
|
|
Кислотний |
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
оксид |
|
|
|
|
+ оксид |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
+Луг |
+Кислота |
|
|
|
|
|
|
+Основи |
+Кислота |
||||||||||||||||
Солі |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
Солі |
|
|
|
|
|
|
|
|
|
|
|
Солі |
|
|
|
|
|
Солі |
|||||||||||||
|
|
|
|
+Сіль |
|
|
+Сіль |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
103
