
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів

утворюється суміш продуктів від монодо полігалогензаміщених алканів. Загальна схема цієї реакції показана на прикладі метану:
CH4 +Cl2 → CH3Cl +HCl,
CH3Cl +Cl2 → CH2Cl2 +HCl,
CH2Cl2 +Cl2 → CHCl3 +HCl,
CHCl3 +Cl2 → CCl4 +HCl.
2. Нітрування (реакція Коновалова). Під час дії нітратної кислоти на алкани при температурі +140 °С та невеликому тиску протікає радикальна реакція:
CH3 −CH3 +HNO3 → CH3 −CH2 −NO2 +H2O. 3. Ізомеризація. Нормальні алкани за певних
умов можуть перетворюватися в алкани з розгалуженим ланцюгом:
CH3 |
CH2 |
CH2 |
CH3 |
Al Cl3 |
, t° |
|||||
|
|
CH3 |
|
CH |
|
CH3 |
||||
|
|
|
|
|||||||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
CH3 |
|||
4. Крекінг — |
це гомолітичний розрив |
|||||||||
зв’язків C −C, що протікає при нагріванні й під дією каталізаторів. При крекінгу алканів утворюються алкени й нижчі алкани, при крекінгу метану й етану утворюється ацетилен:
C8H18 → C4H10 +C4H8,
2CH4 → C2H2 +3H2 ,
C2H6 → C2H2 +2H2.
Ці реакції мають велике промислове значення. Таким шляхом висококиплячі фракції нафти (мазут) перетворюють у бензин, гас та інші цінні продукти.
5. Окиснення. При м’якому окисненні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
CH4 +O2 → CH3OH,
CH4 +O2 → CH2O,
CH4 +O2 → HCOOH.
М’яке каталітичне окиснення бутану киснем повітря — один із промислових способів добування оцтової кислоти:
2C4H10 +5O2 →4CH3COOH +2H2O.
На повітрі алкани згорають до CO2 та H2O:
|
|
(3n+1) |
|
= nCO2 +(n+1)H2O. |
||
CnH2n+ 2 |
+ |
|
|
O2 |
||
2 |
||||||
|
|
|
|
|
||
методи добування алканів
Основні природні джерела алканів — нафта й природний газ. Різні фракції нафти містять алкани від C5H12 до C30H62 . Природний газ складається з метану (95%) з домішкою етану та пропану.
Із синтетичних методів добування алканів можна виділити наступні:
1. Добування з ненасичених вуглеводнів.
Взаємодія алкенів або алкінів з воднем («гідрування») відбувається в присутності металевих каталізаторів (Ni, Pd) при нагріванні:
CH3 −CH = CH2 +H2 → CH3 −CH2 −CH3
CH3 −C ≡ CH +2H2 → CH3 −CH2 −CH3 .
2. Добування з галогенопохідних. При нагрі-
ванні моногалогенозаміщених алканів з металевим натрієм добувають алкани з подвійним числом атомів Карбону (реакція Вюрца):
C2H5Br +2Na +Br −C2H5 → C2H5 −C2H5 +2NaBr.
Подібну реакцію зазвичай не проводять із двома різними галогенозаміщеними, оскільки при цьому виходить суміш трьох різних алканів.
3. Добування із солей карбонових кислот.
При сплавлянні безводних солей карбонових кислот з лугами добувають алкани, що містять на 1 атом Карбону менше порівняно з карбоновим ланцюгом вихідних карбонових кислот:
CH3COONa +NaOH →CH4 ↑ + Na2CO3 .
4. Добування метану. В електричній дузі, що горить в атмосфері водню, утворюється значна кількість метану:
C +2H2 → CH4 .
Така сама реакція відбувається при нагріванні вуглецюватмосферіводнюпритемпературі+400— 500 °С при підвищеному тиску в присутності каталізатора.
5. У лабораторних умовах метан часто добувають із алюміній карбіду:
Al4C3 +12H2O =3CH4 ↑ + 4Al(OH)3.
алкени
гомологічний ряд алкенів
Алкенами називають ненасичені вуглеводні, молекули яких містять один подвійний зв’язок. Перший представник цього класу етилен CH2 = CH2, у зв’язку із чим алкени також називають етиленовими вуглеводнями. Найближчі гомо-
логи етилену: |
|
CH3 −CH = CH2 , |
CH3 −CH2 −CH = CH2 , |
пропен |
бутен 1 |
CH3 −CH = CH −CH3 .
бутен 2
Найпростіший алкен з розгалуженим карбоновим ланцюгом:
CH3 C  CH2
CH2
CH3
2метилпропен
167
Загальна формула гомологічного ряду алкенів CnH2n. Вона збігається із загальною формулою циклоалканів, тому алкени й циклоалкани є міжкласовими ізомерами.
При відщепленні атома Гідрогену від молекул алкенів утворюються ненасичені радикали загальної формули CnH2n−1 , найпростіші з них — вініл (етеніл) та аліл (пропеніл):
CH2 = CH − |
CH2 = CH −CH2 − . |
вініл |
аліл |
ізомерія алкенів
Структурна ізомерія алкенів обумовлена ізомерією карбонового ланцюга (наприклад, бутен-1 і 2-метилпропен) та ізомерією положення подвійного зв’язку (бутен-1 і бутен-2).
Просторова ізомерія, або цистранс-ізомерія, обумовлена різним положенням замісників щодо площини подвійного зв’язку. Якщо кожен з атомів Карбону при зв’язку C = C пов’язаний із двома різними замісниками, то ці замісники можуть розташовуватися з одного боку від площини подвійного зв’язку (цис-ізомер) або по обидва боки
(транс-ізомер), наприклад: |
|
|
|
||
CH3 |
|
CH3 |
CH3 |
|
H |
C |
|
C |
C |
|
C |
|
|
||||
|
|
||||
H |
|
H |
H |
|
CH3 |
цис -бутен-2 |
транс-бутен-2 |
||||
Ці два ізомери не можна перевести один в одного без обертання навколо подвійного зв’язку C = C, а це обертання вимагає його розриву й витрати великої кількості енергії, тому цис- і транс-ізомери являють собою різні індивідуальні речовини, які відрізняються одна від одної фізичними й хімічними властивостями. Алкени, в яких хоча б один з атомів Карбону при зв’язку C = C має два однакових замісники, не мають цистранс-ізомерів.
номенклатура алкенів
У алкенах з нерозгалуженим карбоновим ланцюгом нумерацію атомів Карбону починають із того кінця, до якого ближче перебуває подвійний зв’язок. У назві відповідного алкану закінчення -ан замінюється на -ін (ин). У розгалужених алкенах головний ланцюг вибирають так, щоб він містив подвійний зв’язок, навіть якщо він при цьому й не буде найдовшим. Перед назвою головного ланцюга вказують номер атома Карбону, при якому перебуває замісник, і назву цього замісника. Номер після назви головного ланцюга вказує положення подвійного зв’язку, наприклад:
1 |
2 |
3 |
4 |
9 |
|||||
H3C |
|
CH |
|
CH |
|
|
CH |
|
CH3 |
|
|
||||||||
|
|
|
|||||||
|
|
||||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
CH3
4метилпентен2
Будова алкенів
Атоми Карбону при подвійному зв’язку перебувають у стані sp2-гібридизації. Три σ-зв’язки, утворені гібридними орбіталями, розташовуються в одній площині під кутом 120° один щодо одного. Утворений π-зв’язок при перекриванні негібридних p-орбіталей сусідніх атомів Карбону. При цьому атомні p-орбіталі перекриваються не в міжатомному просторі, а поза ним, тому таке «бічне» перекривання менш ефективне, і, отже, π-зв’язок є менш міцним, аніж σ-зв’язок. Додаткове π-зв’язування двох атомів вуглецю призводить до того, що зменшується відстань між ядрами, оскільки подвійний зв’язок є поєднанням σ - та π-зв’язків. Довжина подвійного зв’язку C = C становить 0,133 нм, що набагато менше від довжини одинарного зв’язку (0,154 нм). Енергія подвійного зв’язку (606 кДж/моль) менша від подвійного значення енергії одинарного зв’язку (354 2 =708 кДж/моль); це обумовлено меншою енергією π-зв’язку.
Н
|
зв’язок |
|
π |
Н |
|
Н |
|
|
|
|
Н
Фізичні властивості алкенів
Фізичні властивості алкенів схожі на властивості алканів, хоча вони мають трохи нижчі температури плавлення й кипіння, ніж відповідні алкани. Наприклад, пентан має температуру кипіння +36 °С, а пентен-1 — +30 °С. За звичайних умов алкени C2 −C4 — гази, C5 −C15 — рідини, починаючи із C16 — тверді речовини. Алкени нерозчинніуводі,добрерозчиняютьсяворганічних розчинниках.
добування алкенів
У природі алкени зустрічаються рідко. Зважаючи на те, що алкени є цінною сировиною для промислового органічного синтезу, на сьогодні розроблено багато способів їхнього добування.
1.Основним промисловим джерелом алкенів
єкрекінг алканів, які входять до складу нафти:
C8H18 → C4H10 +C4H8.
168

Крекінг протікає за вільнорадикальним механізмом при високих температурах
(+400—700 °С).
2. Інший промисловий спосіб добування алкенів — дегідрування алканів:
CH3 −CH2 −CH3 Cr2O3 , t→CH3 −CH = CH2 +H2 .
У лабораторних умовах алкени добувають за реакціями відщеплення (елімінування), при яких від сусідніх атомів Карбону відщеплюються два атоми або дві групи атомів, і утворюється додатковий зв’язок. До таких реакцій належать наступні:
а) Дегідратація спиртів відбувається при їхньому нагріванні з водовідіймальними засобами, наприклад із сульфатною кислотою при температурі понад +150 °С:
CH3 −CH2 −OH → CH2 = CH2 +H2O.
б) Відщеплення галогеноводнів проводять при дії розчинів лугів на моноалкілгалогеніди: CH3 −CH2 −CHBr −CH3 +KOH(спирт. розчин) →
→CH3 −CH = CH −CH3 + KBr +H2O.
При відщепленні H2O від спиртів, HBr та HCl від алкілгалогенідів атом Гідрогену переважно відщеплюється від того із сусідніх атомів Карбону, який зв’язаний з найменшим числом атомів Гідрогену (від менш гідрогенізованого атома Карбону). Ця закономірність має назву правила Зайцева.
3. Дегалогенування відбувається при нагріванні дигалогеналканів, які мають атоми галогену в сусідніх атомів Карбону, з активними двовалентними металами:
CH2Br −CHBr −CH3 +Mg →
→ CH2 = CH −CH3 +MgBr2 .
хімічні властивості алкенів
Хімічні властивості алкенів визначаються наявністю в їхній молекулі подвійного зв’язку. При приєднанні полярних молекул типу HX (X: Hal, OH, CN) до несиметричних алкенів Гідроген переважно приєднується до більш гідрогенізованого атома Карбону, що примикає до подвійного зв’язку (правило Марковникова).
1.Гідрогалогенування. При взаємодії алкенів
згалогеноводнями (HCl, HBr) утворюються гало-
геналкани:
CH3 −CH = CH2 +HBr → CH3 −CHBr −CH3.
Продукти реакції визначаються правилом Марковникова.
Слід, однак, підкреслити, що в присутності якого-небудь неорганічного пероксиду полярні молекули НХ реагують із алкенами не за правилом Марковникова:
CH3 −CH = CH2 +HBr H2O2→CH3 −CH2 −CH2Br .
Це пов’язано з тим, що присутність пероксиду обумовлює радикальний, а не йонний механізм реакції.
2.Гідратація. При взаємодії алкенів з водою
вприсутності мінеральних кислот (сульфатної, фосфатної) утворюються спирти. Мінеральні кислоти виконують роль каталізаторів і є джерелом протонів. Приєднання води також відбувається за правилом Марковникова:
CH3 −CH = CH2 +HOH → CH3 −CH(OH) −CH3 . 3. Галогенування. Алкени знебарвлюють
бромну воду:
CH2 = CH2 +Br2 → BrCH2 −CH2Br.
Ця реакція є якісною на подвійний зв’язок. 4. Гідрування. Приєднання водню
відбувається під дією металевих каталізаторів, найчастіше нікелю:
CH3 −CH = CH2 +H2 Ni→CH3 −CH2 −CH3. 5. Полімеризація алкенів та їхніх похідних:
nCH2 = CHR →(−CH2 −CHR −)n ,
де R = H, CH3, Cl, C2H5 тощо. Молекула CH2 = CHR
називається мономером, отримана сполука — полімером, число n — ступенем полімеризації. Назва полімерів утворена від назви мономерів додаванням префікса полі. Так, з етилену добувають поліетилен, із пропілену — поліпропілен, із хлоретену (вінілхлориду) — полівінілхлорид (ПВХ) тощо.
6. Окрім приєднання, для алкенів характерні також реакції окиснення. При м’якому окисненні алкенів водним розчином калій перманганату (реакція Вагнера) утворюються двохатомні спирти:
3CH2 = CH2 +2KMnO4 +4H2O →
→3HOCH2 −CH2OH +2MnO2 ↓ +2KOH.
Урезультаті протікання цієї реакції фіолето-
вий розчин калій перманганату швидко знебарвлюється й випадає коричневий осад манган(IV) оксиду. Ця реакція, як і реакція знебарвлення бромної води, є якісною на подвійний зв’язок. При твердому окисненні алкенів киплячим розчином калій перманганату в кислому середовищі відбувається повний розрив подвійного зв’язку з утворенням кетонів, карбонових кислот або CO2 , наприклад:
CH3 −CH = CH −CH3 [O]→2CH3 −COOH.
7.Як і всі інші вуглеводні, алкени горять
іпри широкому доступі кисню утворюють карбон діоксид та воду:
|
|
3n |
|
|
|
CnH2n |
+ |
|
|
O2 |
→nCO2 ↑ +nH2O. |
|
|||||
|
|
2 |
|
|
|
При обмеженому доступі повітря горіння алкенів може призводити до утворення карбон монооксиду та води:
CnH2n +nO2 →nCO ↑ +nH2O.
Якщо змішати алкен з киснем і пропустити цю суміш над нагрітим до +200 °С срібним каталізатором, то утворюється алкен оксид (епоксиалкан), наприклад:
|
|
|
|
O |
|
|
CH2 = CH2 + |
1 |
O2 |
→ H C |
|
CH |
|
|
|
2 |
||||
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
169
поняття про полімери
реакція полімеризації
Для етиленових вуглеводнів характерний ще один тип хімічних реакцій: під дією спеціальних каталізаторів молекули етиленових вуглеводнів можуть з’єднуватися один з одним, утворюючи довгий карбоновий ланцюг:
...СН2=СН2 + СН2=СН2 + СН2=СН2 +СН2=СН2 + + СН2=СН2 + ... →
→...СН2—СН2—СН2—СН2—СН2—СН2—СН2—СН2—СН2—СН2
Реакції такого типу називають реакціями полімеризації. Продукти реакції полімеризації називають полімерами (від грецького «полімерес»
— «той, що складається з багатьох частин»), в них багато разів повторюється той самий фрагмент. За своєю суттю реакція полімеризації — це об’єднання величезної кількості молекул ненасичених вуглеводнів одна з одною.
При записуванні рівняння реакції полімеризації у формулі полімеру повторюваний фрагмент молекули беруть у квадратні дужки. Тоді рівняння полімеризації етилену можна записати так:
nCH2 = CH2 каталiзатор→ [ CH2 CH2 ]n .
етилен поліетилен
Звернітьувагунате,щоетиленіполіетиленмають однаковий якісний і кількісний склад: обидва складаються з Карбону і Гідрогену, причому в обох речовинах на один атом Карбону припадає два атоми Гідрогену. Важлива відмінність між ними полягає в тому, що в молекулі етилену є подвійний зв’язок, це ненасичений вуглеводень, а в поліетилені всі зв’язки одинарні, тому він виявляє властивості насичених вуглеводнів. Фактично, поліетилен — це алкан з високою молекулярною масою, тому хімічно він досить інертний. Поліетилен не взаємодіє ні з кислотами, ні з лугами, стійкий до дії окисників. Caме хімічною стійкістю поліетилена пояснюється його широке застосування.
Основні характеристики полімерів
Полімерами називають речовини, які складаються з великої кількості повторюваних фрагментів. Полімери дуже поширені серед органічних речовин, хоча трапляються і неорганічні полімери. Оскільки полімери складаються з великої кількості фрагментів, вони мають дуже високі молекулярні маси. Тому інша назва полімерів — високомолекулярні сполуки. Полімери бувають природні й синтетичні. До природних полімерів відносять білки, нуклеїнові кислоти і полісахариди. Синтетичні полімери — це продукти хімічної промисловості, багато з яких помітно полегшують наш побут. Пластикові пляшки для води, плівка, у яку загортають про-
дукти, корпуси телефонів і телевізорів, шини автомобілів — усе це зроблено з полімерів.
Вихіднуречовинудляреакціїполімеризаціїназивають мономером, продукт — полімером, фрагмент у молекулі полімеру, що повторюється,— елементарною ланкою, число n — ступенем полімеризації. Ступінь полімеризації показує число молекул мономера, що об’єдналися в молекулу полімеру. Залежно від умов він може змінюватися від тисячі до сотень тисяч.
полімер

 CH2 CH2 n
CH2 CH2 n
ступінь елементарна полімеризації ланка
У формулах полімерів не зазначено, чим закінчується карбоновий ланцюг. Зазвичай на кінцях молекули полімеру перебувають фрагменти молекул розчинника, наприклад атоми Гідрогену або гідроксогрупи. Ці частинки майже не впливають на властивості полімеру, оскільки карбоновий ланцюг дуже довгий.
Структурна ланка поліетилену —СН2—СН2— складається з двох однакових груп атомів —СН2—. Чому ж формулу поліетилену не записують у спрощеному вигляді [—СН2—]?Церобитинеприйнято, тому що формула полімеру повинна відображувати його зв’язок з вихідною речовиною — мономером, у цьому випадку — етиленом СН2=СН2.
Більшість полімерів (крім деяких біополімерів) відрізняються від низькомолекулярних речовин тим, що не мають суворо певної молекулярної маси. Так, у кожному зразку поліетилену всі молекули мають різну довжину і масу, тому коли говорять про полімери, використовують поняття середньої молекулярної маси.
різновиди і застосування полімерів
У реакцію полімеризації крім етилену вступають і різноманітні похідні етилену із загальною формулою:
CH2 CH
CH
R
де R — будь-яка група атомів. Рівняння полімеризації має вигляд:
CH2 |
|
CH |
|
|
|
|
CH2 |
CH |
|
|
n |
|
|
|
|
|
|||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
RR
Caме так добувають поліпропілен, полівінілхлорид, полістирол, органічне скло тощо. В сучасній промисловості виготовляється декілька різновидів полімерів. Вони можуть відрізнятися мономером і умовами добування. Найпоширеніші полімери наведено в таблиці:
170
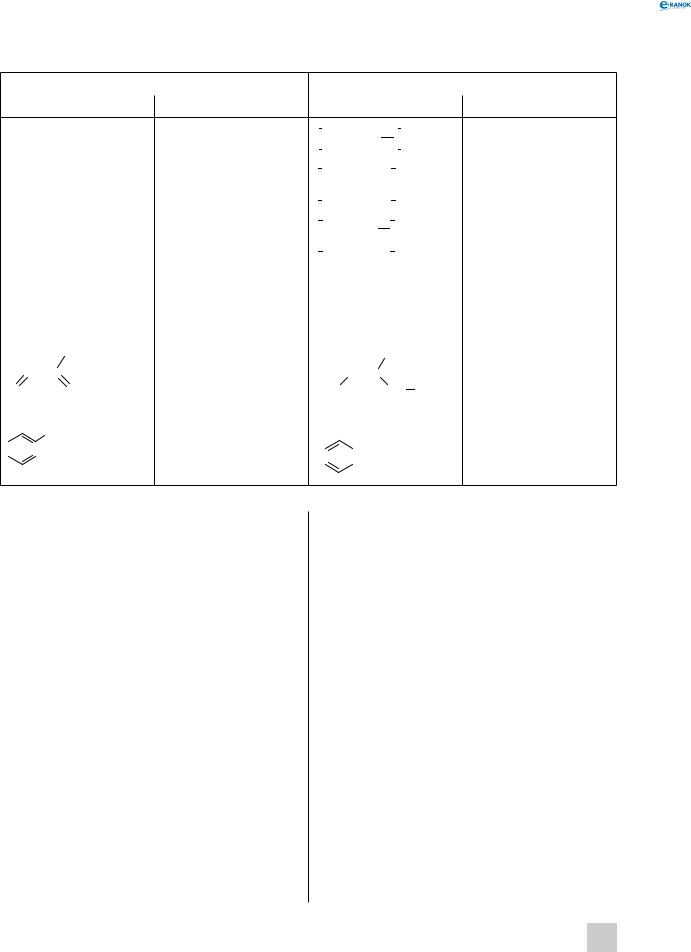
Найпоширеніші полімери
мономер |
|
|
полімер |
|
|
|
|
Формула |
назва |
Формула |
назва |
|
|
|
СН =СН |
Етилен |
|
|
|
|
|
CH2 |
|
|
|
|
|
CH2 |
|
|
|
|
|
n |
Поліетилен |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
СН2—СН=СН2 |
Пропен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поліпропілен |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
(пропілен) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
СН2=СН—Cl |
Хлоретилен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поліхлоретилен |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
(вінілхлорид) |
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
(полівінілхлорид-ПВХ) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
F |
|
|
Тетрафторетилен |
|
|
|
|
|
|
F |
|
|
|
F |
|
|
|
|
|
|
|
Поліфторетилен |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
C |
|
C |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
(тефлон) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
F |
|
F |
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
F |
|
|
|
|
n |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
Поліізопрен |
|||||
|
|
|
CH |
|
C |
|
|
Ізопрен |
|
|
|
|
|
|
CH |
|
|
C |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
(каучук) |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
CH |
|
CH |
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
CH2 |
Стірен (стірол) |
|
|
|
|
|
|
CH |
|
CH2 |
|
|
|
|
|
n |
Полістірол |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Найпоширеніший з полімерів — поліетилен. Він являє собою прозору речовину, що погано проводить тепло і електричний струм, на дотик нагадує парафін. Він досить пластичний, а при нагріванні вище за 100 °С розм’якшується. Молекулярна маса коливається від 30 тис. до 3 млн, залежновідспособудобування.Зависокоготиску (тисячі атмосфер) утворюється полімер з низькою молекулярною масою і низькою густиною. Його використовують для виробництва пакувальних матеріалів. Якщо процес полімеризації проходить за низького тиску, то утворюється поліетилен з високою молекулярною масою і високою густиною. Він міцніший і має кращі механічні властивості, ніж поліетилен з низькою молекулярною масою. З нього виготовляють труби великого діаметра, пластикові пляшки і каністри.
Чисті полімери на практиці зазвичай не використовують. На їх основі виготовляють різноманітні матеріали, які називають пластмасами. Для їх виготовлення до полімерів додають різні речовини: стабілізатори, пластифікатори, барвники, спінювачі тощо. З досить невеликого числа полімерів виготовляється величезна кількість різних пластмас.
Протягом останніх 100 років полімери
іматеріали на їх основі досить міцно увійшли в наше життя. Ними замінюють коштовніші
іменш доступні матеріали: шкіру, деревину, скло, метали тощо. Деякі з пластмас виявляють навіть більш цінні властивості, ніж матеріали, які ними замінюють. По-перше, пластмаси дешевші за природні матеріали, по-друге — вони мають невелику густину, завдяки чому вироби з них легші (порівняйте скляну або залізну пляшку з пластиковою), хімічно інертні, водота газонепроникні, не проводять електричний струм та неотруйні. Крім того, іноді трапляється, що деякі пластмаси навіть міцніші за дерево або деякі метали. Завдяки цьому пластмаси мають широке застосування в нашому житті. Практично немає галузі промисловості і техніки, де б не застосовувалися полімери.
Убільшості полімерів є істотний недолік — термічна нестійкість, горючість і крихкість, але сучасна наука не стоїть на місці. В останні роки винайшли багато нових матеріалів, і можливо, що в найближчі роки пластмаси стануть єдиним матеріалом, що людство буде використовувати, зберігаючи тим самим природні матеріали.
171
