
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів

мило
Милом є солі вищих карбонових кислот. Як
іжири, мило можна класифікувати за агрегатним станомузвичайнихумовах.Так,розрізняютьтверде мило (натрієві солі вищих карбонових кислот)
ірідке мило (калієві солі вищих карбонових кис-
лот). Відповідно, формула мила: C17H35COONa — натрій стеарат та C17H35COOK — калій стеарат.
Основний метод добування мила — гідроліз жирів. Якщо жир нагрівати з розчином соди або лугу, то виходить мило. Щоб виділити мило, у розчин додають натрій хлорид (NaCl), при цьому мило спливає наверх у вигляді щільного шару — ядра. Із цієї маси виготовляють так зване ядрове мило — звичайні сорти господарського мила:
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||
H2C |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
C17H35 |
|
|
|
|
||||||
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 3NaOH |
|
|
|
HC |
|
|
|
|
O |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
C H |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
17 |
35 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H2C |
|
|
|
|
|
|
|
C |
|
|
|
|
|
C17H35 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
OH |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
|
|
OH + 3 C17H35 |
COONa |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
H2C OH
Виробництво мила вимагає великої витрати жирів. Тим часом жири — найцінніший продукт харчування. Щоб зберегти їх, мило краще добувати з нехарчової сировини. Сьогодні такі можливості надає органічна хімія.
До складу мила входять солі вищих карбонових кислот. Зараз такі кислоти добувають у промисловості окисненням вуглеводнів, що входять до складу парафіну (нафти). Цей процес проходить у присутності кисню повітря при температурі близько +120 °С з участю каталізатора (сполуки Мангану). При цьому відбувається розрив молекул вуглеводнів та окиснення кінцевих груп у карбоксильні, наприклад:
2CH3 −(CH2 )14 −CH2 −CH2 −(CH2 )14 −CH3 +5O2 →
→4CH3 −(CH2 )14 −COOH +2H2O.
Урезультаті утворюється суміш різних кислот та інших оксигеновмісних сполук, які піддають роз’єднанню.
Нейтралізацією кислот добувають солі. Ці солі (у суміші з наповнювачем) ідуть на виробництво туалетного та господарського мила. Але мило, добуте із синтетичних кислот, аналогічне за своєю хімічною природою до звичайного мила, отже, має його недоліки: погано миє у твердій воді. Саме тому зараз розвивається виробництво мийних засобів іншого типу: це синтетичні мийні засоби (CMЗ). Один із видів CMЗ являє собою
сіль кислих естерів вищих спиртів та сульфатної кислоти:
Схема добування (у загальному вигляді): R −CH2 −OH+HO −SO3H →
спирт |
сірчана |
|
кислота |
|
→R −CH2 −O −SO3H+H2O |
|
кислий естер спирту |
|
та сірчаної кислоти |
R−CH2 −O −SO3H +NaOH →
→R −CH2 −O −SO3Na+H2O
натрієва сіль складного ефіру
Дуже розповсюдженим видом СМЗ є алкілбензосульфонати:
H3C (CH2)n CH2 
 SO3Na
SO3Na
За будовою такі солі подібні до солей, що входять до складу звичайного мила (вони, як і мило, мають поверхневу активність і гарну мийну дію). Але, на відміну від звичайного мила, такі речовини не втрачають мийних властивостей у твердій воді, тому що утворені при цьому кальцієві та магнієві солі виявляються розчинними й, отже, поверхнево-активна речовина залишається у воді, а не випадає в осад.
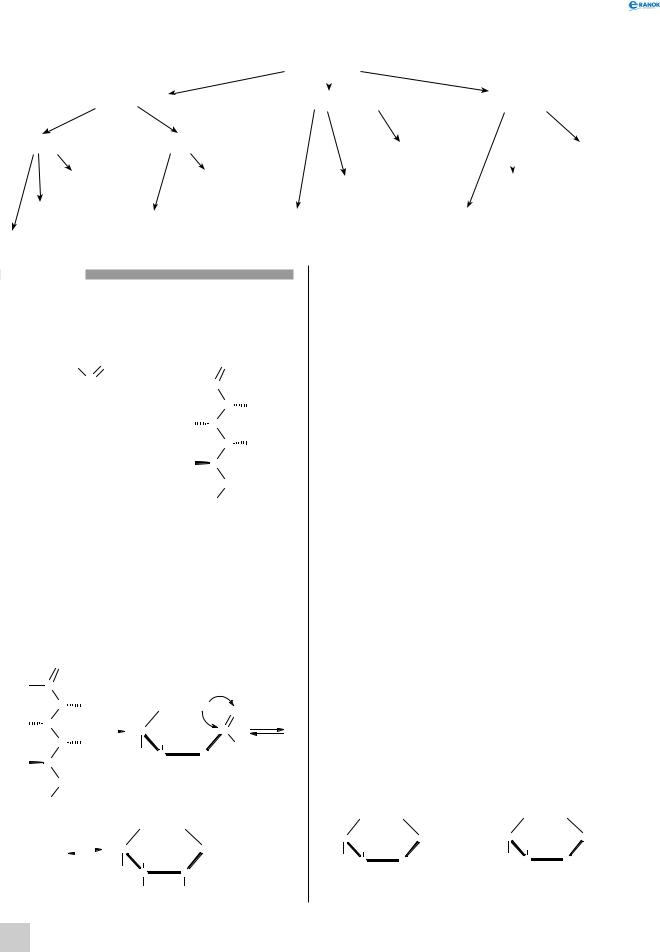
вуглевОди
поняття про вуглеводи та їхня класифікація
Загальна формула вуглеводів: Cn (H2O)m , однак це не означає, що вуглеводи складаються з вугілля та окремих молекул води. Ця формула відображає лише співвідношення атомів Карбону, Гідрогену та Оксигену в молекулах вуглеводів. І, власне, саме такому співвідношенню цей клас речовин зобов’язаний своєю назвою — (вугле)(води). Однак слід зазначити, що вчені знайшли вуглеводи, в яких не дотримується співвідношення Гідрогену та Оксигену, що існує у воді, але котрі за всіма іншими ознаками, безсумнівно, належать до цього класу. Разом з тим існують сполуки, які відповідають за складом формулі Cn (H2O)m , але за властивостями ніяк до них не приналежні, наприклад формальдегід CH2O та оцтова кислота C2H4O2. Таким чином, назва цього класу не виражає його специфіки й більшою мірою, ніж будь-яка інша, залишилася в хімії за традицією.
195
|
|
Вуглеводи |
|
|
||
Моносахариди |
|
|
|
|
||
|
|
|
|
|||
Дисахариди |
Полісахариди |
|||||
|
|
|||||
Гексози |
Пентози |
|
Сахароза |
|
Крохмаль |
|
|
|
|||||
|
|
|
|
|||
Глюкоза |
Рибоза |
|
|
|
|
|
Мальтоза |
Целюлоза |
|||||
|
|
|||||
Фруктоза |
Дезоксирибоза |
Лактоза |
Глікоген |
|||
|
||||||
Галактоза
глюкоза
Глюкоза належить до альдегідоспиртів, тобто до складу її молекули входять два типи функціональних груп: альдегідна та спиртова (гідроксильна група).
H |
1 C |
O |
|
|
|
O |
|
|||||||
|
|
|
|
|
H |
|
1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
|
|
|
|
2 |
|
||
H |
|
C |
|
|
OH |
|
|
|
C |
OH |
||||
|
|
|
|
|
||||||||||
|
|
3 |
|
|
|
|
|
|
або |
HO |
3C |
|
||
HO |
|
C |
|
|
H |
|
||||||||
|
|
|
|
|
|
|
|
C4 |
OH |
|||||
H |
4 |
|
|
|
|
|
|
OH |
|
|
|
|||
C |
|
|
HO |
5 |
|
|||||||||
|
|
|
|
|||||||||||
|
|
5 |
|
|
|
|
|
|
|
C |
|
|||
H |
C |
|
|
OH |
|
|
6 |
|
||||||
|
|
|
6 |
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
CH2OH |
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
HO |
|
|||||||
Однак у розчині глюкози не всі молекули перебувають у такому вигляді (у лінійній формі). Більшість молекул піддаються реакції циклізації й переважно перебувають у циклічній формі. Унаслідок обертання атомів навколо C −C зв’язків молекула глюкози може набувати різної форми, зокрема й кільцеподібної. При такому положенні в молекулі відбувається перегрупування атомів — ізомеризація, у результаті чого
відкрита форма перетворюється в циклічну:
O
H |
1C |
|
|
|
|
|
|
|
|
|
6 |
CH2OH |
|
|
|||||||||
|
|
C2 |
OH |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
H 5C |
|
|
|
|
OH |
|
O |
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
HO |
3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
4C H |
|
|
|
|
|
C |
|
||||||||||
|
4 |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|||||||||
|
|
C |
OH |
|
|
|
|
OH |
|
|
|
1 |
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
OH C |
|
|
|
|
|
|
|
||||||
|
5 |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
||||||||
HO |
|
C |
|
|
|
|
|
|
|
3 |
|
|
|
|
2 |
OH |
|
|
|||||
|
6 |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||||
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
HO |
|
|
|
|
|
|
6 |
|
CH2OH |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
H 5C |
|
|
|
|
OH |
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4C |
|
H |
H |
|
C1 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
OH C |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
C |
|
H |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
2 |
|
|
|
|
|
|
|
HOH
При збереженні валентних кутів альдегідна група найближче підходить до п’ятого атома Карбону, відбувається перегрупування за рахунок розриву подвійного зв’язку в карбонільній групі. Аналогічно до процесу приєднання води (і спирту) до альдегідів. До атома Карбону, який має частковий позитивний заряд, приєднується за допомогою вільної електронної пари атом Оксигену гідроксильної групи, а йон Гідрогену приєднується до карбонільного атома Оксигену за рахунок електронної пари π -зв’язку, що перейшла до нього. Утворюється шестичленний цикл, який не містить альдегідної групи, одним з ланок якого виявляється атом Оксигену.
Циклічні молекули, у свою чергу, можуть знову перетворюватися на відкриті й такі, що містять альдегідну групу. Такий двосторонній процес у розчині йде безперервно. Між ізомерами встановлюється рухлива рівновага. Однак вона сильно зміщена в бік утворення циклічних молекул.
У процесі замикання кільця альдегідна група може орієнтуватися по-різному. Внаслідок цього вона може утворювати дві циклічні форми глюкози: α і β . Вище наведена циклічна β -форма глюкози.
Можливість утворення двох форм глюкози обумовлюється вільним обертанням карбонільного атома Карбону й, отже, всієї альдегідної групи навколо зв’язку C1 −C2 . Якщо «перескок» атома Гідрогену відбудеться тоді, коли карбонільний Оксиген виявиться зверху, гідроксильна група утворюється над кільцем молекули, як у β -глю- козі, якщо ж карбонільний Оксиген при обертанні атома Карбону піде вниз, гідроксильна група буде розташована під площиною кільця, як в α -глюкозі:
|
|
6 CH OH |
|
|
|
|
6 |
CH OH |
|
|
|||||||
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
||
H 5C |
|
O |
H |
H 5C |
|
O |
OH |
||||||||||
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||||
|
|
H |
|
|
|
|
4C |
|
|
C1 |
|||||||
4C |
|
|
C1 |
H |
|||||||||||||
OH |
H |
|
|
OH |
|
|
|||||||||||
OH C |
|
|
|
|
OH C |
|
|
|
|
||||||||
C |
OH |
C |
H |
||||||||||||||
|
|
3 |
|
|
2 |
|
|
|
|
|
3 |
|
|
2 |
|
|
|
|
|
H |
|
OH |
|
|
|
|
H |
OH |
|
|
|||||
|
|
α форма |
|
|
|
|
|
|
β форма |
||||||||
196
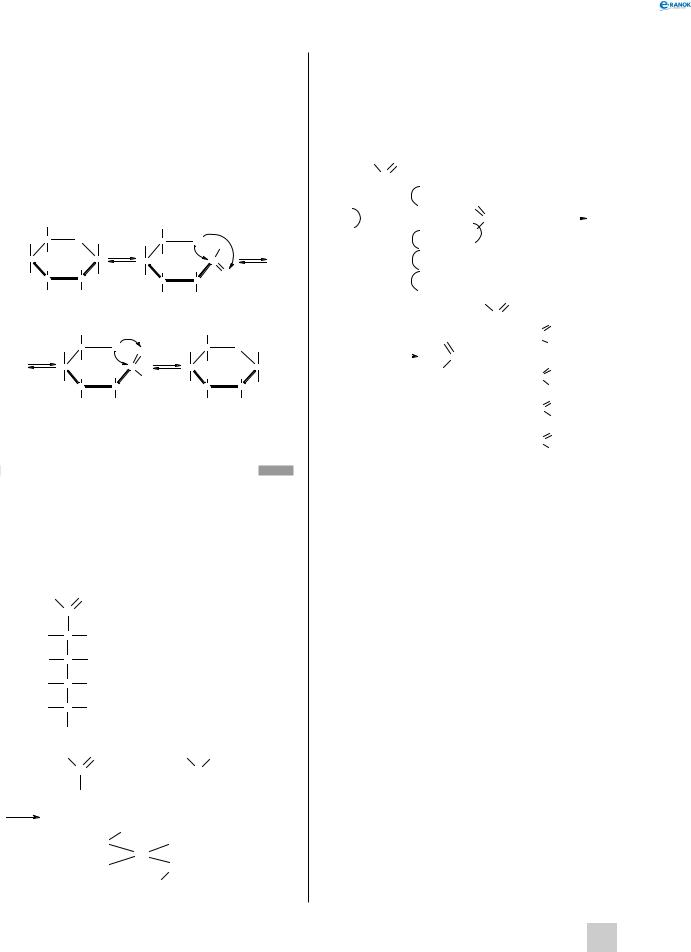
Між α - та β -формами також існує рівновага: вони постійно переходять одна в одну через проміжне утворення альдегідної форми. Припустімо, що молекула α -форми внаслідок рухливої рівноваги перетворюється в ланцюгову молекулу. Оскільки в ній відбувається обертання альдегідної групи за зв’язком C −C, то при наступному замиканні циклу гідроксильна група може виявитися вже в іншому положенні — з іншого боку кільця, у результаті утворюється β -форма. Цей процес відбувається за такою схемою:
|
6CH2OH |
|
|
|
6CH OH |
|
|
|
|
||
|
|
|
|
|
|
2 |
|
|
|
|
|
H 5C |
O |
H |
|
H 5C |
OH |
H |
|
|
|||
|
H |
|
|
|
|
H |
|
|
|
|
|
4C |
H |
C1 |
|
C |
H |
C |
|
|
|
||
|
OH |
|
|
4 |
OH |
1 |
O |
|
|
||
OH3C |
2C OH |
|
OH3C |
2C |
|
|
|
||||
|
|
|
|
|
|||||||
|
H |
OH |
|
|
|
H |
OH |
|
|
|
|
|
α форма |
|
|
|
|
|
|
|
|
|
|
|
|
6CHOH |
|
|
|
6CH OH |
|
||||
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
H 5C |
OH |
|
O |
|
H 5C |
|
O OH |
|||
|
C |
H |
H |
C |
|
|
C |
H |
|
H |
C1 |
|
4 |
OH |
1 |
H |
|
4 |
OH |
|
|||
|
OH3C |
2C |
|
|
OH3C |
|
2C H |
||||
|
|
|
|
|
|||||||
|
|
H |
OH |
|
|
|
|
H |
|
OH |
|
β форма
хімічні властивості глюкози
1. Комплексоутворення з купрум(ІІ) гід роксидом.
Оскільки глюкоза є багатоатомним спиртом, вона проявляє якісну реакцію на багатоатомні спирти: взаємодія зі свіжоосадженим купрум(ІІ) гідроксидом. Як і у випадку із гліцеролом, при цьому утворюється складна комплексна сполука.
H O
C
H C OH
2 HO C H + Cu(OH)2 
H C OH
H C OH
CH2OH
H O O H
C C
C
H |
|
|
|
|
|
C |
|
|
OH |
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
H |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
C |
|
|
|
H |
H |
|
|
|
|
|
|
C |
|
|
|
|
|
|
OH + H2O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
O |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
C |
|
|
|
|
O |
|
|
|
|
|
C |
|
|
|
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
Cu |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
C |
|
|
|
|
|
O |
|
|
|
|
C |
|
|
|
H |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
CH2OH |
|
|
|
CH2OH |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
2. Утворення естерів.
Як і всі спирти, глюкоза може вступати в реакцію естерифікації з кислотами. Причому як з органічними, так і з неорганічними.
На практиці часто використовують п’ятиоцтовий естер із глюкозою, реакцію утворення
якого можна записати так: |
|
|
|
|
||||||||||||||
H |
|
|
|
|
O |
|
|
|
|
|
||||||||
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C |
|
|
|
|
O H |
O |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H O |
|
|
C |
|
|
|
H + 5 C |
|
CH3 |
|
|
|||||||
|
|
|
|
|
|
H SO |
конц |
|||||||||||
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
2 4 |
||||
H |
|
|
|
|
|
C |
|
|
|
O H |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|
O H |
H |
|
|
|
|
|
|
O |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
CH2O H |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
O |
|
|||||
|
|
|
|
|
|
|
|
O |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
O |
|
|
|
|
C |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
C |
|
O |
|
|
|
|
|
C |
|
|
|
|
H |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
C |
|
|
|
|
|
O |
|
|
|
|
|
C CH |
3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
C |
|
|
|
O |
|
|
C CH |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
3 |
|
|
|
|
|
|
|
|
|
|
H |
|
|
C |
|
|
|
O |
|
|
|
|
C CH3 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
пентаацетилглюкоза 3. Відновлення глюкози з утворенням шес
тиатомного спирту — сорбіту:
CH2OH −(CHOH)4 −CHO +H2 →
→CH2OH −(CHOH) −CH2OH.
4.Окиснення глюкози купрум(ІІ)4 гідрокси дом або аміачним розчином аргентум гідроксиду:
CH2OH −(CHOH)4 −CHO +2Cu(OH)2 →
→ CH2OH −(CHOH)4 −COOH +2CuOH +H2O
або
CH2OH −(CHOH)4 −CHO + AgO →
→ CH2OH −(CHOH)4 −COOH +2Ag.
При цьому глюкоза (альдегідоспирт) окиснюється до глюконової кислоти (спиртокислота).
5. Бродіння глюкози.
Важливою хімічною властивістю глюкози є її бродіння під дією органічних каталізаторів — ферментів, які виробляють мікроорганізми. Відомо кілька видів бродіння. Спиртове бродіння використовують для добування спиртів. Хімізм спиртового бродіння, який відбувається під дією ферментів дріжджів, дуже складний. Сумарно він виражається рівнянням:
C6H12O6 бродіння→2C2H5OH +2CO2.
Під дією ферменту молочнокислих бактерій відбувається молочнокисле бродіння глюкози, при якому утворюється молочна кислота. Його
197
хімізм також досить складний. Сумарний процес може бути виражений таким рівнянням:
C6H12O6 →2C3H6O3 (або 2CH3 −CHOH −COOH).
Молочна кислота — це сполука із подвійною функцією — спиртокислота.
Молочнокисле бродіння має велике значення в переробці сільськогосподарських продуктів. З ним пов’язане добування цілого ряду молочних продуктів — кисляку, сиру, сметани, твердого сиру. Молочна кислота утворюється в процесі квашення капусти, силосування кормів і виконує при цьому консервувальну роль. Накопичуючись у щільно укладеній силосованій масі, вона сприяє утворенню кислотного середовища, в якому не можуть відбуватися процеси гниття білків та інші шкідливі біохімічні перетворення; це призводить до добування доброякісного, дуже поживного, соковитого корму для худоби.
застосування глюкози
Глюкозу застосовують в основному як поживну речовину. Її застосування тут розуміється дещо умовно, оскільки безпосередньо задля цієї мети вона використовується мало (як лікувальний засіб).
Основне значення глюкози як поживного засобу — в обміні речовин організму — енергетичне, тому що енергія утворюється в результаті екзотермічної реакції окиснення глюкози:
C6H12O6 +6O2 →6CO2 +6H2O +2920 кДж.
У процесі метаболізму глюкози повне окиснення відбувається не відразу, а ступінчасто. При цьому енергія виділяється поступово, малими порціями на кожній стадії (при поступовому виділенні тепло встигає розсіятися й не викликає ушкодження білків та інших чутливих до нагрівання речовин організму). Більша ж її частина йде на синтез аденозинтрифосфатної кислоти (АТФ), що є універсальним акумулятором енергії в організмі. За рахунок енергії, яка виділяється при наступному розпаді АТФ, організм і здійснює свої різноманітні функції (скорочення м’язів, секреція, синтез речовин тощо). Молекули АТФ потім знову утворюються при окисненні речовин, що надходять у клітини, й т. д.
Глюкозу використовують як зміцнювальний лікувальний засіб, тому що її дуже легко засвоює організм й тому що вона дає йому енергію.
Процес окиснення глюкози в клітинах проходить через десятки стадій, кожна з яких каталізується особливим ферментом. Усі ці стадії неможливо розглянути в школі (їх вивчають у курсах біохімії). Можна лише відзначити появу двох відомих вам речовин на шляху від глюкози до кінцевих продуктів окиснення:
C6H12O6 →CH3 −CHOH −COOH →
глюкоза |
молочна кислота |
|
→CH3 −COOH →CO2 +H2O |
|
оцтова кислота |
сахароза
Сахароза є представником дисахаридів, тому що її молекула складається із залишків двох вуглеводів — глюкози та фруктози:
CH2OH
H |
C |
O H |
HOCH |
O |
H |
|
H |
|
2 |
||
C |
C |
C H |
|
HO C |
|
|
OH |
H |
|
|
|
OH C |
C |
O C |
|
C CH OH |
|
|
|
|
|
|
2 |
|
H |
OH |
OH |
|
H |
Сахароза
Сахароза являє собою білу кристалічну речовину, без запаху, добре розчинна у воді, солодка на смак, температура плавлення +180 °С.
хімічні властивості сахарози
1. Комплексоутворення. Сахароза, як бага-
тоатомний спирт, реагує й з іншими гідроксидами металів, наприклад з кальцій гідроксидом з утворенням добре розчинного у воді кальцій сахарату:
C12H22O11 +Ca(OH)2 +H2O → C12H22O11 CaO 2H2O. 2. Гідроліз. Сахароза здатна піддаватися гід-
ролізу з утворенням двох вуглеводів, із залишків якої вона складається. Однак безпосередньо з водою вона не реагує, точніше, у звичайних умовах швидкість такої реакції незначна, але вона може бути прискорена каталітичною дією кислот:
C12H22O11 +H2O →C6H12O6 +C6H12O6 .
сахароза вода глюкоза фруктоза
Подібнеперетворенняздійснюєтьсяворганізмі бджіл: збираючи нектар із квітів, вони засвоюють сахарозу, яка потім гідролізується до глюкози й фруктози. Саме тому мед — це суміш рівних кількостей глюкози й фруктози (з домішкою інших природних речовин). Він солодший, аніж звичайний цукор, тому що містить багато фруктози (фруктоза солодша від сахарози в три рази, солодкість глюкози становить 2/3 від солодкості сахарози).
CH2OH
H |
C |
|
|
|
|
O |
|
|
H |
|
|
HOCH2 |
|
O |
|
H |
||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
C |
|
|
|
H |
|
|
C |
+ |
|
|
|
H |
|
|
HO |
|
|
|
|
|
||||||||||||
|
OH |
|
|
|
|
|
|
|
–Н2О |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
OH C |
|
|
|
C |
|
|
OH |
|
|
|
HO |
|
|
|
|
|
|
CH2OH |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
H |
|
|
|
OH |
|
|
|
|
|
OH |
H |
|
|
|
|
|
||||||||||||||
глюкоза |
|
|
|
|
|
|
CH2OH |
|
|
|
|
|
|
|
|
фруктоза |
||||||||||||||||
|
|
|
|
|
|
H |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
C |
|
|
|
H HOCH |
|
O |
|
|
H |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
C |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
C |
|
|
H |
C H |
|
|
HO C |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH C |
C |
|
|
O |
|
|
|
C |
|
|
|
C CH OH |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
OH |
|
|
2 |
||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|||||||||||
сахароза
198
