
- •Загальна хімія
- •Основні закони й поняття хімії
- •Предмет і завдання хімії
- •Місце хімії серед природничих наук
- •Фізичні та хімічні явища
- •Хімічна символіка. Знаки хімічних елементів та хімічні формули
- •Валентність
- •Визначення валентності за формулами хімічних сполук
- •Складання формул сполук з використанням валентності
- •Основні фізичні величини, які використовують у хімії
- •Основні кількісні закони хімії
- •Чисті речовини й суміші
- •Основні методи розділення сумішей
- •Перші спроби класифікації хімічних елементів
- •Періодичний закон Д. І. Менделєєва
- •Періодична система хімічних елементів
- •Будова атома
- •Склад атома
- •Ізотопи
- •Ядерні перетворення
- •Рух електронів в атомі. Орбіталі
- •Будова електронних оболонок та властивості хімічних елементів
- •Хімічний зв’язок і будова речовини
- •Умови виникнення хімічного зв’язку
- •Ковалентний зв’язок
- •Полярний і неполярний ковалентний зв’язок. Властивості хімічного зв’язку
- •Йонний зв’язок
- •Ступінь окиснення
- •Металічний зв’язок
- •Будова твердих речовин та їхні властивості
- •Хімічні реакції та закономірності їх перебігу
- •Класифікація хімічних реакцій
- •Тепловий ефект хімічної реакції. Термохімічні рівняння
- •Швидкість хімічної реакції
- •Каталіз і каталізатори
- •Хімічна рівновага
- •Розчини
- •Поняття про розчини
- •Розчинність. Кристалогідрати
- •Способи кількісного вираження складу розчинів
- •Електроліти та електролітична дисоціація
- •Сильні та слабкі електроліти
- •Йонні рівняння реакцій
- •Окисники й відновники
- •Електроліз розчинів та розплавів електролітів
- •Основні класи неорганічних сполук
- •Оксиди
- •Класифікація оксидів
- •Добування оксидів
- •Хімічні властивості оксидів
- •Кислоти
- •Хімічні властивості кислот
- •Добування кислот
- •Основи
- •Хімічні властивості основ
- •Добування основ
- •Витискувальний ряд металів
- •Генетичний зв’язок між класами неорганічних сполук
- •Хімія елементів
- •Гідроген. Водень. Вода
- •Гідроген
- •Вода
- •Галогени
- •Характеристика хімічних елементів
- •Прості речовини
- •Деякі сполуки галогенів
- •Оксигеновмісні кислоти хлору
- •Хлороводень і хлоридна кислота
- •Оксиген. Сульфур
- •Характеристика хімічних елементів
- •Прості речовини
- •Гідроген пероксид
- •Сірководень
- •Оксиди сульфуру
- •Сульфатна кислота
- •Сульфати
- •Нітроген. Фосфор
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування простих речовин
- •Амоніак
- •Оксиди нітрогену
- •Нітратна кислота
- •Нітрати
- •Кругообіг Нітрогену в природі
- •Оксиди Фосфору
- •Ортофосфатна кислота
- •Мінеральні добрива
- •Карбон. Силіцій
- •Характеристика хімічних елементів
- •Прості речовини
- •Хімічні властивості простих речовин
- •Методи добування простих речовин
- •Застосування вуглецю та кремнію
- •Оксиди карбону та силіцію
- •Карбонати
- •Силікати
- •Кругообіг карбону в природі
- •Загальна характеристика металів
- •Загальні фізичні властивості металів
- •Загальні хімічні властивості металів
- •Загальні способи добування металів
- •Корозія металів
- •Сплави. Доменне виробництво чавуну
- •Деякі представники металів
- •Загальна характеристика лужних металів
- •Натрій і калій
- •Кальцій
- •Алюміній
- •Ферум
- •Органічна хімія
- •Розмаїття і класифікація органічних речовин
- •Виникнення органічної хімії
- •Поняття про органічні речовини
- •Класифікація органічних сполук
- •Загальна характеристика органічних сполук
- •Порівняльна характеристика органічних і неорганічних сполук
- •Хімічна структура та хімічна будова
- •Брутто, структурні та електронні формули сполук
- •Явище ізомерії
- •Ізомери
- •Класифікація органічних сполук
- •Насичені вуглеводні. Алкани
- •Гомологічний ряд алканів
- •Ізомерія алканів
- •Номенклатура вуглеводнів
- •Будова алканів
- •Фізичні властивості алканів
- •Хімічні властивості алканів
- •Методи добування алканів
- •Алкени
- •Гомологічний ряд алкенів
- •Ізомерія алкенів
- •Номенклатура алкенів
- •Будова алкенів
- •Фізичні властивості алкенів
- •Добування алкенів
- •Хімічні властивості алкенів
- •Поняття про полімери
- •Гомологічний ряд алкінів
- •Ізомерія й номенклатура
- •Будова алкінів
- •Фізичні властивості алкінів
- •Добування алкінів
- •Хімічні властивості алкінів
- •Ароматичні вуглеводні (Арени)
- •Поняття про ароматичні сполуки
- •Будова бензену
- •Гомологічний ряд аренів
- •Номенклатура та ізомерія
- •Фізичні властивості аренів
- •Добування аренів
- •Хімічні властивості аренів
- •Правила орієнтації (заміщення) у бензеновому кільці
- •Природні джерела і застосування вуглеводнів
- •Спирти й феноли
- •Гомологічний ряд спиртів
- •Ізомерія та класифікація спиртів
- •Номенклатура спиртів
- •Фізичні властивості спиртів
- •Методи добування спиртів
- •Хімічні властивості спиртів
- •Застосування спиртів
- •Вплив спиртів на організм людини
- •Поняття про феноли
- •Фізичні властивості фенолу
- •Добування фенолів
- •Хімічні властивості фенолів
- •Застосування фенолу
- •Альдегіди
- •Поняття про альдегіди
- •Гомологічний ряд і номенклатура альдегідів
- •Фізичні властивості альдегідів
- •Хімічні властивості альдегідів
- •Добування альдегідів
- •Застосування альдегідів
- •Карбонові кислоти
- •Поняття про карбонові кислоти
- •Класифікація карбонових кислот
- •Гомологічний ряд і номенклатура карбонових кислот
- •Фізичні властивості карбонових кислот
- •Хімічні властивості карбонових кислот
- •Застосування карбонових кислот
- •Естери, жири та мило
- •Поняття про естери
- •Фізичні властивості та застосування естерів
- •Добування естерів та їхня номенклатура
- •Хімічні властивості естерів
- •Жири
- •Хімічні властивості жирів
- •Мило
- •Вуглеводи
- •Поняття про вуглеводи та їхня класифікація
- •Глюкоза
- •Хімічні властивості глюкози
- •Сахароза
- •Крохмаль і целюлоза
- •Штучні волокна
- •Нітрогеновмісні сполуки
- •Амінокислоти й білки
- •Номенклатура та ізомерія амінокислот
- •Фізичні властивості амінокислот
- •Хімічні властивості амінокислот
- •Добування амінокислот
- •Будова білків
- •Хімічні властивості білків
- •Біологічна роль білків
- •Нуклеїнові кислоти
- •Словник термінів
деякі представники металів
загальна характеристика лужних металів
Будова атомів лужних металів
У зовнішньому електронному шарі атоми лужних металів мають по одному електрону. У передзовнішньому електронному шарі в атома Літію 2 електрони, а в атомів інших металів по 8 електронів. Однакова будова не тільки зовнішнього, але й передостаннього електронного шару атомів усіх лужних металів, окрім Літію, обумовлює велику подібність властивостей цих елементів. Водночас збільшення заряду ядра й загального числа електронів в атомі зі збільшенням порядкового номера, збільшення числа електронних шарів (збільшення радіуса) спричиняє деякі відмінності в їхніх властивостях (збільшення легкості віддачі валентних електронів, посилення металічних властивостей).
Маючивзовнішньомуелектронномушарітільки по одному електрону, що перебуває на порівняно великій відстані від ядра, атоми цих елементів досить легко віддають електрон, тобто характеризуються низькою енергією йонізації. Утворювані при цьому однозарядні позитивні йони мають стійку електронну структуру відповідного інертного газу ( Li+ → He ; Na+ → Ne тощо). Легкість віддачі зовнішніх електронів характеризує розглядані елементи як найбільш типових представників металів: металічні властивості в лужних металів виражені дуже чітко.
загальні фізичні властивості лужних металів
Усі лужні метали мають кубічну об’ємно-цен- тровану кристалічну ґратку, яка не є щільно упакованою (атоми займають у ній лише 68% наявного об’єму), тому всі лужні метали — легкі. Вони мають металічний блиск на свіжому зрізі металу.
Лужні метали характеризуються незначною твердістю, малою густиною, низькими температурами кипіння й плавлення, що пояснюється слабкими хімічними зв’язками в кристалічних ґратках цих металів.
загальні хімічні властивості лужних металів
Лужні метали належать до числа найбільш активних у хімічному відношенні елементів. На свіжому зрізі лужні метали мають блискучу поверхню, однак, вступаючи в контакт із киснем повітря, вони окиснюються й швидко тьмяніють, тому в разі потреби їх зберігають під шаром гасу. Усі лужні метали горять в атмосфері повітря, утворюючи оксиди одного або кількох типів — нормальні оксиди складу Ме2О, пероксиди складу
Ме2О2 та супероксиди МеО2. При цьому тільки літій згорає на повітрі з утворенням оксиду:
4Li +O2 = 2Li2O,
а інші лужні метали утворюють пероксиди й супероксиди (або їхню суміш):
3Na +2O2 = Na2O2 +NaO2 .
Оксиди Натрію й Калію можуть бути отримані тільки при нагріванні суміші пероксиду з надлишком металу за відсутності кисню:
K2O2 +2K = 2K2O.
Легко віддаючи в хімічних реакціях свої валентні електрони, лужні метали є енергійними відновниками. Усі лужні метали сполучаються з воднем при нагріванні, утворюючи гідриди:
2Me +H2 = 2MeH.
При взаємодії з галогенами, сіркою, азотом, фосфором, вуглецем та кремнієм утворюються відповідно галогеніди, сульфіди, нітриди, фосфіди, карбіди та силіциди.
При взаємодії лужних металів з водою утворюються луги й водень:
2Me +2H2O = 2MeOH +H2.
Активність металів зростає згори вниз за групою. Із кислотами всі лужні метали реагують із вибухом, тому такі реакції спеціально не проводять. Солі лужних металів розчиняються у воді, за винятком деяких солей Літію: фториду, карбона-
ту та фосфату.
Якщо внести в полум’я газового пальника сіль лужного металу, то вона розкладається, і пари вивільненого металу забарвлюють полум’я в характерний для даного металу колір. Калій забарвлює полум’я у фіолетовий колір, Натрій — у жовтий, а Літій — у малиновий. Леткі солі Рубідію та Цезію забарвлюють безбарвне полум’я пальника в рожево-фіолетовий колір.
натрій і калій
поширеність у природі
Зі сполук лужних металів широко розповсюджені в природі лише сполуки Натрію й Калію. У вигляді простих речовин у природі вони не зустрічаються, тому що занадто активні.
Найважливішими природними сполуками Натрію й Калію є: натрій хлорид (NaCl), натрій сульфат — мірабіліт (Na2SO4 10H2O), сильвініт
(NaCl KCl), карналіт (KCl MgCl2 6H2O). Сполуки інших лужних металів зустрічаються дуже рідко. Францій отриманий штучно в ядерних реакціях.
добування натрію й калію
Лужні метали надзвичайно активні і є найсильнішими серед відомих відновників, тому електроліз водних розчинів солей цих металів не призводить до добування самих металів, а лише до утворення лугів. Прості речовини добувають
151

електролізом розплавів їхніх галогенідів, найчастіше — хлоридів, що утворюють природні мінерали. Металічний натрій у промисловості добувають електролізом розплаву натрій хлориду з інертними (графітними) електродами.
Фізичні властивості натрію й калію
Натрій і калій — сріблясто-білі метали, що мають добру електропровідність; м’які, легші від води (плавають на її поверхні, реагуючи з нею).
хімічні властивості натрію й калію
Натрій і калій активно взаємодіють із галогенами:
2Na +Cl2 →2NaCl;
2K +Br2 →2KBr .
На повітрі натрій і калій активно згорають. Причому продуктом реакції є не оксиди, а пероксиди або надпероксиди:
2Na +O2 → Na2O2 ;
K +O2 → KO2 .
Як і всі лужні метали, натрій і калій активно взаємодіють із водою з утворенням водню та відповідних лугів. Калій найчастіше при такій взаємодії вибухає:
2Na +2H2O →2NaOH +H2 .
застосування сполук натрію й калію
Натрій та його сплав з калієм застосовують як рідкометалеві теплоносії. У металургії натрійметричним методом добувають низку тугоплавких металів, а відновлюючи натрієм KOH, виділяють калій. Окрім того, натрій використовують як зміцнювальну добавку свинцевих сплавів. В органічному синтезі натрій використовують для добування багатьох речовин. Він слугує також каталізатором при добуванні деяких органічних полімерів. Із ртуттю натрій утворює твердий сплав — амальгаму натрію, яку іноді використовують як більш м’який відновник замість чистого металу. Натрій гідроксид застосовують для очищення продуктів переробки нафти, у миловарній, паперовій, текстильній та інших галузях промисловості, а також при виробництві штучного волокна.
Калій потрібен у значній кількості для живлення рослин, тому його широко використовують як добриво у вигляді нітрату. Поташ K2CO3 використовують при виробництві скла та рідкого мила.
кальцій
характеристика хімічного елемента
Кальцій перебуває в головній підгрупі II групи, належить до лужноземельних металів разом з Барієм та Стронцієм. У зовнішній оболонці він
має два електрони й може легко віддавати їх, утворюючи йони зі стійкими конфігураціями інертних газів.
поширеність у природі
Кальцій має велику хімічну активність, тому зустрічається в природі тільки у вигляді сполук. Найважливіші природні сполуки Кальцію: а) вапняк, мармур, крейда (CaCO3); б) гіпс
(CaSO4 2H2O); в) фосфорит і апатит (Ca3 (PO4 )2 ); г) доломіт (CaCO3 MgCO3).
Фізичні властивості
Кальцій — метал сріблясто-білого кольору, дуже легкий, як і лужні метали, але значно твердіший за них і має більш високу температуру плавлення (+851 °С). Кальцій зберігають під шаром гасу.
добування
Кальцій добувають шляхом електролізу його розплавленого хлориду.
CaCl2 ел. струм→Ca +Cl2.
хімічні властивості
O2  CaO
CaO
C, t°  CaC2
CaC2
Hal  CaCl2
CaCl2
H2 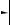 CaH2
CaH2
|
+ |
|
S, t° |
|
|
|
|
|
|
CaS |
|||
Ca |
||||||
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
N2, t°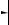 Ca3N2
Ca3N2
P, t°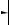 Ca3P2
Ca3P2
H2O 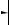 Ca(OH)2 + H2↑
Ca(OH)2 + H2↑
HCl  CaCl2 + H2↑
CaCl2 + H2↑
застосування
Найважливішою сполукою Кальцію є його карбонат СаCO3. Він являє собою основну складову частину вапняку, мармуру, крейди, а також входить до складу доломіту (MgCO3 СаCO3). Кальцій карбонат використовують у виробництві цементу, сталі, скла. Кальцій та кальцій карбід застосовують в органічній хімії. А ще Кальцій відіграє дуже важливу роль у біохімічних процесах, які протікають у живих організмах.
152
алюміній
характеристика хімічного елемента
Алюміній перебуває в головній підгрупі III групи, належить до рідкісноземельних металів. На його зовнішньому електронному шарі міститься три електрони, які він здатний віддавати.
Порівнюючи Алюміній з іншими елементами цієї підгрупи, можна відзначити неметалічність Бору, який стоїть після Берилію в періоді, металічні властивості Галію, із чого можна припустити амфотерності сполук Алюмінію, тобто проміжних (від металічних до неметалічних) властивостей цього елемента.
поширеність у природі
Алюміній — найпоширеніший метал на Землі (3-тє місце серед усіх елементів; 8% складу земної кори). У вигляді простої речовини він у природі не зустрічається; входить до складу багатьох сполук, які утворюють ґрунт: глиноземів (Al2O3) та бокситів (Al2O3 xН2O).
Фізичні властивості
Алюміній — сріблясто-білий метал. Він ковкий, легко витягується в дріт, tпл = +660 °С, tкип = +2520 °С. При кімнатній температурі алюміній не змінюється на повітрі, тому що його поверхня покрита тонкою оксидною плівкою, яка характеризується сильною захисною дією.
хімічні властивості
1) Взаємодія з киснем.
Алюміній є активним металом, тому на повітрі швидко реагує з киснем. Але перетворенню піддається тільки та частина алюмінію, яка перебуває на поверхні зразка, тому що продукт взаємодії — алюміній оксид — утворює щільну оксидну плівку:
4Al +3O2 = 2Al2O3 . 2) Взаємодія з галогенами.
Порошкоподібний алюміній активно взаємодіє з йодом за звичайних умов у присутності каталітичної кількості води:
2Al +3I2 = 2AlI3. 3) Взаємодія з сіркою:
2Al +3S = Al2S3 . 4) Взаємодія з водою.
Незважаючи на високу хімічну активність, з водою алюміній не взаємодіє. У першу чергу, завдяки захисній плівці, а також тому, що продукт взаємодії алюмінію з водою — нерозчинна речовина.
5) Взаємодія з кислотами.
Аналогічно до всіх активних металів алюміній витісняє водень із розчинів кислот:
2Al +6HCl = 2AlCl3 +3H2 ; 2Al +3H2SO4 = Al2 (SO4 )3 +3H2 .
6) Взаємодія з лугами.
Завдяки тому, що алюміній утворює амфотерні сполуки, він також здатний витісняти водень із розчинів лугів:
2Al +2NaOH +6H2O →2NaAl(OH)4 +3H2 .
добування алюмінію
Алюміній є одним із багатотоннажних продуктів металургійної промисловості. Його добувають у величезних кількостях, тому що він
єцінним матеріалом і реагентом. У сучасній металургії алюміній добувають електролізом бокситів (алюміній оксиду). Оскільки сам алюміній оксид
єдуже тугоплавкою речовиною, для зменшення енерговитрат у боксит додають плавиковий шпат (кальцій фторид), що знижує температуру плавлення руди.
застосування алюмінію
Алюміній є цінним конструкційним матеріалом. Маючи відносну легкість (густина алюмінію набагато легша, ніж у сталі), він є досить міцним металом. Його використовують для виготовлення легких конструкцій, у сплаві з магнієм для обшивки літаків тощо. З алюмінію виготовляють столові прибори й посуд. У великих кількостях алюміній використовують у металургії для добування металів алюмотермічним способом.
Ферум
властивості хімічного елемента
Ферум належить до металічних елементів. За будовою електронної оболонки його відносять до d-елементів, тому що в нього відбувається заповнення електронами d-підрівня.
Здебільшого Ферум виявляє ступінь окиснення +2 (за рахунок двох електронів зовнішнього рівня) або +3 (віддаючи ще один електрон з передзовнішнього рівня). Ступінь окиснення +3 для Феруму більш стабільний, оскільки передзовнішній d-підрівень у цьому разі стає наполовину заповненим, що є більш вигідним. Ферум є досить активним елементом. У хімічних реакціях він проявляє здебільшого металічні властивості.
26 |
Fe0 |
4 ↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3↑↓ |
|
|
|
|
|
f |
|||||||||||
|
|
↑↓↑↓↑↓ |
|
↑↓↑↑ |
|
↑ |
↑ |
|
|
|
|
||||||||
|
|
2↑↓ |
|
|
|
|
d |
|
|
|
|
|
|
|
|
||||
|
|
↑↓↑↓↑↓ |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
1↑↓ |
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
153
26 |
Fe+2 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
f |
|||||
|
|
↑↓ |
|
↑↓↑↓↑↓ |
|
↑↓ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|||||||||
|
|
2 |
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|||
|
|
↑↓ |
|
↑↓↑↓↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
1 |
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
26 |
Fe+3 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
f |
||||
|
|
↑↓ |
|
↑↓↑↓↑↓ |
|
↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
||
|
|
↑↓ |
|
↑↓↑↓↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
1 |
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У виняткових випадках Ферум може віддавати шість електронів і виявляє ступінь окиснення +6. Однак такі сполуки, в яких міститься Fe+6, зустрічаються досить рідко.
поширеність у природі
Ферум є одним з найпоширеніших елемен- тів-металів на Землі. У земній корі 5% маси припадає на атоми Феруму. Тільки Алюмінію в літосфері міститься більше (8,13%).
Уприроді Ферум зустрічається у вигляді сполук. Найпоширеніші сполуки Феруму — оксиди:
ферум(II) оксид FeО, ферум(III) оксид Fe2O3, а також змішаний оксид Fe3O4, який іще називають залізною окалиною. Сполуки тривалентного Феруму мають колір — від жовтого до бурого, залежно від складу. Саме вони надають жовтуватого кольору піску та бурого забарвлення багатьом ґрунтам.
Ферум входить до складу великої кількості різних мінералів у вигляді оксидів, сульфідів та сполук з іншими елементами. Зазвичай ці речовини розсіяні в земній корі, але зустрічаються
йскупчення мінералів. Ці скупчення є джерелом залізної руди, з якої потім добувають залізо.
Сполуки Феруму розчинені у водах деяких мінеральних джерел. Наявність у воді сполук двовалентного Феруму надає їй присмаку металу. Іноді у водопровідній воді, яка тече по старих іржавих трубах, розчинені сполуки тривалентного Феруму, що надає воді кольору іржі.
Атоми Феруму також є складовою частиною багатьох живих організмів: в організмі дорослої людини міститься близько 4—5 г атомів Феруму. Він входить до складу деяких вітамінів, білків, зокрема гемоглобіну — речовини, завдяки якій кров може переносити кисень по організму й виводити вуглекислий газ.
Увигляді простої речовини залізо входить до складу деяких метеоритів. Іноді зустрічаються
злитки самородного заліза, хоча більшість учених вважають, що вони теж мають «метеоритне» походження.
Фізичні властивості заліза
Залізо є речовиною з немолекулярною будовою. У звичайних умовах залізо являє собою метал сірого кольору з металічним блиском, добре проводить електричний струм і теплоту. Залізо є досить пластичним металом і добре піддається куванню. Температура плавлення заліза +1540 °С, густина 7,87 г/см3. Як і багато інших металів, залізо не розчиняється у воді та в інших розчинниках, але розчиняється в ртуті.
Залізо притягується магнітом, тобто є парамагнетиком. Для заліза також характерне явище феромагнетизму — воно зберігає намагніченість після усунення зовнішнього магнітного поля. Завдяки цьому із заліза можна виготовляти магніти, а також матеріали для запису інформації.
хімічні властивості заліза
Залізо досить активно вступає в хімічні взаємодії. Оскільки залізо має явні металічні властивості, то воно вступає переважно в реакції з неметалами.
Залізо активно вступає у взаємодію з киснем навіть у звичайних умовах. При нагріванні заліза на повітрі його поверхня покривається залізною окалиною:
3Fe +2O2 → Fe3O4 .
Якщо розжарений залізний дріт помістити в посудину, заповнену чистим киснем, то залізо спалахне, розкидаючи яскраві іскри.
Залізо може активно згорати навіть на повітрі. Однак це можливо тільки тоді, коли залізо подрібнене до дуже дрібного порошку, його називають пірофорним залізом. Якщо такий порошок потрапляє в повітря, то він яскраво спалахує навіть при кімнатній температурі. Подрібнити залізо до дрібного порошку звичайними методами неможливо. Це роблять за допомогою хімічних методів.
Залізний дріт також дуже активно згорає, якщо його помістити в посудину, наповнену хлором. При цьому утворюється ферум(III) хлорид:
2Fe +3Cl2 →2FeCl3 .
Залізо також активно взаємодіє із сіркою. У результаті цієї реакції утворюється ферум(II) сульфід:
Fe +S → FeS.
Залізо здатне реагувати з водою. При пропусканні перегрітої пари через розжарені залізні ошурки залізо перетворюється в залізну окалину й при цьому виділяється водень:
3Fe +4H2O t→Fe3O4 +4H2 .
У звичайних умовах залізо активно реагує з кислотами. При цьому утворюються солі, до яких Ферум входить зі ступенем окиснення +2:
Fe +H2SO4 → FeSO4 +H2 .
154

Ферум також здатен витісняти менш активні метали з розчинів солей:
Fe +CuSO4 → FeSO4 +Cu.
Зі ступенем окиснення +3 він може проявляти амфотерні властивості. Це можна довести тим, що ферум(III) гідроксид розчиняється в гарячому концентрованому лузі:
Fe(OH)3 +NaOH = Na Fe(OH)4 .
Амфотерні властивості Феруму проявляються значно слабше, ніж в Алюмінію, тому що алюміній гідроксид розчиняється в лугах у звичайних умовах, а ферум(III) гідроксид — при нагріванні й за умови високої концентрації лугу.
застосування заліза
Залізо є одним із семи найстаріших металів — металів, відомих людству з давніх часів. Унаслідок високої хімічної активності самородне залізо (тобто у вигляді простої речовини) на Землі не зустрічається. Люди навчилися добувати залізо на початку першого тисячоліття до нашої ери. Звідтоді почався залізний вік розвитку нашої цивілізації. Хоча в археологічних розкопках іноді зустрічаються залізні вироби, датовані другим і третім тисячоліттям до нашої ери, це так зване космічне залізо — уламки залізних метеоритів, які впали на Землю.
Залізо є набагато твердішим металом, аніж мідь, тому знаряддя праці та зброю для полювання було зручніше виготовляти саме з нього. Однак для добування заліза необхідна більш висока температура вогню, ніж для добування міді. І хоча міді в земній корі міститься приблизно в 1000 разів менше, ніж заліза, її було простіше виплавляти й обробляти. Отож першим металом, який почали обробляти люди, була мідь, а не залізо.
Залізо здебільшого використовують у вигляді сплавів: чавуну й сталі. Чавун за фізичними властивостями посутньо відрізняється від заліза: він набагато твердіший і крихкіший. Саме тому чавун не піддається куванню, однак із нього виходять предмети, які можуть витримувати великі механічні навантаження. Раніше з нього виплавляли гармати та ядра й навіть посуд. Зараз із чавуну роблять станини для верстатів, лещата та інші вироби, для яких більше важить механічна міцність, а не пластичність. Такі вироби дуже бояться ударів, від сильного удару чавун розбивається.
Широко розповсюджена іржостійка сталь, її добувають додаванням у сталь нікелю й хрому, а для добування зносостійкої сталі додають марганець (таку сталь використовують для виготовлення залізничних рейок).
